 |

|

|
| 小児・AYA世代上衣腫ガイドライン
|

|
| 目 次:各メニューをクリックすると該当項目にリンクします。
|

|
| |
|
| |
|

|
| (Ⅰ)ガイドラインサマリー
|

|
| |
| |
<課題1:手術摘出>
|
| |
CQ1 |
: |
肉眼的全摘出は生命予後を改善するか?
|
| |
推奨 |
: |
生命予後の改善が期待できるので肉眼的全摘出を強く推奨する。(推奨度 1C)
|

|
| |
<課題2:放射線治療>
|
| |
CQ2 |
: |
3歳以上の症例に放射線治療は有用か?
|
| |
推奨 |
: |
摘出術後に腫瘍が残存した上衣腫 (WHO grade Ⅱ)・退形成性上衣腫の症例に対しては、摘出術後に放射線治療を行うことを強く推奨する。 (推奨度 1C)
肉眼的に全摘出された退形成性上衣腫の症例に対しては、摘出術後に放射線治療を行うことを弱く推奨する。 (推奨度2C)
|
| |
CQ3 |
: |
3歳未満の症例に放射線治療は有用か?
|
| |
推奨 |
: |
3歳未満の症例に対しては、放射線治療を回避するか、できるだけ長期の開始遅延を目指すことを弱く推奨する。 (推奨度2C) |
| |
CQ4 |
: |
全脳全脊髄照射は有用か?
|
| |
推奨 |
: |
脊髄播種のない症例に対しては、全脳全脊髄照射を施行しないことを強く推奨する。 (推奨度1C)
脊髄播種を有する症例に対しては、全脳全脊髄照射を施行することを強く推奨する。 (推奨度1D)
|

|
| |
<課題3:化学療法>
|
| |
CQ5 |
: |
化学療法は推奨されるか?
|
| |
推奨 |
: |
3歳以上症例に対して
1)摘出術後に化学療法を行わないことを弱く推奨する。(推奨度2C)
2)二期的摘出を前提とした化学療法を行うことを弱く推奨する。(推奨度2C)
3歳未満症例に対して
乳幼児に対する放射線治療による晩期合併症を軽減するために、放射線治療時期を遅延させる目的で化学療法を先行することを弱く推奨する。(推奨度2C)
|

|
| |
<課題4:再発時の治療>
|
| |
CQ6 |
: |
再発時の適切な治療法は何か?
|
| |
推奨 |
: |
再手術
再発時に再摘出術を行うことを弱く推奨する。(推奨度2D)
放射線治療
再発時に再照射を行うことを弱く推奨する。(推奨度2C)
化学療法
化学療法は行わないことを弱く推奨する。(推奨度2C)
|
|

|
| 目次へ戻る!
|

|
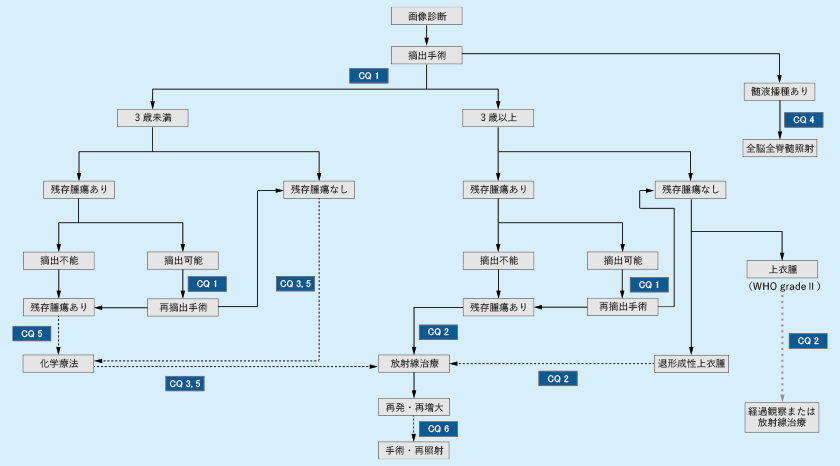
| (Ⅱ)上衣腫診療アルゴリズム
|

|
| |
各CQについて、実線は「強い推奨」を、破線は「弱い推奨」を意味する。CQ2の灰色の破線は他の破線と意味が異なり、推奨できる治療方針が未確定であることを意味する。
|
| |
|
| 目次へ戻る!
|

|
| (Ⅲ)略語一覧
|

|
| |
| AIEOP |
Associazione Italiana di Ematologia ed Oncologia Pediatrica |
|
| AT/RT |
atypical teratoid/rhabdoid tumor |
|
| AYA |
adolescent and young adult |
|
| cIMPACT-NOW |
The Consortium to Inform Molecular and Practical Approaches to CNS tumor Taxonomy - Not Official WHO |
|
| COG |
Children Oncology Group |
米国小児がんグループ |
| CR |
complete response |
完全奏効 |
| CSI |
craniospinal irradiation |
全脳全脊髄照射 |
| CSS |
cause specific survival |
補正生存率 |
| CTCAE |
Common Terminology Criteria for Adverse Events |
有害事象共通用語規準 |
| CTV |
clinical target volume |
臨床標的体積 |
| EANO |
European Association of Neuro-Oncology |
欧州神経腫瘍学会 |
| EFS |
event free survival |
無イベント生存率 |
| EMA |
epithelial membrane antigen |
|
| GFAP |
glial fibrillary acidic protein |
|
| GTR |
gross total resection |
|
| IDH |
isocitrate dehydrogenase |
|
| IQ |
Intelligence Quotient |
|
| LCR |
locoregional control rate |
|
| MRI |
magnetic resonance imaging |
磁気共鳴画像診断 |
| NCDB |
National Cancer Database |
|
| OS |
overall survival |
全生存期間 |
| PFA |
posterior fossa type A |
|
| PFB |
posterior fossa type B |
|
| PFS |
progression-free survival |
無増悪生存期間 |
| POG |
Pediatric Oncology Group |
米国小児がんグループ |
| PR |
partial response |
部分奏効 |
| QOL |
quality of life |
生活の質 |
| SEER |
The Surveillance, Epidemiology, and End Results |
|
| SFOP |
French Society of Pediatric Oncology |
フランス小児がん学会 |
| SIOP |
International Society of Paediatric Oncology |
欧州小児がんグループ |
| SRS |
stereotactic radiosurgery |
定位的放射線手術 |
| UKCCSG/SIOP |
United Kingdom Children's Cancer Study Group/ Societe Internationale D’oncologie Pediatrique |
英国小児がんグループ/ 国際小児腫瘍協会 |
| WHO |
World Health Organization |
世界保健機関 |
|

|
| 目次へ戻る!
|

|
| (Ⅳ)作成組織・作成方針
|

|
| 1. 作成組織
|

|
| |
1.1. 作成主体
|

|
| |
|
共通目次と共通項目参照
|

|
| |
1.2. 診療ガイドライン作成グループ
|

|
| |
上衣腫診療ガイドライン作成グループ
|
| |
|
| 役 割 |
氏 名 |
所属機関 |
担 当 |
| 委員長 |
宇塚 岳夫 |
獨協医科大学 脳神経外科 |
総括
|
| 副委員長 |
隈部 俊宏 |
北里大学 脳神経外科 |
他のガイドラインとの整合性 |
| 協力委員 |
前林 勝也 |
日本医科大学付属病院 放射線治療科 |
放射線治療 |
| 協力委員 |
原 純一 |
大阪市立総合医療センター小児医療センター 小児血液腫瘍科 |
化学療法
|
| 協力委員 |
坂本 博昭 |
大阪市立総合医療センター小児医療センター 小児脳神経外科 |
手術療法 |
| 協力委員 |
師田 信人 |
北里大学 脳神経外科 |
化学療法 |
| 委 員 |
夏目 敦至 |
名古屋大学 脳神経外科 |
再発時の治療 |
| 委 員 |
橋本 直哉 |
京都府立医科大学 脳神経外科 |
手術療法 |
| 委 員 |
杉山 一彦 |
広島大学病院 がん化学療法科 |
他のガイドラインとの整合性 |
|

|
| |
1.3. システマティックレビューチーム(SR チーム)
|

|
| |
|
| 課題番号 |
課題名 |
課題担当者 |
SR |
| 1 |
手術摘出 |
坂本博昭
橋本直哉 |
柴原一陽 (北里大学 脳神経外科)
國廣誉世 (大阪市立総合医療センター小児医療センター 小児脳神経外科)
小川隆弘 (京都府立医科大学 脳神経外科)
|
| 2 |
放射線治療 |
前林勝也 |
太田篤 (新潟大学 放射線科)
斎藤紘丈 (新潟大学 放射線科)
中野智成 (新潟大学 放射線科)
棗田学 (新潟大学 脳神経外科)
岡田正康 (新潟大学 脳神経外科)
渡邉潤 (新潟大学 脳神経外科)
栗林茂彦 (東京女子医科大学 放射線腫瘍学講座)
秋本裕義 (日本医科大学付属病院 放射線治療科)
|
| 3 |
化学療法 |
原純一
師田信人 |
吉藤和久 (北海道立子ども総合医療・療育センター 脳神経外科)
藤崎弘之 (大阪市立総合医療センター 小児血液腫瘍科)
|
| 4 |
再発時の治療 |
夏目敦至 |
大岡史治 (名古屋大学 脳神経外科) |
|

|
| 目次へ戻る!
|

|
| 2. 作成過程
|

|
| |
2.1. 作成方針
|

|
| |
|
小児・AYA世代上衣腫に対するエビデンスを整理し、診療アルゴリズムと診療ガイドラインを示すことによって、上衣腫患者の生命予後と機能予後の改善を目的とする。
|

|
| |
2.2. 使用上の注意
|

|
| |
|
共通目次と共通項目参照
|

|
| |
2.3. 利益相反
|

|
| |
|
共通目次と共通項目参照
|

|
| |
2.4. 作成資金
|

|
| |
|
共通目次と共通項目参照
|

|
| |
2.5. 組織編成
|

|
| |
|
ガイドライン統括委員会:ガイドライン作成を統括する脳腫瘍診療拡大ガイドライン委員会は、2009年11月に日本脳腫瘍学会の内部組織として設置され、当時の理事と協力委員2名で構成された。その後、日本脳腫瘍学会の新理事が委員として加わった。また、対象疾患毎に関連学会から協力委員の参加を得ている。
ガイドライン作成グループ:脳腫瘍診療拡大ガイドライン委員会から選出された8名によって構成されている。
システマティックレビューチーム:重要臨床課題ごとに作成グループがシステマティックレビュー(SR)チームのリーダーとなり、リーダーよりSR委員を選出してもらい、各課題1-4名で編成した。上衣腫が稀少疾患であることを踏まえて、各チーム一人ずつガイドライン委員が兼任することとした。
|

|
| |
2.6. 作成過程
|

|
| |
|
準備:2014年3月上衣腫診療ガイドラインWGが発足。委員長及び担当者を決定した。
スコープ:WG委員で検討を繰り返し、作成した。
システマティックレビュー:各CQに担当者を募り、リーダーとなるWG委員と相談しながらエビデンスを収集した。
2014年3月version 1.0を作成.
2015年1月 version 2.0を作成.
2016年2月 version 3.0を作成.
2016年8月 version 4.0を作成.
2020年9月 version 5.0を作成.
2020年10月 version 6.0を作成.
2020年12月 version 7.0を作成.
2021年1月 version 8.0を作成.
2021年3月 version 9.0 (最終版)を作成.
作成グループ会議:2014年3月から2019年12月の期間は、年間2回程度の日程でWG会議を行った。2020年6月からは毎月1回オンライン会議を行った。
推奨作成とその過程:021年1月と2月にWG内における推奨グレードの投票を行った。最終的にはオンライン会議にて討論し、WG内での意見が一致した状態で推奨グレードを提案した。
その他、共通目次と共通項目参照にも追加記載あり。
公開:2021年9月ホームページ上に公開した。
|

|
| |
2.7. 推奨の強さの提示方法・エビデンスレベル・推奨度(臨床的意義)について
|

|
| |
|
共通目次と共通項目参照
|

|
| |
2.8.外部評価を求めた団体・委員
|

|
| |
|
共通目次と共通項目参照
|

|
| 3.公開後の取り組み
|

|
| |
|
共通目次と共通項目参照
|

|
| 4.脳腫瘍ガイドライン拡大委員会(ガイドライン統括委員会)組織構成
|

|
| |
|
共通目次と共通項目参照
|

|
| 5.日本脳腫瘍学会 脳腫瘍診療ガイドライン作成事務局
|

|
| |
|
共通目次と共通項目参照
|

|
| 目次へ戻る!
|

|
| (Ⅴ)スコープ
|

|
| 小児・AYA世代上衣腫の基本的特徴
|

|
| |
はじめに
|

|
| |
|
2021年に出版が予定されているWHO脳腫瘍分類第5版において、The Consortium to Inform Molecular and Practical Approaches to CNS tumor Taxonomy - Not Official WHO (cIMPACT-NOW) update 7 1)の提言に基づき、上衣腫の分類は大幅に改訂されることが予想されている。一方臨床の現場ではWHO脳腫瘍分類改訂第4版による分類が広く行われていると考えられるため、本ガイドラインでは新分類を視野に入れつつ、用語などはWHO脳腫瘍分類改訂第4版 (以後WHO2016) 2)に準拠するものとする。
使用する「上衣腫」に関連する用語の定義は以下の如くである。WHO2016 2)に記載されているEpendymal tumoursを「上衣系腫瘍」と表記する。「上衣腫」とのみ表記する場合は、WHO2016 2)における上衣腫 (ependymoma, WHO grade Ⅱ)・ependymoma, RELA fusion-positive (WHO grade Ⅱ/Ⅲ)・退形成性上衣腫 (anaplastic ependymoma, WHO grade Ⅲ)を含むものとする。狭義のWHO grade Ⅱの上衣腫を示す場合は、「上衣腫 (WHO grade Ⅱ)」と表記することとする。上衣腫のgradingの記載については、前述のcIMPACT-NOW1)では、Ⅰ-Ⅳのローマ数字ではなく、1-4のアラビア数字で記載している。これらは今後のWHO分類にも採用されるものと思われるが、現在のWHO脳腫瘍分類の表明とは異なるため、本ガイドラインではローマ数字I-IVのgradingで記載することとした。
本ガイドラインは「小児・AYA世代」患者の診療を行う医療者を主な対象としている。上衣腫において、小児期から成人期にかけて明確な腫瘍の性状の違いは無いが、小児期からの切れ目のない継続医療(移行期医療)が必要と考えられるためである。
|

|
| |
疫学的特徴
|

|
| |
|
上衣腫は脳室壁や脊髄中心管を構成する上衣細胞 (ependymal cell) への分化を示す腫瘍である。脳腫瘍全国集計調査報告3)では、上衣腫の頻度は原発性脳腫瘍の1%と稀な腫瘍である。年齢層は乳幼児から高齢者まで、幅広く認められることが特徴である。年齢層別にみると、0-29歳では全脳腫瘍の7.0%、0-4歳までに限ると20.2%を占め、特に乳幼児では重要な腫瘍である。
発生部位は脳室系に関係していることが多く、成人ではテント上、小児では第四脳室発生が多い。テント上では脳室系と無関係な脳実質内に発生することもある。テント上発生が30%程度、後頭蓋窩発生が60%程度、脊髄発生が10%程度と報告されている 2)。
脊髄腫瘍としての上衣腫は頻度が高く、成人の脊髄神経膠腫の約半分を占めるが、小児では稀である。脊髄上衣腫は神経線維腫症II型に合併する症例もしばしば見られ、脊髄円錐と馬尾には粘液乳頭状上衣腫が高頻度にみられるなど、頭蓋内上衣腫とは異なる臨床的・生物学的特徴をもつため、脊髄上衣腫は本ガイドラインでは扱わない。
|

|
| |
画像所見
|

|
| |
|
脳室内の境界明瞭な腫瘍として描出されることが多い。Magnetic resonance imaging (MRI) T1強調画像では低信号、T2強調画像では高信号を呈することが多く、造影効果は様々な程度で認められる。腫瘍内部には石灰化や嚢胞、腫瘍内出血などがしばしば認められ、内部が不均一であることも特徴の一つである。脳実質への広汎な浸潤や周囲の強い脳浮腫を来すことは稀である。小児では第四脳室に好発し、外側孔 (Luschka孔)から小脳橋角部へ進展する症例も認められる。また脳室内発生の場合は閉塞性水頭症を合併しやすい。比較的髄液播種を来しやすい腫瘍であり、髄液播種にも注意が必要である。
術前画像診断では、後頭蓋窩発生の上衣腫は髄芽腫やatypical teratoid/rhabdoid tumor (AT/RT)との鑑別が難しい例がある。テント上脳室外発生の場合、膠芽腫や退形成性星細胞腫との鑑別が問題となる。
|

|
| |
病理診断
|

|
| |
|
上衣腫 (WHO grade Ⅱ)は小型で均一な腫瘍細胞が血管周囲性偽ロゼット配列を示すことが特徴であり、多くの症例で観察される。中心管を模した上衣ロゼットが上衣腫の診断に有用であるが、典型的なロゼット形成は比較的少数の症例にしか観察されないことも知られている。免疫染色では腫瘍細胞はglial fibrillary acidic protein (GFAP)が陽性となる。また多くはS100蛋白、vimentinが陽性であり、Olig2は陰性となる。Epithelial membrane antigen (EMA)染色は上衣腫の診断に有用であり、ドット状もしくはリング状の陽性所見を認めることが多い。Isocitrate dehydrogenase (IDH) R132Hでの染色が陰性である点も重要である。
退形成性上衣腫はWHO grade Ⅲに属し、上衣腫 (WHO grade Ⅱ)と比較して細胞密度が高く、多数の核分裂像を有し、微小血管増殖や壊死像を伴うものとされている。しかし、WHO2016では退形成上衣腫の診断根拠となる核分裂像の個数は明記されていない。
上衣腫の診断とさらにそのgradingに関する病理診断の難しさについてはいくつかの報告がある。Sasakiらは本邦の治療担当施設で小児上衣腫と診断された130検体を対象に、熟練した3名の病理医による中央診断の結果を報告している4)。中央診断において病理医間の診断一致率は脊髄上衣腫では100%、後頭蓋窩腫瘍では93%であったが、テント上(大脳半球)腫瘍では病理医間の一致率は77%であった。さらに、ヨーロッパの3つの前向き臨床試験における上衣腫187例について、熟練した5名の病理医が独立して診断したところ、grade Ⅱにおける症例毎の診断一致率は19-59%、grade 3は41-81%と広いばらつきを認めた5)。このように上衣腫の病理診断及びgradingの確定が困難であることが、予後予測因子としてのgradingの不明確性に影響しているものと考えられる。
WHO20162)では、上衣腫は5つのサブタイプと3つのグレードに分類されている。
WHO grade Ⅰには上衣下腫 (subependymoma) や粘液乳頭状上衣腫 (myxopapillary ependymoma)などが含まれる。上衣下腫は成人の脳室壁に好発し、粘液乳頭状上衣腫は若年成人の終糸に好発する。いずれの腫瘍も全摘出 (gross total resection: GTR)後の予後は非常に良好である。いずれも成人に好発するため、本ガイドラインではこれらの腫瘍については取り扱わない。
WHO grade Ⅱにはpapillary, clear cell, tanycyticといったvariantが含まれる。WHO20162)には遺伝子診断によって分類されるEpendymoma, RELA fusion-positiveという項目が新たに付け加えられた。本腫瘍は小児のテント上上衣腫の70%程度を占め、WHO grade ⅡもしくはⅢに分類される。退形成性上衣腫はこれまでどおりWHO grade Ⅲに分類される。本ガイドラインではWHO grade Ⅱの上衣腫とgrade Ⅲの退形成性上衣腫およびgrade Ⅱ/ⅢのRELA fusion-positive上衣腫について取り扱う。
|

|
| |
分子生物学的知見
|

|
| |
|
近年の上衣腫における分子生物学的知見の報告は目覚ましく増加し、以前から年齢・発生部位によって臨床的特徴が異なると報告されていた症例群の背景が明らかとなってきた。テント上・下の上衣腫は病理組織所見としては類似するものの、もはやそれぞれ別の疾患として論じられるべきである。分子生物学的分類を理解することは、今後の診療に役立つためだけでなく、これまでの治療成績に関する報告を考察する上でも、極めて重要である。
分子生物学的には、頭蓋内上衣腫はテント上と後頭蓋窩で大きく異なる。テント上上衣腫では、染色体粉砕 (chromothripsis) により形成されるC11orf95-RELA融合遺伝子が2/3程度と高頻度に認められることが報告された5)。RELA遺伝子もC11orf95遺伝子も共に11番染色体長腕に存在し、マウスの実験ではC11orf95-RELA融合遺伝子を導入することにより、NF-kBシグナルの活性化による上衣腫の発生が認められ、C11orf95-RELA融合遺伝子はドライバー遺伝子であることが確認された。またRELA融合遺伝子を認めたテント上上衣腫の多くは退形成性上衣腫WHO grade Ⅲと診断されている4)。cIMPACT-NOW update 7ではC11orf95-RELA融合遺伝子におけるC11orf95の役割が強調されており、疾患名もSupratentorial ependymoma, C11orf95 fusion-positiveとすることが提言されている 1)。また、C11orf95遺伝子はその機能的意義として、RELA遺伝子だけでなく他の多くの遺伝子と融合遺伝子を形成し、腫瘍形成の主因子となることが判明し、Zinc Finger Translocation Associated (ZFTA)と呼称されることとなった1)。
またテント上上衣腫においては、RELA融合遺伝子群と相互排他的にYAP1-MAMLD1融合遺伝子が発現しているグループ(YAP1融合遺伝子群)も存在する。これらテント上上衣腫15例の報告では、全例が3歳未満で、年齢中央値は8.2ヶ月であり、乳児に好発することが示唆されている6)。15例中13例が女児で、病理組織学的には11例がWHO grade Ⅲに分類されたものの、フォローアップ期間中央値 4.84年で全例再発を認めていない。YAP1融合遺伝子群についてはcIMPACT-NOW 1)でも提言されており、今後分類に追加されるサブタイプと考えられる。一方、RELAやYAP1などの融合遺伝子が存在しないテント上上衣腫も約30%見られるが、それらの腫瘍の生物学的悪性度の評価は定まっておらず7)、今後メチル化プロファイルなどによる精査が必要である。
後頭蓋窩上衣腫は全ゲノム的な発現プロファイルやメチル化プロファイルの違いから、Group A (posterior fossa type A: PFA)とB (posterior fossa type B: PFB)に分類される8)。PFAはCpG islandに高メチル化を多数認め、また30%程度に染色体1qのDNAコピー数増加が見られる7)。一方、PFBでは6q、22qの欠失や9q、15q、18qなどの増加など1q増加以外の様々な染色体異常を示す。PFAは幼年の男児に多く、WHO grade Ⅲが多い傾向があり、転移・再発が多い。PFBは年長児や成人に多く、性差はなく、PFAに比べて予後が良好である。PFA・PFBの鑑別には、H3K27me3の免疫染色が有用である。前述のSasakiらの報告4)では、後頭蓋窩上衣腫のうち、退形成性上衣腫と診断された症例の大部分はPFAであった。
また、前向き臨床試験であるHIT 2000-Eプロトコールに含まれていた28例の18ヶ月未満の上衣腫についての遺伝子検索結果が報告され9)、8ヶ月未満の上衣腫28例は全て退形成性上衣腫であった。28例中21例(75%)が後頭蓋窩局在であり、全例PFAであり、テント上局在の7例 (25%)のうち、4例がRELA融合遺伝子陽性で、2例がYAP1融合遺伝子陽性であった。これらの結果より18ヶ月未満の上衣腫は、PFA / RELA融合遺伝子 / YAP1融合遺伝子の3群が大半を占めることが示唆されている。
上衣腫の分子生物学的分類における予後解析では、PFAが予後不良であり、PFBは予後良好であるとする報告が多い10)。特に一番染色体長碗のgain を伴うPFAの予後は不良である10)。RELA融合遺伝子群の予後については、報告にばらつきがみられる10)。YAP1群の発生頻度はRELA群に比べて低いが、予後は良好である。
本ガイドラインで取り上げた臨床試験や報告の多くは、上記の分子生物学的知見ついて勘案されたものでないことに注意する必要がある。現在のところ、分子生物学的分類は治療方法の選択に直結しないが、予後を予測するのに重要な示唆が得られる。今後はこれらの分子生物学的分類に基づいた臨床試験が行われ、手術・放射線治療・化学療法の有効性がサブグループごとに変わっていく可能性がある。
|

|
| |
治療
|

|
| |
|
上衣腫の治療における手術についてのエビデンスは、一つの方向に向かっており理解しやすい。すなわち、大部分の報告において可能な限り全摘出を行うことが予後の改善につながっている。また放射線治療については、サブタイプによっては不要という報告があるものの、多くは有用性を支持する報告である。
上衣腫において最も悩ましいのは、乳幼児の治療である。これは放射線治療の晩期合併症が発生しやすいためである。乳幼児の上衣腫に対しても、おそらく放射線治療は有効であると考えられるが、晩期合併症を考慮すると、化学療法を先行することにより放射線治療の回避もしくは延期が望まれるところである。問題は、何歳なら照射を行ってよいのかというカットオフ値であろう。本ガイドラインでは「3歳」という年齢を提示した。これは歴史的に複数の臨床試験に用いられてきた年齢区分であり、ある程度エビデンスが存在するためである。しかしその区切り自体に強いエビデンスではなく、あくまで一つの目安として考えるべきであると思われる11)。放射線治療は、年齢のみならず、摘出術後の状態、残存腫瘍の部位や量、病理組織所見と遺伝子分類などを考慮し、生命予後と晩期合併症のバランスを考えた上で照射量、照射範囲、照射方法を慎重に判断する必要がある。2018年にEuropean Association of Neuro-Oncology (EANO) から示されたガイドライン12)では、摘出術後の後療法として、12ヶ月未満には化学療法を、12から18ヶ月には54 Gyの局所照射を、18ヶ月以上では59.4 Gyの局所照射を推奨している。しかし、後のCQで記述しているとおり、上衣腫に放射線治療の効果はあるものの、12か月以上3歳未満児への放射線治療に関しては、局所照射であっても、晩期脳障害が許容できるかどうかの十分なエビデンスの蓄積はみとめられなかった。そのため本のガイドラインでは、患者年令3歳未満・3歳以上という区切りを用いているものの、その取り扱いについては充分慎重を期して解説文を記載した。また、今回のシステマティックレビューからは、12・18ヶ月という年齢の区切りに関するエビデンスはは充分ではないと判断し、その採用を見送った。詳しくは 課題2:放射線治療、 課題3;化学療法 を参照されたい。
|

|
| |
治療成績と予後因子
|

|
| |
|
脳腫瘍全国集計調査報告3)によると、手術+放射線治療を受けた症例の5年生存割合は、上衣腫 (WHO gradeⅡ)では約70%、退形成性上衣腫(WHO gradeIII)では約30%である。年齢的には3歳未満での発症は予後不良因子とする報告が多い。低年齢発症の場合には組織的悪性度が高いこと、後頭蓋窩発生の割合が大きく全摘出が難しいこと、また低年齢層への放射線治療が避けられてきたことなどの要因が予後に影響を及ぼしている可能性が考えられている。摘出率については、全摘出が遂行可能であった例は、有意差をもって予後良好であるとする報告が多い。摘出術後の放射線治療が標準的治療と考えられるが、いくつかの報告では放射線治療の効果が示されておらず、放射線治療を必要としない症例群の存在も示唆されている。上記以外の予後不良因子として、治療前の播種病変の存在が報告されている。
|

|
| |
|
| |
引用文献
|
| |
|
| 1) |
Ellison DW, Aldape KD, Capper D, et al. cIMPACT-NOW update 7: advancing the molecular classification of ependymal tumors. Brain Pathol. 2020;30(5):863-866. |
| 2) |
Louis D, Ohgaki H, Wiestler O, et al. WHO classification of tumours of the central nervous system. 4th edition revised, Lyon: IARC Press; 2016 |
| 3) |
Brain Tumor Registry of Japan (2005-2008). Neurol Med Chir (Tokyo). 2017; 57(Suppl 1):9-102. |
| 4) |
Sasaki A, Hirato J, Hirose T, et al. Review of ependymomas: assessment of consensus in pathological diagnosis and correlations with genetic profiles and outcome. Brain Tumor Pathol. 2019;36(2):92-101. |
| 5) |
Ellison DW, Kocak M, Figarella-Branger D, et al. Histopathological grading of pediatric ependymoma: reproducibility and clinical relevance in European trial cohorts. J Negat Results Biomed. 2011;10:7. |
| 6) |
Parker M, Mohankumar KM, Punchihewa C, et al. C11orf95-RELA fusions drive oncogenic NF-κB signalling in ependymoma. Nature. 2014;506(7489):451-5. |
| 7) |
Fukuoka K, Kanemura Y, Shofuda T, et al. Significance of molecular classification of ependymomas: C11orf95-RELA fusion-negative supratentorial ependymomas are a heterogeneous group of tumors. Acta Neuropathol Commun. 2018;6(1):134. |
| 8) |
Andreiuolo F, Varlet P, Tauziède-Espariat A, et al. Childhood supratentorial ependymomas with YAP1-MAMLD1 fusion: an entity with characteristic clinical, radiological, cytogenetic and histopathological features. Brain Pathol. 2019;29(2):205-16. |
| 9) |
Witt H, Mack SC, Ryzhova M, et al. Delineation of two clinically and molecularly distinct subgroups of posterior fossa ependymoma. Cancer Cell. 2011;20(2):143-57. |
| 10) |
Jünger ST, Andreiuolo F, Mynarek M, et al. Ependymomas in infancy: underlying genetic alterations, histological features, and clinical outcome. Childs Nerv Syst. 2020;36(11):2693-700. |
| 11) |
Upadhyaya SA, Robinson GW, Onar-Thomas A, et al. Molecular grouping and outcomes of young children with newly diagnosed ependymoma treated on the multi-institutional SJYC07 trial. Neuro Oncol. 2019;21(10):1319-30. |
| 12) |
Rudà R, Reifenberger G, Frappaz D, et al. EANO guidelines for the diagnosis and treatment of ependymal tumors. Neuro Oncol. 2018;20(4):445-56. |
|
|

|
| 目次へ戻る!
|

|
| 2. スコープの作成
|

|
| |
2.1. 診療ガイドラインがカバーする内容に関する事項
|

|
| |
| (1) |
タイトル:小児・AYA世代上衣腫の診療ガイドライン |
| (2) |
目的:生命予後、機能予後の改善 |
| (3) |
トピック:生命予後、機能予後の改善 |
| (4) |
想定される利用者、利用施設:小児脳腫瘍(15歳未満及び16-29歳のAdolescent and Young Adult: AYA世代を含めた年齢)を診療する医療者、患者・家族 |
| (5) |
既存ガイドラインとの関係:上衣腫診療については、EANOガイドライン (2016)を参考にした。 |
| (6) |
最重要課題
課題1:手術摘出
課題2:放射線治療
課題3:化学療法
課題4:再発時の治療
|
| (7) |
ガイドラインがカバーする範囲
初発治療時が小児がんとしてみなされる年齢(15歳未満)の小児例に加え15~29歳のAYA(adolescent and young adult)世代
|
| |
a) |
脊髄髄内に発生する上衣腫は本ガイドラインの対象疾患には含めず、頭蓋内上衣腫に限定する。
|
| |
b) |
頭蓋内上衣腫の2016年WHO分類第4版による悪性度のWHO grade ⅡとⅢの両方を含める。
|
| |
c) |
厚労省から示された小児がんとしてみなされる年齢(15歳未満及び16-29歳のAYA世代を含めた年齢)
|
| (8) |
CQリスト
|
| |
| 課題1:手術摘出 |
| |
CQ1: |
肉眼的全摘出は生命予後を改善するか?
|
| 課題2:放射線治療 |
| |
CQ2: |
3歳以上の症例に放射線治療は有用か?
|
| |
CQ3: |
3歳未満の症例に放射線治療は有用か?
|
| |
CQ4: |
全脳全脊髄照射は有用か?
|
| 課題3:化学療法 |
| |
CQ5: |
化学療法は推奨されるか?
(3歳以上と3歳未満に分け検討)
|
| 課題4:再発時の治療 |
| |
CQ6: |
再発時の適切な治療法は何か?
|
|
|

|
| |
2.2. システマティックレビューに関する事項
|

|
| |
| (1) |
実施スケジュール
文献検索:2カ月
文献の選出:2カ月
エビデンス総体の評価と統合:6カ月
|
| (2) |
エビデンスの検索
|
| |
① |
エビデンスタイプ
|
| |
|
・ |
既存のガイドライン: European Association for Neuro-Oncology (EANO)よりガイドラインが報告されている(スコープ引用文献12を参照)。
|
| |
|
・ |
個別研究論文:ランダム化比較試験の報告は、海外からいくつか報告されている。その他、非ランダム化比較試験、観察研究を検索対象とした。MRI時代以前の観察研究や、症例報告に関しては一部を除いて省略した。
|
| |
② |
データベース
|
| |
|
・ |
個別研究論文: 主にPubMed
|
| |
|
・ |
SR/MA論文について: 検索されたSRは全て参考としたが、構造化抄録には加えなかった。MA論文は認めなかった。
|
| |
|
・ |
既存のガイドラインの検索: EANOからのガイドラインを参考とした(スコープ引用文献12を参照)。
|
| |
③ |
検索方法
|
| |
|
・ |
介入の検索に関してはPICOフォーマットを用いる。
|
| |
④ |
検索対象期間
|
| |
|
・ |
すべてのデータベースで2019年12月31日まで
|
| (3) |
文献の選択基準,除外項目
採択条件を満たす観察研究がない場合、システマティックレビューは実施しない。
|
| (4) |
エビデンスの評価と統合の方法
エビデンス総体の強さの評価は「Minds作成手引き2014」の方法に基づく。
エビデンス総体の統合は質的な統合を基本とし、適切な場合が量的統合を実施。
|
|

|
| 目次へ戻る!
|

|
| (Ⅵ)推奨
|

|
| 課題1:手術摘出
|

|
| |
CQ1 肉眼的全摘出は生命予後を改善するか?
|

|
| |
推奨
生命予後の改善が期待できるので肉眼的全摘出を強く推奨する。(推奨度1C)
|
|

|
| |
解説
|
| |
はじめに
|
| |
|
小児期とadolescent and young adult (AYA)世代の頭蓋内上衣腫に対する手術摘出として、アウトカムの「益」としてはoverall survival (OS)やprogression-free survival (PFS)の延長を、また「害」としては神経症状の悪化によるquality of life (QOL)の低下を設定し、肉眼的全摘出gross total resection (GTR)とそれ以下の摘出度との間で比較した。また初回摘出術後の残存腫瘍に対する再摘出の有効性、および最近提唱されている全ゲノム的な発現プロファイルから分類される後頭蓋窩上衣腫サブタイプにおける摘出度と予後との関連性も検討した。PICOの設定に従い、30歳以上の症例を多く含む報告や、再発例および脊髄上衣腫を対象とした報告は除外し、稀少疾患である頭蓋内上衣腫に対して定性的システマテックレビューを行なった。
|

|
| |
(1) 腫瘍の摘出度とOS・PFS
|
| |
|
頭蓋内上衣腫では腫瘍のGTRができれば生命予後が改善すると考えられてきたが、今回システマテックレビューにより、この仮説を評価した。上衣腫の摘出度の判定は、術中所見ではなく、摘出術後早期の画像検査によって厳密に評価することが求められるようになったため、画像評価が行なわれた報告を採用した。近年の摘出度の評価法に準じて1)、摘出術後の画像検査で残存腫瘍を認めないものをGTRとし、GTR以外のnon-GTRにはnear total resection、亜全摘出、部分摘出および生検が含まれる。これまで摘出度と予後との関係を明確にするためのランダム化比較試験の報告はないため、年齢・部位・組織学的悪性度・放射線治療・化学療法など複数の予後因子を評価した報告で、多変量解析を用いたサブ解析により腫瘍の摘出度の評価を行なった報告を採用した。統計学的に適切な評価を得るために、GTR群・non-GTR群の症例数がそれぞれ20例以上の報告を採用した。
Non-GTRよりもGTRでOSの延長が有意差ありとする報告は7件、PFSの延長が有意差ありとする報告は6件であった。これらの報告で、摘出術後に放射線治療などの後療法が施行された5年OSはGTR群80%-93.6%、non-GTR群51%-53%であり、5年PFSはGTR群53%-81.5%、non-GTR群33%-42%であった。一方、OSではGTR群とnon-GTR群に有意差を認めないとする報告は1件のみで、PFSで有意差のない報告は3件といずれも少なかった。Non-GTR群がGTR群よりもOS、PFSが有意に良好であるとする報告はなかった。発生部位を後頭蓋窩あるいはテント上に分けて摘出度と予後との関係を検討した報告はなかった。
|

|
| |
| |
1-1) 前方視的研究の報告
|
| |
|
頭蓋内上衣腫では腫瘍のGTRができれば生命予後が改善すると考えられてきたが、今回システマテックレビューにより、この仮説を評価した。上衣腫の摘出度の判定は、術中所見ではなく、摘出術後早期の画像検査によって厳密に評価することが求められるようになったため、画像評価が行なわれた報告を採用した。近年の摘出度の評価法に準じて1)、摘出術後の画像検査で残存腫瘍を認めないものをGTRとし、GTR以外のnon-GTRにはnear total resection、亜全摘出、部分摘出および生検が含まれる。これまで摘出度と予後との関係を明確にするためのランダム化比較試験の報告はないため、年齢・部位・組織学的悪性度・放射線治療・化学療法など複数の予後因子を評価した報告で、多変量解析を用いたサブ解析により腫瘍の摘出度の評価を行なった報告を採用した。統計学的に適切な評価を得るために、GTR群・non-GTR群の症例数がそれぞれ20例以上の報告を採用した。
Non-GTRよりもGTRでOSの延長が有意差ありとする報告は7件、PFSの延長が有意差ありとする報告は6件であった。これらの報告で、摘出術後に放射線治療などの後療法が施行された5年OSはGTR群80%-93.6%、non-GTR群51%-53%であり、5年PFSはGTR群53%-81.5%、non-GTR群33%-42%であった。一方、OSではGTR群とnon-GTR群に有意差を認めないとする報告は1件のみで、PFSで有意差のない報告は3件といずれも少なかった。Non-GTR群がGTR群よりもOS、PFSが有意に良好であるとする報告はなかった。発生部位を後頭蓋窩あるいはテント上に分けて摘出度と予後との関係を検討した報告はなかった。
|

|
| |
1-2) 後方視的研究の報告
|
| |
|
腫瘍の摘出術後、年少児に対しては化学療法を施行した後に放射線治療を施行し、治療効果を検討した報告7)(15歳未満、テント上18例、後頭蓋窩65例、GTR 72%)では、GTR群のOS・PFSがnon-GTRよりも有意に良好で、5年OSはGTR群80%、non-GTR群51%であり、5年PFSはGTR群53%、non-GTR群33%であった。摘出術後に放射線治療や一部の例に化学療法を施行し治療効果を検討した報告8)(0.1歳から18歳、テント上24例、後頭蓋窩58例、GTR 68%)では、OSはnon-GTR群よりもGTR群で有意に良好であったが、PFSは両郡間に有意差は認めなかった。摘出術後に異なった方法で放射線治療を施行してその有効性を検討した報告9)(25歳以下、テント上147例、後頭蓋窩55例、GTR 86%)では、GTR群のOSはnon-GTR群よりも有意に良好であった。
以上の結果から、年少児からAYA世代の年齢の症例を対象とした前方視的研究、あるいは後方視的研究のサブ解析では、GTR群のOS・PFSが non-GTR群よりも有意に良好であるとする報告が多く、これに反する報告は非常に少ない。ただ、摘出術後に後療法が施行されているので、摘出度によってどの程度の予後を改善できるかは不明である。結論として、摘出度と予後との関係をランダム化比較試験で検討した報告はないのでエビデンスレベルが高いとは言えないが、後述のように腫瘍の摘出により重篤な神経症状の悪化が予想される場合を除き、生命予後の改善が期待できるためGTRを提案する。
|
|

|
| |
(2) 残存腫瘍に対する再摘出の有効性
|
| |
|
初回摘出術後に残存した腫瘍に対する再摘出、いわゆるsecond-look surgeryによってGTRが達成できれば予後の改善が期待されるため、初回摘出術後に再摘出、あるいは再々摘出が行なわれてきた5,11)。これらの報告でのGTRの達成率は81.7%および80.2%であり、前項1)で述べたGTR率 (30 - 80%台)と比較して高値である。
再摘出による予後への影響を中心に検討した報告は少なく、システマテックレビューでは次の3つの報告を採用した。
小児テント上下の上衣腫110例を対象に再摘出の有効性を検討した多施設前方視的研究の報告12)では、初回摘出術後の残存腫瘍に対し化学療法や放射線治療を行い、残存腫瘍の再摘出、あるいは複数回の摘出術によって、GTR達成率は初回摘出の61.0%から82.7%まで上昇した。この報告では、初回摘出でGTRを達成できた群と複数回の摘出でGTRを達成できた群との間に、PFSや局所非再発率に有意差は認めないことから、再摘出によってGTRが達成できれば初回摘出でGTRとなった場合と同等の効果があることが示唆された。この再摘出の適応は外科医の判断に委ねられているが、適応とならないのは、腫瘍が基底核に浸潤している例、脳底動脈を巻き込んでいる例、脳幹部の腹側まで進展している例など、再摘出によって高度の神経障害が予想される場合としている。この手術適応で複数回の摘出を行なった29例中、神経症状の悪化は2例(6.8%)に見られ、このうち1例は改善したことから再摘出による神経障害の悪化は許容範囲としている。
小児テント上下の上衣腫160例を対象とした多施設前方視的研究6)では、初回手術で残存腫瘍を認めた50例中46例(92.0%)で、摘出術後の後療法を行う前に残存腫瘍を再度摘出した。少数例で3回以上の摘出を行なっている。その結果、初回摘出でのGTR達成率68.8%が再摘出によって75.6%と上昇した。再摘出の手術合併症は46例中5例 (10.9%)に認め、このうち4例は小脳・下位脳神経の障害で、残り1例は出血を呈したが神経症状は改善したことから、再摘出に伴う神経症状の悪化は許容範囲としている。
発生部位・組織学的悪性度・摘出度によって異なった後療法を施行し、放射線治療の有効性を前方視的に検討した報告13)(1歳から21歳までのテント上下の上衣腫356例、GTR 82.0%)では、亜全摘出(摘出術後の画像所見で0.5 cmより大きな残存腫瘍を認める)に終わったのは64例(全例の18.0%)であった。亜全摘出例に化学療法を行い、64例中25例(39.0%)で残存腫瘍に対し再摘出を施行し、後療法として局所放射線治療を行なったところ、5・10年のPFSはそれぞれ50.5%・45.9%であった。一方、亜全摘出術後に化学療法を行ったが再摘出しなかった例(39例)に放射線治療を行った群の5・10年のPFSはそれぞれ28.5%・25.0%であった。これら再摘出した群と行なわなかった群でのPFSを比較すると、再摘出した群の方が良好な傾向を認めたが、この差は有意ではなかった(P = 0.116)。
以上、初回摘出術後に画像上残存腫瘍を認めた場合、再摘出を行なう、あるいは化学療法などを施行した後に再摘出を行なうことが、予後を改善するのに有効かどうかに関しては、報告が少なく十分なエビデンスがない。しかし、前述のMassiminoらの再摘出の適応12)を参考にし、重篤な障害を来さずに再摘出を施行してGTRが達成できれば、non-GTRよりも良好なOSやPFSが期待できるため、再摘出を考慮してもよい。
|

|
| |
(3) 腫瘍摘出によるQOLの低下
|
| |
|
腫瘍の摘出技術が向上し、摘出に際して神経障害の発生頻度は減少しているものの、脳深部に局在する腫瘍や、大きい腫瘍であれば、摘出に伴う神経機能障害を起こしやすい。発生部位がテント上であれば摘出に伴い腫瘍周囲の脳損傷が発生しやすく、大脳深部に発生すれば腫瘍到達までの大脳の切開などによる損傷も加わる。後頭蓋窩では、大きな腫瘍では摘出時の小脳または脳幹の損傷によって、脳幹の機能障害、錐体路障害や小脳障害による歩行障害や運動障害が発生する。第四脳室から小脳橋角部や脳幹前面に進展した腫瘍では、摘出時の脳神経の障害によって顔面神経麻痺や眼球運動障害が発生し、下位脳神経の障害による構音障害、重篤なものとして嚥下障害による気管切開や胃瘻造設の必要性が指摘されてきた。また、後頭蓋窩腫瘍に特有な無言症(mutism)があり、重篤な場合は回復しにくく、これにより高次脳機能障害が発生して患者のQOLを大きく低下させる。
今回、摘出術による神経障害の悪化をより客感的に評価するため、システマテックレビューでは次の3つの報告を採用した。
小児の後頭蓋窩上衣腫(45例)を対象に、摘出術後の神経障害を後方視的に検討した単施設からの報告14)では、20%に声帯機能低下を認め、24%に嚥下障害のために胃瘻を必要とした。複数回の腫瘍摘出の後に局所放射線治療を施行し、神経障害を前方視的に評価した単施設からの報告11)(0.8歳から22.7歳、後頭蓋窩のみ96例)では、摘出術後に運動失調55%、外転神経麻痺51%、顔面神経麻痺50%、四肢麻痺40%、嚥下障害39%、体幹失調・筋緊張低下24%を認めた。重篤な障害として歩行障害18%、嚥下障害9%があり、嚥下障害が最も改善しにくく、28%で胃瘻、16%で気管切開を必要とした。治療後60か月以上生存した48例中42例 (87.5%)では神経症状の改善を認めたが、四肢麻痺と運動失調は改善が乏しかった。顔面神経麻痺、構音障害、歩行障害は摘出術後36 ヶ月まで改善し、その後障害は固定化した。複数回の手術摘出によりGTRは80.2%であったが、摘出度と神経障害の関連は示されていない。摘出術後に神経学的異常を認めなかった例 (21%)の大半は腫瘍の外側進展が少ない例であったことから、外側進展が手術摘出における神経障害の危険因子であると推測される。また水頭症やシャント設置も神経症状出現の危険因子であったとしている。
摘出度と高次脳機能との関連性に関しては、摘出術後に放射線治療を施行し5年後のQOLを評価した単一施設での前方視的研究の報告15)(1歳から25歳、テント上25例、後頭蓋窩98例、GTR 82%)がある。摘出度については、肉眼的全摘出をGTR、5 mm以下の残存腫瘍の場合をnear total resection、5 mmを越える残存腫瘍を認める場合をsubtotal resectionと定義している。サブ解析として腫瘍の摘出度とIntelligence Quotient (IQ)の有意な関連性は認められなかったが、集団行動が取れない等の適応行動障害は、subtotal resection群ではGTR群やnear total resection群より単変量解析で有意 (P=0.046)に強く認められたとしている。この報告では、後頭蓋窩上衣腫の摘出術後無言症の記載はなく、無言症の高次脳機能への影響は検討されていない。しかし、近年は小脳と高次脳機能との関連が推測されているため、重篤な無言症の発生はQOLを低下させることを認識すべきである。
今回のシステマテックレビューでは、腫瘍の摘出度と神経障害の関連性は明らかではないが、後頭蓋窩上衣腫では第四脳室の外側に進展した場合に、手術摘出による神経障害が発生しやすいことが推測できた。初回の手術摘出であっても、残存腫瘍に対する再手術摘出の場合でも、重篤な神経障害が発生すれば十分な回復は期待できないことを認識し、手術摘出に臨むべきであると思われる。
|

|
| |
(4) 分子分類での摘出度による予後への影響
|
| |
|
後頭蓋窩上衣腫は、全ゲノム的な発現プロファイルの違いからPFAとPFBに分けられ、PFAはPFBと比較して有意に予後が不良であることが明らかとなってきた16,17)。PFAとPFBのサブグループで、腫瘍摘出度と予後との関係に注目した前方視的研究の報告はない。今回のシステマテックレビューでは、複数の予後因子が評価されている報告を採用し、摘出度と予後との関係を検討した。
PFAを対象にOSに対する摘出度を含めた複数の予後因子を検討した報告は4件あり、全て後方視的研究で少数の成人例を含む報告もある。このうち3件の報告16-18)ではGTR群はnon-GTR群よりも有意にOSが良好で、残り1件の報告19)では有意差は認めなかった。PFSは上記4件の全ての報告において、GTR群がnon-GTR群よりも有意に良好であった。
PFBを対象にOSに対する摘出度を含む複数の予後因子の解析を行った4件の後方視的研究がある。このうち2件の報告18,20)でGTR群がnon-GTR群より有意にOSが良好であったが、他の2件の報告16,17)では両群間で有意差を認めなかった。PFSに関して、1件の報告18)でGTR群がnon-GTR群より有意に良好であったが、他の2件の報告16,17)では両群間に有意差を認めなかった。
以上から、後頭蓋窩上衣腫をPFAおよびPFBに分類して摘出度と予後とを検討すると、両群ともにGTRによるOS・PFSはnon-GTRよりも良好な傾向があると推測できる。しかし、この分類に従って腫瘍の摘出度と予後との関係を検討した報告は少なく、明確な結論を出すことはできない。現状では、後頭蓋窩上衣腫の手術摘出時にリアルタイムでPFAやPFBの分子診断はできないため、重篤な神経障害を呈さない限りGTRを提案する。
|

|
| |
まとめ
|
| |
|
多数の前方視的・後方視的研究における予後因子の解析結果から、小児とAYA世代の頭蓋内上衣腫に対してはGTRを達成できれば、non-GTRに比べてOS・PFSは改善することが示唆される。エビデンスレベルは高くはないが、手術摘出により重篤な神経症状の悪化が予想される場合を除き、GTRを強く推奨する。また初回摘出術後に残存腫瘍を認めた場合は、手術摘出による神経障害の悪化を十分に考慮した上で、再摘出手術によりGTRをめざすことを提案する。現状では、後頭蓋窩上衣腫の手術摘出時にリアルタイムでPFAやPFBの分子診断はできないため、重篤な神経障害を呈さない限りGTRを提案する。
|

|
| |
|
| |
引用文献
|
| |
|
| 1) |
Gnekow AK. Recommendations of the Brain Tumor Subcommittee for the reporting of trials. SIOP Brain Tumor Subcommittee. International Society of Pediatric Oncology. Med Pediatr Oncol. 1995;24(2):104-8. |
| 2) |
Timmermann B, Kortmann RD, Kühl J, et al. Combined postoperative irradiation and chemotherapy for anaplastic ependymomas in childhood: results of the German prospective trials HIT 88/89 and HIT 91. Int J Radiat Oncol Biol Phys. 2000;46(2):287-95. |
| 3) |
Strother DR, Lafay-Cousin L, Boyett JM, et al. Benefit from prolonged dose-intensive chemotherapy for infants with malignant brain tumors is restricted to patients with ependymoma: a report of the Pediatric Oncology Group randomized controlled trial 9233/34. Neuro Oncol. 2014;16(3):457-65. |
| 4) |
Grill J, Le Deley MC, Gambarelli D, et al; French Society of Pediatric Oncology. Postoperative chemotherapy without irradiation for ependymoma in children under 5 years of age: a multicenter trial of the French Society of Pediatric Oncology. J Clin Oncol. 2001;19(5):1288-96. |
| 5) |
Merchant TE, Li C, Xiong X, et al. Conformal radiotherapy after surgery for paediatric ependymoma: a prospective study. Lancet Oncol. 2009;10(3):258-66. |
| 6) |
Massimino M, Miceli R, Giangaspero F, et al. Final results of the second prospective AIEOP protocol for pediatric intracranial ependymoma. Neuro Oncol. 2016;18(10):1451-60. |
| 7) |
van Veelen-Vincent ML, Pierre-Kahn A, Kalifa C, et al. Ependymoma in childhood: prognostic factors, extent of surgery, and adjuvant therapy. J Neurosurg. 2002;97(4):827-35. |
| 8) |
De B, Khakoo Y, Souweidane MM, et al. Patterns of relapse for children with localized intracranial ependymoma. J Neurooncol. 2018;138(2):435-45. |
| 9) |
Ducassou A, Padovani L, Chaltiel L, et al; Pediatric French Radiation Oncologist Group (GFRP) and the French Society of Children With Cancer (SFCE). Pediatric Localized Intracranial Ependymomas: A Multicenter Analysis of the Societe Francaise de lutte contre les Cancers de l'Enfant (SFCE) from 2000 to 2013. Int J Radiat Oncol Biol Phys. 2018;102(1):166-73. |
| 10) |
Grundy RG, Wilne SA, Weston CL, et al; Children's Cancer and Leukaemia Group (formerly UKCCSG) Brain Tumour Committee. Primary postoperative chemotherapy without radiotherapy for intracranial ependymoma in children: the UKCCSG/SIOP prospective study. Lancet Oncol. 2007;8(8):696-705.
|
| 11) |
Morris EB, Li C, Khan RB, et al. Evolution of neurological impairment in pediatric infratentorial ependymoma patients. J Neurooncol. 2009;94(3):391-8.
|
| 12) |
Massimino M, Solero CL, Garrè ML, et al. Second-look surgery for ependymoma: the Italian experience. J Neurosurg Pediatr. 2011;8(3):246-50.
|
| 13) |
Merchant TE, Bendel AE, Sabin ND, et al. Conformal Radiation Therapy for Pediatric Ependymoma, Chemotherapy for Incompletely Resected Ependymoma, and Observation for Completely Resected, Supratentorial Ependymoma. J Clin Oncol. 2019;37(12):974-83.
|
| 14) |
Thompson JW, Newman L, Boop FA, et al. Management of postoperative swallowing dysfunction after ependymoma surgery. Childs Nerv Syst. 2009;25(10):1249-52.
|
| 15) |
Netson KL, Conklin HM, Wu S, et al. A 5-year investigation of children's adaptive functioning following conformal radiation therapy for localized ependymoma. Int J Radiat Oncol Biol Phys. 2012;84(1):217-223.e1.
|
| 16) |
Witt H, Mack SC, Ryzhova M, et al. Delineation of two clinically and molecularly distinct subgroups of posterior fossa ependymoma. Cancer Cell. 2011;20(2):143-57.
|
| 17) |
Pajtler KW, Witt H, Sill M, et al. Molecular Classification of Ependymal Tumors across All CNS Compartments, Histopathological Grades, and Age Groups. Cancer Cell. 2015;27(5):728-43.
|
| 18) |
Ramaswamy V, Hielscher T, Mack SC, et al. Therapeutic Impact of Cytoreductive Surgery and Irradiation of Posterior Fossa Ependymoma in the Molecular Era: A Retrospective Multicohort Analysis. J Clin Oncol. 2016;34(21):2468-77.
|
| 19) |
Zapotocky M, Beera K, Adamski J, et al. Survival and functional outcomes of molecularly defined childhood posterior fossa ependymoma: Cure at a cost. Cancer. 2019;125(11):1867-76.
|
| 20) |
Cavalli FMG, Hübner JM, Sharma T, et al. Heterogeneity within the PF-EPN-B ependymoma subgroup. Neuropathol. 2018;136(2):227-37.
|
|
|

|
| |
|
[課題1のシステマティックレビュー結果]
このクリニカルクエスチョンに答えるため、下記検索式による検索を行った。
|
| |
|
| ((((((((((((Ependymoma[mh:noexp] OR Ependymoma*[tiab] OR ependymal tumo*[tiab]))) AND ((Brain Neoplasms[mh] OR Brain[tiab] OR Cerebral*[tiab] OR Cerebellar*[tiab] OR Infratentorial*[tiab] OR supratentorial*[tiab] OR subtentorial*[tiab] OR intracranial*[tiab] OR ventricle*[tiab] OR Posterior Fossa[tiab]))) AND ((("surgery"[sh] OR "surgery"[tiab] OR "surgical procedures, operative"[mh]) OR ("surgical"[tiab] AND "procedures"[tiab] AND "operative"[tiab]))))) AND (((infant[mh] OR child[mh] OR adolescent[mh] OR young adult[mh] OR adult[mh:noexp]))))) AND 1900/1/1: 2019/12/31 [dp])) AND ((English[la] or Japanese[la])))) NOT Case Reports[pt]
以上の検索式より、1次スクリーニングとして179の文献を抽出した。医中誌の検索による8の文献、及びハンドサーチによる20の文献を加え、188の文献について2次スクリーニングを行った。最終的に44文献について構造化抄録を作成した。それらに基づいて推奨と解説文を作成した。
|
|

|
| 目次へ戻る!
|

|
| 課題2:放射線治療
|

|
| |
CQ2 3歳以上の症例に放射線治療は有用か
|

|
| |
推奨1
摘出術後に腫瘍が残存した上衣腫 (WHO grade Ⅱ)・退形成性上衣腫の症例に対しては、摘出術後に放射線治療を行うことを強く推奨する。(推奨度1C)
|
推奨2
肉眼的に全摘出された退形成性上衣腫の症例に対しては、摘出術後に放射線治療を行うことを弱く推奨する。 (推奨度2C)
|
|

|
| |
解説
|

|
| |
|
上衣腫に対して放射線治療が有効かどうかに関しては、現在まで、本来の結論を導くことができるような十分にデザインされた臨床試験は行われていない。また、上衣腫に対して放射線治療が有効かどうかを検討した報告1-10)はいくつかあるものの、その結果のみで結論を出すことは難しい。現状では、より若年の症例には放射線治療を避ける試みがなされており、通常診療でも年齢によって治療戦略の立て方が異なっていることが多い。本項では3歳以上の症例に放射線治療が有用かどうかを、今までの報告から検討した。
放射線治療が有効であるとした報告の中で、比較的症例数が多い・前向き比較試験などのインパクトのあるものが5編あった。一番目は、小児上衣腫の手術と照射の役割を検討することを目的に、1973-2005年のThe Surveillance, Epidemiology, and End Results (SEER)のデータベースから抽出された上衣腫 (WHO grade Ⅱ)・退形成性上衣腫2408例を対象に行った研究1)である。最も強い予後因子は全摘出であり、全摘出例への摘出術後放射線治療の有効性は示されなかった。しかし、部分摘出例では摘出術後に放射線治療を追加することで予後が有意に改善し、摘出術後放射線治療の有効性が示された。最も症例数の多いこの報告からは、限定的ではあるが摘出術後の放射線治療が有効であると考えられる。ただし、対象症例は30歳未満が30%程度であり、本ガイドラインの対象よりも高い年齢層が多く含まれているという点に注意を要する。二番目はSEERデータベース(1973-2003年)から抽出された小児上衣腫 (WHO grade Ⅱ)・退形成性上衣腫635例を対象とし、予後因子について検討した研究2)である。年齢と腫瘍発生部位が予後因子として報告された。5年生存率 (5Y-OS)はテント上 59.5%、後頭蓋窩 57.1%、脊髄86.7%であり、解析対象に非常に予後良好な55例(8.7%)の脊髄原発例が含まれているため、小児頭蓋内上衣腫の予後を規定する因子は年齢のみと考えたほうが良いかもしれない。一方で、放射線治療は単変量解析では全体のOSの改善に寄与し、多変量解析でも後頭蓋窩上衣腫のOSの改善に寄与する (5Y-OS 57.1% vs. 48.2%)ことが示された。特に後頭蓋窩上衣腫に対する放射線治療の有効性が示されたと結論している。三番目は、153例の小児限局性上衣腫への手術+摘出術後照射の有効性を検討した単施設前向き臨床研究3)である。対象の年齢中央値は2.9 (0.9-22.9)歳であった。研究計画されていた放射線治療はClinical Target Volume (CTV)マージン1.0 cmの局所照射で、1.5歳未満の全摘例には54 Gy/30回、それ以外の症例には59.4 Gy/33回の投与線量が設定されていた。131例で59.4 Gy、22例で54.0 Gyの照射が行われた。全体での7年locoregional control rate (LCR)、EFS、OSは87.3%、69.1%、81.0%で、局所再発、遠隔転移の累積発生率は16.3%、11.5%であった。何らかの理由で摘出術後早期に放射線治療をしなかった46例を除いた107例の結果は、7年LCR、EFS、OSは88.7%、76.9%、85.0%で、局所再発、遠隔転移の累積発生率は12.6%、8.6%であった。過去の報告と比較して試験全体の治療成績が比較的良好であったこと、有害事象として脳幹壊死は1.6%と多くなかったこと等から、可及的摘出術後の局所への高線量の放射線治療が重要であると結論している。しかし、本研究のみから、摘出術後に1.5歳未満児に54 Gy/30 回、それ以外に59.4 Gy/33回を標準的投与線量として良いかについては、今後十分な検討が必要である。四番目は、フランスでの24施設の後方視的症例集積研究4)であり、中央値46(18-82)歳の成人上衣腫 (WHO grade Ⅱ)・退形成性上衣腫の152例が対象であった。予後因子として摘出度、grade(WHO、Marseille)、年齢、KPSが示された。放射線治療に関する結果では、Marseille の低Grade(93.8%がWHO grade Ⅱ)の部分摘出の場合にはPFSで有意な有効性があり、OSに関しても有効な傾向を示したが、Marseille の高Grade(90%がWHO grade Ⅲ)の全摘出の場合にはPFSには有効な傾向を示したが、OSに差はなかった。この報告は、本ガイドラインが対象とする年齢層よりも高い年齢層が多く含まれていること、WHO grade Ⅲの症例が28.3%と少ないこと等の注意点があるものの、その結果に関しては、症例限定的ではあるが放射線治療の有効性が示されている。五番目の報告5)は顕微鏡下手術における平均年齢23 (1-75)歳の頭蓋内上衣腫の予後因子を単一施設で後方視的に検討したもので、WHO gradeは無増悪生存期間・全生存期間ともに明らかな予後因子であることが認められた。摘出術後の放射線治療に関しては上衣腫全体での放射線治療の有効性は示されなかったものの、退形成性上衣腫で全摘出された症例で最も有効性が高いことが示された。つまり、摘出術後の放射線治療の有効性は上衣腫全体では認めないが、退形成性上衣腫では全摘出であっても追加したほうが良いという結果であり、放射線治療の有効性が症例限定的に示された。このように放射線治療は、部分摘出術後・退形成性上衣腫・小児後頭蓋窩腫瘍で有効である可能性が示唆されるが、報告によって有効性が示された群が相反する結果も認められた。
一方で、放射線治療の有効性がないとする少数の報告も認められた。しかし、放射線治療が有効であるとする研究と比較すると、対象症例数が少ない研究が多い。その中でも解析症例数の多い研究に、米国のNational Cancer Database (NCDB)から抽出した上衣腫 (WHO gradeⅡ)・退形成性上衣腫1318例(年齢中央値43〔18-54〕歳)を対象とした研究6)がある。症例はWHO grade Ⅱ/Ⅲは1055/263例、テント上/下は848/470例で、485例に亜全摘出/肉眼的全摘出、662例に摘出術後放射線治療、75例に化学療法が実施された。その結果、予後因子として年齢、WHO grade、腫瘍サイズ、性別、腫瘍部位が示されたが、放射線治療はWHO gradeや摘出度、腫瘍部位を考慮しても生存への寄与は認められなかった。この研究では本ガイドラインで対象としている年齢層より高年齢の症例が多いことに注意が必要であるが、症例限定ではあるが摘出術後の放射線治療の有効性が示されていない報告である。もう一つの報告は、SEERデータベースから全摘出術後のテント上上衣腫を抽出した研究7)である。対象は92例で、年齢中央値は17.5(1-83)歳であった。結果は、5年OS 83.2%、10年OS 71.4%、他因死を除く補正生存率 (修正生存率) (cause specific survival : CSS) 5年84.1%、10年CSS 71.4%であった。放射線治療は半数の症例に実施されたが、放射線治療の有無でCSS、OSともに差を認めなかった。本ガイドラインの対象年齢層より高い年齢が含まれていること、対象がテント上の全摘出された上衣腫に限定されていることに注意が必要である。しかし、本報告も症例限定ではあるが摘出術後の放射線治療の有効性を認めなかった研究の一つである。
これらの結果から、大部分が後方視的検討ではあるものの、残存腫瘍を認める上衣腫 (WHO grade Ⅱ)・退形成性上衣腫に対する摘出術後放射線治療の有効性は、多くの検討で肯定的な結果であった。摘出術後に腫瘍が残存した上衣腫 (WHO grade Ⅱ)・退形成性上衣腫には放射線治療を追加することで予後が改善すると考えられる。また、肉眼的全摘出された退形成性上衣腫に関しては、摘出術後残存を認める腫瘍ほど肯定的な報告は多くないが、摘出術後に放射線治療を施行したほうがOSあるいはPFSを改善するとした報告が散見される。よって退形成性上衣腫の場合には、全摘術後でも放射線治療を行うことを検討すべきである。一方、肉眼的全摘出がなされた上衣腫 (WHO grade Ⅱ)に関しては、前述したとおりに相反する報告がそれぞれに散見されることから、画一的に摘出術後の放射線治療の実施の是非を決めることはできず、推奨度を決めるのは難しい。摘出腔周囲の再発時に手術が可能かどうか・年齢・全身状態・腫瘍部位・腫瘍サイズ、分子生物学的情報(現段階ではまだ一般的ではないが組織学的悪性度以外の情報)等を考慮し、症例に応じて判断するのも一法であろう。
|

|
| |
|
| |
引用文献
|
| |
|
| 1) |
Rodríguez D, Cheung MC, Housri N, et al. Outcomes of malignant CNS ependymomas: an examination of 2408 cases through the Surveillance, Epidemiology, and End Results (SEER) database (1973-2005). J Surg Res. 2009;156(2): 340-51.
|
| 2) |
McGuire CS, Sainani KL, Fisher PG. Both location and age predict survival in ependymoma: a SEER study. Pediatr Blood Cancer. 2009;52(1): 65-9.
|
| 3) |
Merchant TE, Li C, Xiong X, et al. Conformal radiotherapy after surgery for paediatric ependymoma: a prospective study. Lancet Oncol. 2009;10(3): 258-66.
|
| 4) |
Metellus P, Barrie M, Figarella-Branger D, et al. Multicentric French study on adult intracranial ependymomas: prognostic factors analysis and therapeutic considerations from a cohort of 152 patients. Brain. 2007;130(Pt 5): 1338-49.
|
| 5) |
Korshunov A, Golanov A, Sycheva R, et al. The histologic grade is a main prognostic factor for patients with intracranial ependymomas treated in the microneurosurgical era: an analysis of 258 patients. Cancer. 2004;100(6): 1230-7.
|
| 6) |
Nuño M, Yu JJ, Varshneya K, et al. Treatment and survival of supratentorial and posterior fossa ependymomas in adults. J Clin Neurosci. 2016;28: 24-30.
|
| 7) |
Ghia AJ, Mahajan A, Allen PK, et al. Supratentorial gross-totally resected non-anaplastic ependymoma: population-based patterns of care and outcomes analysis. J Neurooncol. 2013;115(3): 513-20.
|
| 8) |
Aizer AA, Ancukiewicz M, Nguyen PL, et al. Natural history and role of radiation in patients with supratentorial and infratentorial WHO grade II ependymomas: results from a population-based study. J Neurooncol. 2013;115(3): 411-9.
|
| 9) |
Metellus P, Guyotat J, Chinot O, et al. Adult intracranial WHO grade II ependymomas: long-term outcome and prognostic factor analysis in a series of 114 patients. Neuro Oncol. 2010;12(9): 976-84.
|
| 10) |
Guyotat J, Metellus P, Giorgi R, et al. Infratentorial ependymomas: prognostic factors and outcome analysis in a multi-center retrospective series of 106 adult patients. Acta Neurochir (Wien). 2009;151(8): 947-60.
|
|
|

|
| 目次へ戻る!
|

|
| |
CQ3 3歳未満の症例に放射線治療は有用か?
|

|
| |
推奨
3歳未満の症例に対しては、放射線治療を回避するか、できるだけ長期の開始遅延を目指すことを弱く推奨する。 (推奨度2C)
|
|

|
| |
解説
|

|
| |
|
上衣腫に対して放射線治療が有効かどうかに関しては、現在までこれに答えることができる十分にデザインされた臨床試験は行われていない。特に現状では、より低年齢の症例に対して放射線治療を避ける試みがなされており、通常診療でも年齢により異なる方針で治療している施設が多い。本項では3歳未満の症例に放射線治療が有用かどうかを、今までの報告から検討した。
予後不良と考えられている3歳未満の症例に放射線治療を行うことで、治療成績が向上するとした前方視研究のサブ解析や比較的症例数の多い後方視的研究などの代表的な報告を提示する。1990年から2005年までのpopulation-based studyがカナダから報告1)されている。診断時3歳未満の悪性脳腫瘍579例中の上衣腫75例(13%)が対象であった。後頭蓋窩局在が80%、WHO grade Ⅱが67%、診断時に転移を認めた症例が29%であった。治療は、手術単独23%、摘出術後手術+化学療法37%、手術+放射線治療19%、手術+化学放射線療法21%であった。各治療群の5年無イベント生存率 (Event Free Survival: EFS)はそれぞれ、22.0%、11.5%、46.2%、64.8%であり、摘出術後に放射線治療を追加された症例でEFSが長く、化学放射線療法を受けた症例群で最も良好であった。しかし、より年齢の低い症例には摘出術後に化学療法だけが行われていることが多く、より年齢の高い症例には放射線治療を含む治療が行われていたことが多かったことに注意が必要である。この試験は比較試験ではなく、治療毎の症例背景も異なることから、3歳未満の症例に摘出術後放射線治療に意義があると結論づけるのは難しい。
SEERのデータベースからの検討結果2)も報告されている。3歳未満の症例の多くが摘出術後照射を受けておらず、摘出術後照射なしの3歳未満の症例は比較的予後不良であった。一方で、摘出術後照射を受けた症例は他の年齢層の症例と同様の生存率であったことから、3歳未満の症例にも放射線治療を追加することで腫瘍制御が期待できる可能性が示唆されたが、結論を得るためには今後の臨床試験が望まれる、と結んでいる。
HIT-SKK 87試験では、登録された3歳未満の症例についてサブ解析による結果3)が示されている。生存に関する予後良好因子として、摘出術後照射が示された。
Merchant TEらは2つの報告4, 5)を行っている。双方とも放射線治療の方針は、1.5歳未満の全摘出例には54 Gy/30回、それ以外の症例には59.4 Gy/33回の投与線量が設定されていた。2019年の頭蓋内限局性上衣腫153例の単施設前方試験の報告5)では、ほとんどの症例に摘出術後に放射線治療が実施されていた。諸家の報告と比較して、3歳未満の症例の治療成績が比較的良好であったこと、有害事象も脳幹壊死は1.6%と多くなかったことから、3歳未満の症例についても摘出術後の放射線治療を奨めている。ACNS0121試験は、COG(Children Oncology Group)による多施設前方視試験であり、全摘出できたテント上のWHO grade IIの腫瘍は経過観察、部分切除例にはsecond look surgeryでの全摘出を期待して化学療法が設定された。摘出術後に放射線治療を受けた3歳未満とそれ以上の年齢の症例のEFSが類似したことから、3歳未満の症例にも摘出術後に放射線治療を行うことを推奨している。
4つの独立した後方視研究をまとめた820例を対象とした報告6)がある。小児の後頭蓋上衣腫について分子生物学的サブタイプ(PFA・PFB)を含めて予後因子解析が行われた。OSに関連した最も強い予後因子はPFA・PFBの分子生物学的サブタイプであり、他に摘出率や摘出術後放射線治療の有無が挙げられた。4歳以下の後頭蓋例ではPFAが多くを占めていた。PFAで亜全摘の症例は予後不良であり、PFAが多くを占める4歳以下の症例には放射線治療の追加を推奨している。一方で、若年時に放射線治療を施行した症例には長期的に重篤な影響が残るため、摘出術後早期の放射線治療回避の臨床試験を検討するために、このサブタイプでの治療選択や層別化が重要であるとしている。
このように腫瘍制御のためには、放射線治療は3歳未満の症例に対する有効性が示唆されているが、明確に摘出術後に放射線治療を施行すべきといえる結果はない。一方で、乳幼児への放射線治療による晩期脳障害は、低年齢になるほど脳の脆弱性が高いため増強してしまう。そのため、乳幼児への放射線治療を遅延あるいは回避させるための臨床試験や臨床研究は少なくない1-10)。
POG(Pediatric Oncology Group)が行った介入試験では、3歳未満の悪性脳腫瘍に対して摘出術後化学療法を行うことで放射線治療の遅延あるいは回避が可能かを検討した7)。1986年から1990年に登録された乳幼児の悪性脳腫瘍症例に放射線治療前の摘出術後化学療法を行なった試験で、36か月未満の悪性脳腫瘍198例が対象であった。摘出術後化学療法はCPA+VCRレジメとCDDP+VP-16レジメンを繰り返し行い、24か月未満の132例には2年間の、24〜36か月の66例には1年間の化学療法を行うか、その期間内に病変が進行すれば放射線治療が行われた。全腫瘍の奏効率(CR+PR)は39%で、髄芽腫、悪性神経膠腫、上衣腫の順に高く、脳幹神経膠腫、胎児腫瘍では低かった。PFSは、24~36か月児は1年41%、24か月未満児は2年39%であり、化学療法によるCR例ではPFSがGTR例に近い値となった。中枢神経障害はベースラインと1年後で明らかな低下は示されなかった。化学療法後の放射線治療遅延による認知機能低下も有意に上昇しないことから、肉眼的全摘出例や化学療法でCRを得た症例には放射線治療の遅延が可能であり、症例によっては放射線治療回避も可能と結論している。さらに、同じPOGによる化学療法の強化で3歳未満の小児悪性脳腫瘍に放射線治療の遅延が可能なレジメンがあるか検討した介入試験のサブ解析の報告8)がある。1992年に開始され338例が登録された。上衣腫に関しては強化化学療法でもOSの延長は認めなかったが、EFSは改善しており、化学療法の強化により放射線治療を遅延させられる可能性を示唆している。さらに、United Kingdom Children's Cancer Study Group/ International Society of Paediatric Oncology (UKCCSG/SIOP)による3歳未満の悪性脳腫瘍の患児を対象に、化学療法の強度を高めて放射線治療を回避・遅延させることを目的とした臨床試験(CNS9204試験)があり、その中のサブ解析の一つに頭蓋内上衣腫を対象とした報告9)がある。結果は、1992年から2003年に89例が登録され、80例の限局性頭蓋内上衣腫例のうち化学療法中の増悪で放射線治療が施行されたのは34例であった。80例のOSとEFSは3年で79.3%と47.6%、5年で63.4%と41.8%であり、比較的多くの症例で放射線療法を回避あるいは遅延させつつ、生存率を損なうことがなかったとしている。まとめとして、3歳未満の上衣腫例では化学療法による放射線治療の回避も重要な役割を果たす可能性があるとしている。
Head Start Ⅲは、放射線治療の遅延や回避の可能性を探究した前方視的臨床試験である10)。強力な化学療法で放射線治療を遅延させることが可能か検討した多施設臨床試験であり、2004年から2009年に登録された10歳未満の頭蓋内上衣腫を対象とした。この報告の結論は、テント上上衣腫では放射線治療を遅延あるいは回避できる可能性があるものの、後頭蓋窩上衣腫では難しいのではないか、というものであった。
このように、放射線治療により腫瘍制御の可能性は高まるが、放射線治療による脳障害を含む晩期合併症が増加してしまうこともあり、それぞれの研究で相反する結果が生じている可能性がある。放射線治療の有効性を示すことができる十分に良くデザインされた臨床試験は今までないことから、予後不良である3歳未満の上衣腫症例に摘出術後早期に放射線治療をすべきか、の答えを出すのは現状では難しい。
|

|
| |
|
| |
引用文献
|
| |
|
| 1) |
Purdy E, Johnston DL, Bartels U, et al. Ependymoma in children under the age of 3 years: a report from the Canadian Pediatric Brain Tumour Consortium. J Neurooncol. 2014;117(2): 359-64.
|
| 2) |
Koshy M, Rich S, Merchant TE, et al. Post-operative radiation improves survival in children younger than 3 years with intracranial ependymoma. J Neurooncol. 2011;105(3): 583-90.
|
| 3) |
Timmermann B, Kortmann RD, Kühl J, et al. Role of radiotherapy in anaplastic ependymoma in children under age of 3 years: results of the prospective German brain tumor trials HIT-SKK 87 and 92. Radiother Oncol. 2005;77(3): 278-85.
|
| 4) |
Merchant TE, Li C, Xiong X, et al. Conformal radiotherapy after surgery for paediatric ependymoma: a prospective study. Lancet Oncol. 2009;10(3): 258-66.
|
| 5) |
Merchant TE, Bendel AE, Sabin ND, et al. Conformal Radiation Therapy for Pediatric Ependymoma, Chemotherapy for Incompletely Resected Ependymoma, and Observation for Completely Resected, Supratentorial Ependymoma. J Clin Oncol. 2019;37(12): 974-83.
|
| 6) |
Ramaswamy V, Hielscher T, Mack SC, et al. Therapeutic Impact of Cytoreductive Surgery and Irradiation of Posterior Fossa Ependymoma in the Molecular Era: A Retrospective Multicohort Analysis. J Clin Oncol. 2016;34(21): 2468-77.
|
| 7) |
Duffner PK, Horowitz ME, Krischer JP, et al. Postoperative chemotherapy and delayed radiation in children less than three years of age with malignant brain tumors. N Engl J Med. 1993;328(24): 1725-31.
|
| 8) |
Strother DR, Lafay-Cousin L, Boyett JM, et al. Benefit from prolonged dose-intensive chemotherapy for infants with malignant brain tumors is restricted to patients with ependymoma: a report of the Pediatric Oncology Group randomized controlled trial 9233/34. Neuro Oncol. 2014;16(3):457-65.
|
| 9) |
Grundy RG, Wilne SA, Weston CL, et al; Children's Cancer and Leukaemia Group (formerly UKCCSG) Brain Tumour Committee. Primary postoperative chemotherapy without radiotherapy for intracranial ependymoma in children: the UKCCSG/SIOP prospective study. Lancet Oncol. 2007;8(8):696-705.
|
| 10) |
Venkatramani R, Ji L, Lasky J, et al. Outcome of infants and young children with newly diagnosed ependymoma treated on the "Head Start" III prospective clinical trial. J Neurooncol. 2013;113(2):285-91.
|
|
|

|
| 目次へ戻る!
|

|
| |
CQ4 全脳全脊髄照射は有用か?
|

|
| |
推奨
脊髄播種のない症例に対しては、全脳全脊髄照射を施行しないことを強く推奨する。 (推奨度1C)
脊髄播種を有する症例に対しては、全脳全脊髄照射を施行することを強く推奨する。(推奨度1D)
|
|

|
| |
解説
|

|
| |
|
頭蓋内上衣腫は髄液播種を来しやすい腫瘍であり、かつては全脳全脊髄照射を用いられることが多かった。その後は全脳全脊髄照射、全脳照射、後頭蓋窩照射、局所照射、定位放射線照射など照射範囲に関して多彩な方法が報告されてきた1-17)。より望ましい照射範囲を決定するための十分にデザインされたランダム化比較試験や前方視研究は実施されておらず、現段階では確定的な結論を導くことはできない。
比較的症例数の多い前・後方視的研究で、頭蓋内限局性上衣腫に関する放射線治療の照射範囲について検討した18の報告1-17)があった。その中で、頭蓋内限局性上衣腫には予防的な全脳全脊髄照射は必要ないであろうと結論した報告1-6, 8 ,9 ,11-16)が14と多くを占めていた。
予防的な全脳全脊髄照射は不要と結論した報告の中で、無作為化比較試験のサブ解析や症例数の多い前・後方視研究の結果を示す。1974-2006年にハイデルベルグ大学にて限局性頭蓋内上衣腫57例に対して摘出術後放射線治療をした後方視的研究4)が報告されている。WHO gradeⅠ/Ⅱが27例、Grade Ⅲが30例であった。4症例の粘液乳頭状上衣腫が含まれている。41例に後頭蓋窩照射、16例に全脳全脊髄照射が併用され、最終的に腫瘍床に54 Gy/30回を目指して局所照射が追加された。3年、5年全生存率は各々83%、71%で、後頭蓋窩照射併用群と全脳全脊髄照射併用群の間で有意差を認めなかった。5年局所非再発率と5年無遠隔転移生存率は後頭蓋窩照射併用群で60%、83%で、全脳全脊髄照射併用群で67%、93%であり、いずれも有意差を認めなかった。全生存に影響する因子として、腫瘍床への投与線量45 Gy以上が示され、照射範囲よりも局所線量の増加が重要であると結論された。1964-2006年にフロリダ大学にて限局性頭蓋内上衣腫 (44例)に対して放射線治療を施行した後方視的研究1)の報告もある。上衣下腫、上衣芽細胞腫および再照射例は除外されている。29例に局所照射が施行され、11例に全脳全脊髄照射が併用されていた。いずれの方法においても再発形式は95%が局所再発であり、残りの5%は局所再発なしの脊髄播種であった。全脳全脊髄照射を受けた症例は一例も脊髄への再発を認めなかったが、全生存と無病生存の双方ともに予後因子として放射線治療法は示されず、予防的な全脳全脊髄照射の有用性は認められなかった。まとめると、予防的全脳全脊髄照射の併用により無脊髄播種生存率や脊髄播種出現率は改善されるが、局所照射のみの再発形式も摘出腔周囲の局所かそれに加えて脊髄播種を伴ったものが多く、脊髄播種のみの症例はわずかであった。また他の報告も、照射範囲は全生存期間・無病生存期間の予後因子とはならず1-6, 8, 9, 11, 13- 16)、局所への投与線量が全生存期間・無病生存期間の予後因子である8, 12-15)とするものが多い.これらの結果から、頭蓋内限局性上衣腫には、全脳全脊髄照射や全脳照射などの広範囲の照射を行うよりも、局所照射を用いて腫瘍への投与線量増加を目指すのが良いと考えられている。また、これらの報告の中で、脊髄播種を有する頭蓋内上衣腫に関しては治療的全脳全脊髄照射を用いているが、成績は十分とは言えず、より良い治療の開発が待たれるとする報告が多く認められた。
なお、定位放射線治療による報告もみられたが、一つの報告5)のみで症例数も12例と少ないため参考程度と考えるべきである。著者らは照射野外の再発率や全生存率が過去の全脳全脊髄照射や後頭蓋窩照射を併用していた時期の結果と大きな違いがないことから、定位放射線治療は許容される治療となるかもしれない、と結んでいる。
以上の結果から、腫瘍局在やWHO gradeに関係なく、限局性頭蓋内上衣腫に対しては全脳全脊髄照射や全脳照射などの広い照射範囲は必要とはせず、局所照射が推奨される。一方で、脊髄播種を有する頭蓋内上衣腫には、他の有効な治療がないとの理由もあるが、全脳全脊髄照射が推奨される。なお3歳児未満の症例には、別項に記載しているとおり、症例に応じて判断することになるが、再発時に速やかに放射線治療を実施できる体制を取った上で、化学療法を先行させて放射線治療を遅延させる方法を検討する等、乳幼児への放射線障害を低減する方法を常に念頭におくことが重要である。
|

|
| |
|
| |
引用文献
|
| |
|
| 1) |
Swanson EL, Amdur RJ, Morris CG, et al. Intracranial ependymomas treated with radiotherapy: long-term results from a single institution. J Neurooncol. 2011;102(3): 451-7.
|
| 2) |
Messahel B, Ashley S, Saran F, et al. Relapsed intracranial ependymoma in children in the UK: patterns of relapse, survival and therapeutic outcome. Eur J Cancer. 2009;45(10): 1815-23.
|
| 3) |
Merchant TE, Li C, Xiong X, et al. Conformal radiotherapy after surgery for paediatric ependymoma: a prospective study. Lancet Oncol. 2009;10(3): 258-66.
|
| 4) |
Combs SE, Kelter V, Welzel T, et al. Influence of radiotherapy treatment concept on the outcome of patients with localized ependymomas. Int J Radiat Oncol Biol Phys. 2008;71(4): 972-8.
|
| 5) |
Combs SE, Thilmann C, Debus J, et al. Local radiotherapeutic management of ependymomas with fractionated stereotactic radiotherapy (FSRT). BMC Cancer. 2006;6: 222.
|
| 6) |
Jaing TH, Wang HS, Tsay PK, et al. Multivariate analysis of clinical prognostic factors in children with intracranial ependymomas. 2004;68(3): 255-61.
|
| 7) |
Ben Ammar CN, Kochbati L, Frikha H, et al. Primitive intracranial ependymomas. Salah-Azaîz institute experience. Cancer Radiother. 2004;8(2): 75-80.
|
| 8) |
Merchant TE, Mulhern RK, Krasin MJ, et al. A Sanford. Preliminary results from a phase II trial of conformal radiation therapy and evaluation of radiation-related CNS effects for pediatric patients with localized ependymoma. J Clin Oncol. 2004;22(15): 3156-62.
|
| 9) |
Oya N, Shibamoto Y, Nagata Y, et al. Postoperative radiotherapy for intracranial ependymoma: analysis of prognostic factors and patterns of failure. J Neurooncol. 2002;56(1): 87-94.
|
| 10) |
McLaughlin MP, Marcus RB Jr, Buatti JM, et al. Ependymoma: results, prognostic factors and treatment recommendations. Int J Radiat Oncol Biol Phys. 1998;40(4): 845-50.
|
| 11) |
Merchant TE, Haida T, Wang MH, et al. Anaplastic ependymoma: treatment of pediatric patients with or without craniospinal radiation therapy. J Neurosurg. 1997;86(6): 943-9.
|
| 12) |
Stüben G, Stuschke M, Kroll M, et al. Postoperative radiotherapy of spinal and intracranial ependymomas: analysis ofprognostic factors. Radiother Oncol. 1997;45(1): 3-10.
|
| 13) |
Carrie C, Mottolese C, Bouffet E, et al. Non-metastatic childhood ependymomas. Radiother Oncol. 1995;36(2): 101-6.
|
| 14) |
Rousseau P, Habrand JL, Sarrazin D, et al. Treatment of intracranial ependymomas of children: review of a 15-year experience. Int J Radiat Oncol Biol Phys. 1994;28(2): 381-6.
|
| 15) |
Kovalic JJ, Flaris N, Grigsby PW, et al. Intracranial ependymoma long term outcome, patterns of failure. J Neurooncol. 1993;15(2): 125-31.
|
| 16) |
Chiu JK, Woo SY, Connelly AJ, et al. Intracranial ependymoma in children: analysis of prognostic factors. J Neurooncol. 1992;13(3): 283-90.
|
| 17) |
Shaw EG, Evans RG, Scheithauer BW, et al. Postoperative radiotherapy of intracranial ependymoma in pediatric and adult patients. Int J Radiat Oncol Biol Phys. 1987;13(10): 1457-62.
|
|
|

|
| |
|
[課題2のシステマティックレビュー結果]
CQ2-4のクリニカルクエスチョンに答えるため、下記検索式による検索を行った。
|
| |
|
| ((((((((((((((outcome*[tiab]) OR (prognos*[tiab])) OR (impair*[tiab])) OR (late effect*[tiab])) OR (cognitive[tiab])) OR (development*[tiab])) OR (disorder*[tiab])) OR (risk factor*[tiab])) OR (side effect*[tiab])) OR (adverse effect*[tiab])) OR (toxi*[tiab])) OR (damage[tiab])) OR (sequela*[tiab])) AND (((("Ependymoma"[Mesh:NoExp] OR ependymoma*[tiab] OR ependymal tumo*[tiab]) AND ("Brain Neoplasms"[Mesh] OR Brain[tiab] OR Cerebral*[tiab] OR Cerebellar*[tiab] OR Infratentorial*[tiab] OR supratentorial*[tiab] OR subtentorial*[tiab] OR Intracranial*[tiab] OR Ventricle*[tiab] OR Posterior Fossa*[tiab])) AND ("Radiotherapy"[Mesh] OR "radiotherapy" [Subheading] OR Radiotherapy[tiab] OR Irradiation[tiab] OR reIrradiation[tiab] OR "Proton therapy"[tiab] OR "radiation therapy"[tiab])) AND (1900/1/1: 2019/12/31 [dp]))) NOT (Case Reports[pt])
以上の検索式より、1次スクリーニングとして557文献を抽出し、2次スクリーニングとして187文献を抽出し、ハンドサーチによる2文献を加え、最終的に95文献の構造化抄録を作成した。それらに基づいて推奨と解説文を作成した。
|
|

|
| 目次へ戻る!
|

|
| 課題3:化学療法
|

|
| |
CQ5 化学療法は推奨されるか?
|

|
| |
推奨
3歳以上症例に対して
1)摘出術後に化学療法を行わないことを弱く推奨する。(推奨度2C)
2)二期的摘出を前提とした化学療法を行うことを弱く推奨する。(推奨度2C)
3歳未満症例に対して
乳幼児に対する放射線治療による晩期合併症を軽減するために、放射線治療時期を遅延させる目的で化学療法を先行することを弱く推奨する。(推奨度2C)
|
|

|
| |
解説
|

|
| |
|
診断時3歳以上症例
化学療法の生存への寄与について直接比較した報告がなく、化学療法の効果に関する情報は非常に限定的である1-5)。一定数以上(20例以上)の症例を前方視的に収集した報告は4編しかなく1-4)、うち3編は化学療法を含む治療全体での評価であり、これまでの報告と比べて生存率の向上は得られなかったとしている1-3)。残りの一編は摘出術後に腫瘍が残存した例で腫瘍の縮小を期待して化学療法を行い、その後二期的手術で全摘を目指し、その後局所放射線治療を行うという試験である4)。本試験では、摘出術後腫瘍残存例でも化学療法で腫瘍縮小が得られ、二期的手術で全摘することで、初回手術で全摘された症例に匹敵する成績が得られたと報告されている。腫瘍縮小効果については、放射線治療前に化学療法が行われ、奏効が記載されているのは上記の報告のうち2件の試験であるが、完全および部分奏効が50-60%の症例で認められている3,4)。このように、化学療法で腫瘍が縮小する一群が存在する。効果のあった化学療法はシクロホスファミド(CPA)またはイホスファミド(IFM)、エトポシド(VP-16)、ビンクリスチン(VCR)併用レジメンまたはこれらにシスプラチン(CDDP)を追加したものである。しかし、腫瘍に対する縮小効果は二期的手術の介入がなければ最終的な生存期間の延長に繋がっておらず、化学療法の有無を直接比較した臨床成績が報告されていない現時点では化学療法が生存期間延長に直接寄与するかについては明確ではない。
|

|
| |
|
診断時3歳未満症例
乳幼児期の放射線治療への脳の脆弱性を考慮して、放射線治療を回避または遅延させる目的で摘出術後化学療法の有用性についての検討が行われてきた6-13)。しかし、3歳以上を対象とした上述の試験同様、これまで直接比較する試験が行われていないため、その有用性については明確とは言い難く、これまでのところ、化学療法の実施によって放射線治療を不要とする、または、その時期を3歳以降まで遅らせることができるかについては、相反する報告が見られる。これには化学療法レジメンの違いなどが影響している可能性がある。化学療法への奏効について記載のある4編のうち、3編では30%程度の奏効が報告されており6-8)、その中のひとつではテント上発症例の方が奏効した割合が高いと述べている6)。その他の報告のうち、UKCCSG(英国小児がんグループ)/SIOP(欧州小児がんグループ)で行われた試験では施行された化学療法の強度が強い方が予後良好であったとしているほか9)、POG(米国小児がんグループ)の強度の異なる2種類の化学療法レジメンの比較試験では、強度の高いレジメンによる生存期間延長への寄与はなかったものの、2年無イベント生存率は有意に良好であった10)。なお、これらの試験での放射線治療の適応は、3歳到達時、化学療法終了時の腫瘍残存例、再発時など様々であるが、摘出術後、化学療法を先行させ、一定期間は放射線治療を行わない点は共通している。一方、化学療法の副作用としてPOGの試験では3%程度の化学療法による死亡例が発生し、またUKCCSG/SIOPのレジメンでも死亡例はないものの全例でCommon Terminology Criteria for Adverse Events (CTCAE) grade 4の血液毒性が観察されている。
このように、一定以上の強度を有する化学療法には上衣腫に対し抗腫瘍効果があると考えられる。しかし、3歳以上での報告同様、生存期間延長への寄与は明確ではなく、現時点では、一定期間放射線治療の開始を遅らせるあるいは再発の時期を遅らせる可能性が示唆されるに止まる。従って、晩期放射線合併症の観点から、化学療法の毒性を理解した上で、放射線治療を摘出術後直ちには行わない場合の選択肢とはなり得る。
|

|
| |
根拠
|

|
| |
|
1.化学療法の有無による違いの検討
AIEOP(イタリア小児がんグループ)のコホート研究では、多分割放射線治療に加え、摘出術後腫瘍残存例(17例)にのみ、摘出術後化学療法(VCR,CPA,VP-16)を行ったが、化学療法を行わなかった全摘例(46例)と比べ、無増悪生存率、全生存率とも有意に不良であり、化学療法は予後不良である腫瘍残存例の治療成績を向上させることはできなかった。化学療法関連死亡はなかった3)。また、単一施設での後方視的調査でも摘出術後化学療法(CDDP,VCR,VP-16,CPA,カルボプラチン(CBDCA))を行った群(17例)と,化学療法なし群(21例)では、化学療法群で無増悪生存率が低い傾向が認められた5)。
一方、3歳以上を対象として腫瘍縮小を得た後に二期的手術で全摘を目指す目的で、摘出術後残存腫瘍のある例にのみ放射線治療前化学療法(VCR,VP-16,CDDP,CPA)を実施したCOG(米国小児がんグループ)のコホート研究がある4)。摘出術後腫瘍残存化学療法実施41例と、全摘出43例(補助療法は放射線治療のみ)の5年無増悪生存率、全生存率ともそれぞれ約50%と70%と、一般的には腫瘍残存例の方が予後不良にも関わらず差がなかった。しかし、化学療法の恩恵を受けたのは、化学療法で腫瘍縮小が得られ二期的手術で90%以上の腫瘍摘出が可能であった例に限られた。
このように、化学療法が直接生存に寄与していることを示す情報はなく、化学療法の役割は、残存腫瘍の全摘を可能とするために、残存腫瘍を縮小させることに留まり、あくまで二期的摘出を前提とした場合のみに考慮して良い。なお、化学療法奏効率は50%程度であり、COGのコホートでは化学療法関連死は2.4%であった4)。
|

|
| |
|
2.化学療法の内容・投与法についての検討
これまで化学療法についての無作為割り付け試験は3件の報告があるが、化学療法の有無ではなくレジメンの比較を目的とするものである。うち1件は放射線治療を併用した上での化学療法レジメンの比較で、VCR,CCNU,プレドニゾロン群(14例)と,8-drug in-1レジメン(18例)を比較した。5年無増悪生存率、全生存率ともに差はなかった。化学療法死が1例に認められている1)。
他の2件は3歳未満の小児悪性脳腫瘍を対象とした非照射での化学療法レジメンの比較であり、その中に含まれる上衣腫のサブクラス解析である。CCGでは摘出術後寛解導入化学療法としての、レジメンA(VCR,CDDP,CPA,VP-16)(35例)とレジメンB(VCR,CBDCA,IFM,VP-16)(39例)に74例を割り付けたが、奏効率、無増悪生存率に差はなかった7)。また、POGの試験では化学療法(CPA,VCR,CDDP,VP-16)の用量の違いの比較であったが、1.8倍へ投与量を増やすことで無増悪生存率は改善したが(p = 0.0062),全生存率は改善しなかった。WHO grade Ⅲのみを対象とすると,1.8倍投与+放射線治療群で全生存率が良く,標準投与量(放射線の有無にかかわらず)や放射線なし(化学療法の量にかかわらず)より優れていた10)。
無作為割り付け試験ではないが、3歳未満上衣腫に対する非照射での化学療法を実施したUKCCSG/SIOPの試験がある。化学療法は約1年間繰り返すが、実際に投与された抗がん剤の用量と予後との関係を後方視的に検討したところ、用量が多いほど治療成績は良好であった9)。
以上のように、化学療法の有用性が明らかではない状況での化学療法レジメンの検討であるが、4件中、3歳未満を対象とした2件では予後と抗がん剤の用量とに弱いながらも関係がみられた。これらの試験では、化学療法関連死亡が0-10%で観察された。
|

|
| |
|
3.自家造血幹細胞移植併用大量化学療法に関する報告
WHO grade Ⅲのみ,テント上下発症例を対象とした研究がある.摘出術後29例に寛解導入療法(CDDP,VCR,VP-16,CPA,メトトレキサート:MTX),地固め療法(CBDCA,ThioTEPA,VP-16)を施行、放射線は3歳以上の後頭蓋例の全てとテント上の残存例、3歳未満 (35ヶ月以下)の残存例に併用した。5年無増悪生存率が12%,5年全生存率が38%であり、過去の報告と比べ明らかな予後改善・延命効果はなく、逆に化学療法関連死が10.3%で認められた8)。
|

|
| |
|
4.化学療法と放射線治療の順に関する報告
3歳以上のWHO grade Ⅲ,テント上下例を対象とした報告がある。1990年まではIFM, VP-16,MTX,CDDP,シタラビン,1991年以降はCDDP,CCNU,VCRを使用し、放射線前化学療法2コース先行の40例と放射線後化学療法15例を検討した。3年無増悪生存率はともに60%台と差はなかった2)。
|

|
| |
|
5.テント上下で化学療法の有効性の違いを記述した報告
WHO grade ⅡとⅢを対象としたコホート研究がある。摘出術後残存腫瘍19例に対しCDDP,VP-16,CPA,MTX,temozolomide (TMZ),CBDCAを自家造血細胞移植併用で使用した。テント上では全8例で完全奏効が得られ、再発は1例で3年全生存率は100%であったが、後頭蓋窩では完全奏効が11例中4例、再発が8例で3年全生存率は73%と低かった。以上より、後頭蓋窩では放射線治療が必要であると結論している。対象者に化学療法死はなく、一過性の副作用のみを(発生率記載なし)認めた6)。
|

|
| |
|
6.乳幼児例での化学療法による放射線治療実施時期遅延に関する報告
乳幼児例(3-4歳以下)で脳の脆弱性による放射線晩期合併症について、化学療法を先行させることで、摘出術後放射線治療を遅延または回避できないかを検証した試験が複数存在する。
その中で、最も症例数の多いものとして、3歳以下(47ヶ月以下)のWHO grade ⅡとⅢ,テント上下の89例を対象とし、摘出術後VP-16,CBDCA,MTX,CPA,CDDPを含む化学療法を約1年間実施、進行時のみに放射線治療を行った試験(UKCCSG/SIOP)では、転移のない80例の5年間累積非照射率42%、5年無イベント生存率と全生存率はそれぞれ41.8%と63.4%、放射線治療実施年齢中央値3.6歳であった。また、全摘例とそれ以外の例とで生存率の差はなかった。以上より、化学療法により照射時期の遅延は可能と結論している。化学療法関連死亡は観察されなかった9)。
この他にも小規模ながら主なものとして8件の報告がある。多くは放射線治療は化学療法終了時の腫瘍残存例または進行時としており、3-4年無イベント生存率0-30%、全生存率50%前後である6-8, 10-13)。これらの試験に含まれる予後良好であるテント上発症例、全摘例、WHO grade II例の割合には大きな差はないが、用いられている化学療法は様々である。前述のPOG、UKCCSG/SIOPの試験では化学療法の強度が成績に影響することを示唆している9-11)。
|

|
| |
|
注意: |
本邦では上衣腫に適応が認められた薬剤はないが、ビンクリスチン、シスプラチン、エトポシド、チオテパなどは適応症として小児悪性固形腫瘍がある。 |

|
| |
|
| |
引用文献
|
| |
|
| 1) |
Robertson PL, Zeltzer PM, Boyett JM, et al. Survival and prognostic factors following radiation therapy and chemotherapy for ependymomas in children: a report of the Children's Cancer Group. J Neuro Surg. 1998; 88(4):695-703.
|
| 2) |
Timmermann B, Kortmann RD, Kühl J, et al. Combined postoperative irradiation and chemotherapy for anaplastic ependymomas in childhood: results of the German prospective trials HIT 88/89 and HIT 91. Int J Radiat Oncol Biol Phys. 2000; 46(2):287-95.
|
| 3) |
Massimino M, Gandola L, Giangaspero F, S et al; AIEOP Pediatric Neuro-Oncology Group. Hyperfractionated radiotherapy and chemotherapy for childhood ependymoma: final results of the first prospective AIEOP (Associazione Italiana di Ematologia-Oncologia Pediatrica) study. Int J Radiat Oncol Biol Phys. 2004; 58(5):1336-45.
|
| 4) |
Garvin JH Jr, Selch MT, Holmes E, et al; Children's Oncology Group. Phase II study of pre-irradiation chemotherapy for childhood intracranial ependymoma. Children's Cancer Group protocol 9942: a report from the Children's Oncology Group. Pediatr Blood Cancer. 2012; 59(7):1183-9.
|
| 5) |
Pejavar S, Polley MY, Rosenberg-Wohl S, et al. Pediatric intracranial ependymoma: the roles of surgery, radiation and chemotherapy. J Neurooncol. 2012; 106(2):367-75.
|
| 6) |
Venkatramani R, Ji L, Lasky J, Haley K, J et al. Outcome of infants and young children with newly diagnosed ependymoma treated on the "Head Start" III prospective clinical trial. J Neurooncol. 2013; 113(2):285-91.
|
| 7) |
Geyer JR, Sposto R, Jennings M, et al; Children's Cancer Group. Multiagent chemotherapy and deferred radiotherapy in infants with malignant brain tumors: a report from the Children's Cancer Group. J Clin Oncol. 2005; 23(30):7621-31.
|
| 8) |
Zacharoulis S, Levy A, Chi SN, et al. Outcome for young children newly diagnosed with ependymoma, treated with intensive induction chemotherapy followed by myeloablative chemotherapy and autologous stem cell rescue. Pediatr Blood Cancer. 2007; 49(1):34-40.
|
| 9) |
Grundy RG, Wilne SA, Weston CL, et al; Children's Cancer and Leukaemia Group (formerly UKCCSG) Brain Tumour Committee. Primary postoperative chemotherapy without radiotherapy for intracranial ependymoma in children: the UKCCSG/SIOP prospective study. Lancet Oncol. 2007; 8(8):696-705.
|
| 10) |
Strother DR, Lafay-Cousin L, Boyett JM, et al. Benefit from prolonged dose-intensive chemotherapy for infants with malignant brain tumors is restricted to patients with ependymoma: a report of the Pediatric Oncology Group randomized controlled trial 9233/34. Neuro Oncol. 2014; 16(3):457-65.
|
| 11) |
Grill J, Le Deley MC, Gambarelli D, et al; French Society of Pediatric Oncology. Postoperative chemotherapy without irradiation for ependymoma in children under 5 years of age: a multicenter trial of the French Society of Pediatric Oncology. J Clin Oncol. 2001; 19(5):1288-96.
|
| 12) |
Timmermann B, Kortmann RD, Kühl J, et al. Role of radiotherapy in anaplastic ependymoma in children under age of 3 years: results of the prospective German brain tumor trials HIT-SKK 87 and 92. Radiother Oncol. 2005; 77(3):278-85.
|
| 13) |
Massimino M, Gandola L, Barra S, et al. Infant ependymoma in a 10-year AIEOP (Associazione Italiana Ematologia Oncologia Pediatrica) experience with omitted or deferred radiotherapy. Int J Radiat Oncol Biol Phys. 2011; 80(3):807-14.
|
|
|

|
| |
|
[課題3のシステマティックレビュー結果]
このクリニカルクエスチョンに答えるため、下記検索式による検索を行った。
|
| |
|
| ((((((Ependymoma[mh:noexp] OR Ependymoma*[tiab] OR ependymal tumo*[tiab]) AND (Brain Neoplasms[mh] OR Brain[tiab] OR Cerebral*[tiab] OR Cerebellar*[tiab] OR Infratentorial*[tiab] OR supratentorial*[tiab] OR subtentorial*[tiab] OR intracranial*[tiab] OR ventricle*[tiab] OR Posterior Fossa[tiab])) AND ("drug therapy" [sh] OR "Antineoplastic Agents/therapeutic use"[mh] OR "Antineoplastic Agents" [PA])) AND ("Adolescent"[mh] OR "Adult"[mh:NoExp] OR "Young Adult"[mh] OR "Child"[mh] OR "Infant"[mh])) AND (("2017/01/01"[Date - Publication] : "2019/12/31"[Date - Publication]))) AND ((English[Language]) OR (Japanese[Language]))) NOT (Case Reports[Publication Type])
以上の検索式より、1次スクリーニングとして293の文献を抽出し、24の文献の2次スクリーニングを行った後、13の文献の構造化抄録を作成した。それらに基づいて推奨と解説文を作成した。
|
|

|
| 目次へ戻る!
|

|
| 課題4:再発時の治療
|

|
| |
CQ6 再発時の適切な治療法は何か?
|

|
| |
推奨
再手術
再発時に再摘出術を行うことを弱く推奨する。(推奨度2D)
放射線治療
再発時に再照射を行うことを弱く推奨する。(推奨度2C)
化学療法
化学療法は行わないことを弱く推奨する。(推奨度2C)
|
|

|
| |
解説
|

|
| |
|
25歳以下の再発上衣腫117例の予後に関するシステマティックレビューが報告されている。総じて、初回再発からの無増悪生存期間は6.7ヶ月、再発からの生存期間は11.2ヶ月と予後不良であった。その内訳は、再発後の全生存期間は、テント上と後頭蓋窩で、それぞれ8.3、20.1ヶ月であった。再発時の治療別の診断後からの全生存期間は手術24.2ヶ月; 放射線治療 29.2ヶ月; 化学療法 19.3ヶ月であった。また、年齢別では3歳以下31.0ヶ月;3歳以上17.5ヶ月であった1)。再発時の治療は、経過観察、手術, 放射線治療、化学療法単独もしくはこれらの併用が選択されうる2)。CQ6の注意点として、照射未施行症例は除外されている点に注意されたい。照射未施行の症例の再発時には、照射前の残存腫瘍として考えるべきであり、照射以外に手術摘出も考慮する必要がある。
|

|
| |
|
再手術
再発上衣腫に対する再手術は無益とは言えない。再発時に再手術のみを行ったエビデンスレベルの高い報告は限られた。再発後の再手術された17例中、全摘出を達成された12例の5年生存割合が58%3)であり、再発腫瘍に対して再摘出が行われた57例のメタ解析4)では全摘出群と部分摘出群の5年生存割合は、それぞれ44%と23%であった。しかし、機能温存のために初回手術で全摘出が不可能であったならば、再手術も困難である5)。したがって、生活の質を延長できるかどうか、適応を検討の上、症例を選択する6)。
|

|
| |
|
放射線治療
再発時の再照射に関しては、症例背景が不揃いで不十分な期間の観察研究しかない制限があり、エビデンスレベルの高い報告は限られる。再発上衣腫に対する再照射は否定されないが、適応については放射線治療医と十分に検討したほうが良い7)。
268例の小児再発上衣腫に対する再照射について11編の論文をまとめた総説によると、再発後は摘出術と放射線治療が望ましく、もし初回放射線後12ヶ月未満の再発であれば30.6 Gy/17 fr、12ヶ月以上経過しているようであれば36 Gy/20 frが望ましいと述べている8)。最近、全脳全脊髄照射(craniospinal irradiation: CSI)の有用性も報告されるようになってきた。遠隔転移のある症例9例においては、2年無増悪割合12.5%, 2年生存割合 62.5%であった。たとえ、局所再発であってもCSI(1.8 Gy分割で23.4-36 Gyの全脊髄照射に、腫瘍床に54-59.4 Gyを照射)を行なった結果、5年無増悪生存割合が83.3% に対して、局所照射のそれは15.2%に留まったと報告されている9)。
CSIの毒性についても十分考慮しなければならない。Bouffetらは、再発上衣腫に対する54 Gyの最大線量による局所もしくは59.4 GyのCSIの毒性と予後の評価を行った。113例中再発した47例のうち再照射した18例(年齢0.8-8.9歳、テント上4例、後頭蓋窩14例)を評価した。初回手術全摘・亜全摘17例、部分摘出1例で、初発時放射線治療単独群11例、放射線+化学療法群7例であった。その結果、追跡期間中央値2.1 年間 (range, 0.7-5.8年)で、3年生存割合は再照射なし群(7% ± 6%)と比較して、再照射あり群で81% ± 12% (p < 0.0001)と有意に高く、また再照射後から再発までの期間は最初の再発までの期間より有意に長かった。一方で、高次脳機能評価を行なった7例全例で、高次脳機能評価項目全てにおいて低下を認めた。平均3.7年間で18例中2例が内分泌異常を呈し、1例が特別支援教育を要した。
一方で、定位的放射線手術(Stereotactic Radiosurgery: SRS)による腫瘍の局所制御の有用性の報告もある10)。Stauderらは、再発頭蓋内上衣腫に対するSRSの腫瘍制御率および合併症率を明らかにすることを目的とし、26例(49病変;テント上31病変、後頭蓋窩18病変)におけるOS, PFS, LCR, 放射線脳壊死の発生率を後方視的に評価した。各病変に対するmedian marginal doseは 18 Gy (range, 12–24 Gy)であった。生存期間中央値はSRS後5.5 年、無増悪生存期間中央値は14.7ヶ月(range, 2.9ヶ月–11.2年)であった。1年生存割合96%、3年生存割合 69%であった。7例 (27 %)に遠隔腫瘍再発を認めた。照射範囲によるものの2例 (8 %)に症候性放射線壊死を認めた。SRSは比較的短期の局所制御率が良好であり、短期的には生存率を上げる可能性がある11)。12例17病変に対してSRSを実施し、3年間で68%において良好な局所コントロールが得られたという2000年のStaffordらの報告を裏付けた12)。以上より、比較的短期での観察結果しかなく、また放射線壊死を伴う例があるが、SRSは考慮しても良い。
|

|
| |
|
化学療法
1995年以前は、テント上下の再発悪性小児脳腫瘍を対象に化学療法の有効性が検討されていた。症例数は少ないが、その一部に再発上衣腫が含まれており、ここでは、再発上衣腫の結果を抜粋する。1984年にPediatric Oncology Group (POG)より、ビンクリスチン+プロカルバジン+プレドニンとナイトロジェンマスタードを上乗せしたレジメンを比較検討した無作為比較試験の結果が報告された。評価を受けた再発上衣腫10例のうち、CR、PRはそれぞれ1例であった。また、ナイトロジェンマスタードを上乗せした群では高い毒性を認めた13)。
その後、白金製剤もしくはアルキル化剤を基軸とする化学療法が試された。5例の再発上衣腫に対してビンクリスチン、シスプラチンもしくはカルボプラチン、CCNU、エトポシド、ブレオマイシン併用による治療の症例報告が行われたが、CR+PRは1例のみで、PDが3例であった14)。また2005年にイタリアのグループから報告された成人再発上衣腫28例での後方視研究では、白金製剤の有無で有効性が比較されたが、シスプラチンを含むレジメンでも全生存期間、無増悪生存期間に有意差は見られなかった15)。アルキル化剤においては、1993年にFrench Society of Pediatric Oncology (SFOP)がイホスファミド単剤の第2相臨床試験の結果を報告し、8例中CR 0例、PR 1例、OR+SD 5例、PD 2例であった16)。チオテパに関連する検討としては、高用量ブスルファン (150 mg/m2/day) + チオテパ (150 mg/m2/day) +自家骨髄移植に腫瘍部照射(45-55 Gy)を行った報告がある。8例中3例のCR症例が認められたものの、1例の治療合併症死亡例があり、消化管と粘膜障害などの毒性も多く認められ、治療効果に比し毒性が高かった17)。テモゾロミドについては、再手術、再照射を行っても再増悪した18例の成人再発上衣腫に対して投与された。22%の奏効割合(CR+PR)が報告されている18)が、過去に白金製剤などを含む化学療法が行われた例には有効性を認めなかった19)。2007年にChildren’s Oncology Group (COG)が第2相試験を行い、12例中SD 5例、他7例は7コースまでにPDになった20)。
その他の薬剤としては、エトポシドの効果検討がなされ、観察後7ヶ月の段階で、2例でPR、4例でSDであった21)。
以上より、薬剤の有効性が乏しいことから、現状で推奨できる化学療法レジメンはない。少数例で化学療法に反応することがあるが、頻度は低く、また効果があっても生存期間の延長につながることは少ないため、化学療法は行わないことを弱く推奨する。
|

|
| |
|
| |
引用文献
|
| |
|
| 1) |
Byer L, Kline CN, Coleman C, et al. A systematic review and meta-analysis of outcomes in pediatric, recurrent ependymoma. J Neurooncol. 2019;144(3): 445-52.
|
| 2) |
Acquaye AA, Vera E, Gilbert MR, et al. Clinical presentation and outcomes for adult ependymoma patients. Cancer. 2017;123(3): 494-501.
|
| 3) |
Vinchon M, Leblond P, Noudel R,at al. Intracranial ependymomas in childhood: recurrence, reoperation, and outcome. Childs Nerv Syst. 2005;21(3): 221-6.
|
| 4) |
Zacharoulis S, Ashley S, Moreno L, et al. Treatment and outcome of children with relapsed ependymoma: a multi-institutional retrospective analysis. Childs Nerv Syst. 2010;26(7): 905-11.
|
| 5) |
Ruda R, Reifenberger G, Frappaz D, et al. EANO guidelines for the diagnosis and treatment of ependymal tumors. Neuro Oncol. 2018;20(4): 445-56.
|
| 6) |
Barrer SJ, Schut L, Sutton LN, et al. Re-operation for recurrent brain tumors in children. Childs Brain. 1984;11(6): 375-86.
|
| 7) |
Bouffet E, Hawkins CE, Ballourah W, et al. Survival benefit for pediatric patients with recurrent ependymoma treated with reirradiation. Int J Radiat Oncol Biol Phys. 2012;83(5):1541-8.
|
| 8) |
Tsang DS, Laperriere NJ. Re-irradiation for Paediatric Tumours. Clin Oncol (R Coll Radiol). 2019;31(3): 191-8.
|
| 9) |
Tsang DS, Murray L, Ramaswamy V, et al. Craniospinal irradiation as part of re-irradiation for children with recurrent intracranial ependymoma. Neuro Oncol. 2019;21(4): 547-57.
|
| 10) |
Regnier E, Laprie A, Ducassou A, Bet al. Re-irradiation of locally recurrent pediatric intracranial ependymoma: Experience of the French society of children's cancer. Radiother Oncol. 2019;132: 1-7.
|
| 11) |
Stauder MC, Ni Laack N, Ahmed KA, et al. Stereotactic radiosurgery for patients with recurrent intracranial ependymomas. J Neurooncol. 2012;108(3): 507-12.
|
| 12) |
Stafford SL, Pollock BE, Foote RL, et al. (2000) Stereotactic radiosurgery for recurrent ependymoma. Cancer. 2000;88(4): 870-5.
|
| 13) |
Cangir A, Ragab AH, Steuber P, et al. Combination chemotherapy with vincristine (NSC-67574), procarbazine (NSC-77213), prednisone (NSC-10023) with or without nitrogen mustard (NSC-762)(MOPP vs OPP) in children with recurrent brain tumors. Med Pediatr Oncol. 1984;12(1): 1-3.
|
| 14) |
Douek E, Kingston JE, Malpas JS, et al. Platinum-based chemotherapy for recurrent CNS tumours in young patients. J Neurol Neurosurg Psychiatry. 1991;54(8): 722-5.
|
| 15) |
Brandes AA, Cavallo G, Reni M, et al. A multicenter retrospective study of chemotherapy for recurrent intracranial ependymal tumors in adults by the Gruppo Italiano Cooperativo di Neuro-Oncologia. Cancer. 2005;104(1): 143-8.
|
| 16) |
Chastagner P, Sommelet-Olive D, Kalifa C, et al. Phase II study of ifosfamide in childhood brain tumors: a report by the French Society of Pediatric Oncology (SFOP). Med Pediatr Oncol. 1993;21(1): 49-53.
|
| 17) |
Grill J, Kalifa C, Doz F, et al. A high-dose busulfan-thiotepa combination followed by autologous bone marrow transplantation in childhood recurrent ependymoma. A phase-II study. Pediatr Neurosurg. 1996;25(1): 7-12.
|
| 18) |
Ruda R, Bosa C, Magistrello M, et al. Temozolomide as salvage treatment for recurrent intracranial ependymomas of the adult: a retrospective study. Neuro Oncol. 2016;18(2): 261-8.
|
| 19) |
Chamberlain MC, Johnston SK. Temozolomide for recurrent intracranial supratentorial platinum-refractory ependymoma. Cancer. 2009;115(20): 4775-82.
|
| 20) |
Nicholson HS, Kretschmar CS, Krailo M, et al. Phase 2 study of temozolomide in children and adolescents with recurrent central nervous system tumors: a report from the Children's Oncology Group. Cancer. 2007;110(7): 1542-50.
|
| 21) |
Chamberlain MC. Recurrent intracranial ependymoma in children: salvage therapy with oral etoposide. Pediatr Neurol. 2001;24(2): 117-21.
|
|
|

|
| |
|
[課題4のシステマティックレビュー結果]
このクリニカルクエスチョンに答えるため、下記検索式による検索を行った。
|
| |
|
| (((((((((((("Ependymoma"[mh:NoExp] OR ependymoma*[tiab] OR ependymal tumo*[tiab])) AND (("Brain Neoplasms"[mh] OR Brain[tiab] OR Cerebral*[tiab] OR Cerebellar*[tiab] OR Infratentorial*[tiab] OR supratentorial*[tiab] OR subtentorial*[tiab] OR Intracranial*[tiab] OR Ventricle*[tiab] OR Posterior Fossa*[tiab]))) AND (("Recurrence"[mh] OR Recurren*[tiab] OR Neoplasm, Residual[mh] OR Neoplasm Recurrence, Local[mh] OR relaps*[tiab] OR Regrowth[tiab])))) AND (("Infant"[mh] OR "Child"[mh] OR "Adolescent"[mh] OR "Young Adult"[mh] OR "Adult"[mh:NoExp])))) AND 1900/1/1: 2016/12/31 [dp]))) AND ((Japanese[la] OR English[la])))) NOT case reports[pt]
以上の検索式より、1次スクリーニングとして250の文献を抽出し、194の文献の構造化抄録を作成した。それらに基づいて推奨と解説文を作成した。
|
|

|
| 目次へ戻る!
|

|
|

|
| |

|
|

|
|
|

|
|

