 |

|

|
| 中枢神経原発胚細胞腫瘍(CNS germ cell tumor)診療ガイドライン
|

|
| 目 次:各メニューをクリックすると該当項目にリンクします。
|

|
| |
|
| |
|
| |
|

|
| (Ⅰ)ガイドラインサマリー
|

|
| |
| |
<課題1:診断、分類>
|
| |
CQ1 |
: |
中枢神経原発胚細胞腫における腫瘍マーカー(AFP、HCG)の測定は有用か?
|
| |
推奨 |
: |
中枢神経原発胚細胞腫瘍では、腫瘍マーカー(AFP、HCG)を測定することを推奨する。(推奨度1A)
|
| |
CQ2 |
: |
中枢神経原発胚細胞腫瘍における病理組織診断は必要か。
|
| |
推奨 |
: |
中枢神経原発胚細胞腫瘍を疑う症例において、診断確定のためには病理組織による診断を提案する。(推奨度2C)
|

|
| |
<課題2:手術>
|
| |
CQ3 |
: |
ジャーミノーマに対して積極的な摘出手術は必要か。
|
| |
推奨 |
: |
ジャーミノーマに対して積極的な摘出をしないことを推奨する。(推奨度1B)
|
| |
CQ4 |
: |
NGGCTに対して摘出手術は必要か?
|
| |
推奨 |
: |
1. |
成熟奇形腫に対して摘出術を推奨する。(推奨度1B)
|
| |
|
|
2. |
成熟奇形腫以外のNGGCTについては、化学放射線療法を行った後に、残存する腫瘍に対する摘出術を推奨する。(推奨度1C)
|
| |
CQ5 |
: |
中枢神経原発胚細胞腫に合併した水頭症に対して手術は必要か?
|
| |
推奨 |
: |
内視鏡下第3脳室底開窓術などの水頭症を解除する手術を推奨する。(推奨度1B)
|

|
| |
<課題3:ジャーミノーマに対する治療>
|
| |
CQ6 |
: |
ジャーミノーマにおいて化学放射線療法は必要か?
|
| |
推奨 |
: |
1. |
脊髄播種のないジャーミノーマにおいては化学療法を併用した全脳室を照射野内に含める放射線照射を推奨する。(推奨度1B)
|
| |
|
|
2. |
脊髄播種のないジャーミノーマに対しては、予防的脊髄照射を行わないことを強く推奨する。(推奨度1C)
|
| |
|
|
3. |
化学療法単独で治療しないことを推奨する。(推奨度1B)
|

|
| |
<課題4:NGGCTに対する治療>
|
| |
CQ7 |
: |
NGGCTには化学放射線療法を行うことが有用か。
|
| |
推奨 |
: |
成熟奇形腫を除くNGGCTでは化学放射線療法を推奨する。(推奨度1B)
|

|
| |
<課題5:再発時の治療方針>
|
| |
CQ8 |
: |
再発ジャーミノーマに対し救済治療を行う必要があるか。
|
| |
推奨 |
: |
治癒を目指して治療を行うことを推奨する。(推奨度1B)
|
| |
CQ9 |
: |
再発 NGGCT に対し救済治療は有用か。
|
| |
推奨 |
: |
寛解を目指した治療を提案する。治療反応性が不良の場合は、緩和的治療を提案する。(推奨度2C)
|

|
| |
<課題6:長期予後>
|
| |
CQ10 |
: |
中枢神経原発胚細胞腫におけるフォローアップは必要か。
|
| |
推奨 |
: |
可能な限り長期に追跡することを推奨する。(推奨度1B)
|
|

|
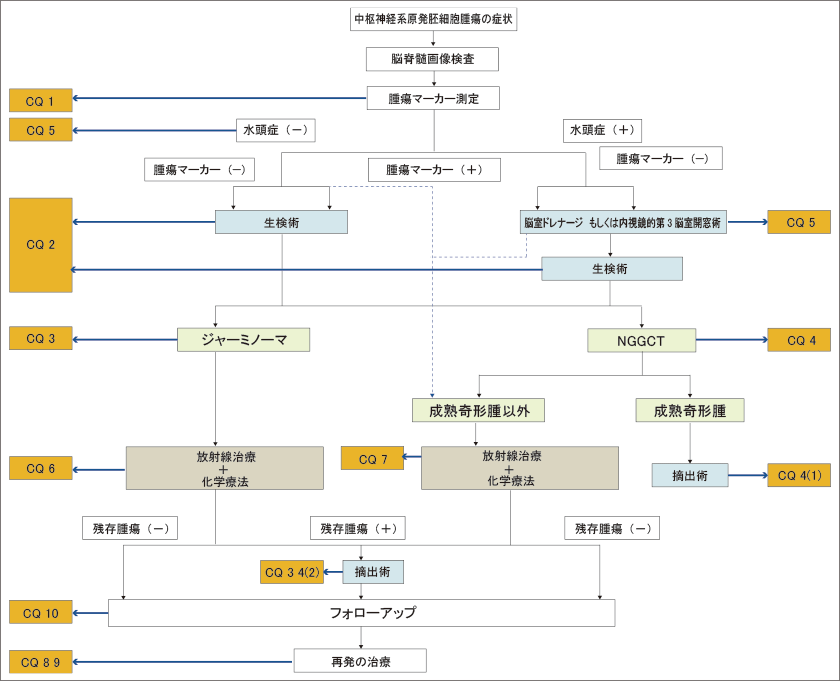
| (Ⅱ)中枢神経原発胚細胞腫瘍の診療アルゴリズム
|

|
| |
|
| 目次へ戻る!
|

|
| (Ⅲ)略語一覧
|

|
| |
| CNS-GCT |
central nervous system germ cell tumor |
| AFP |
α-fetoprotein |
| HCG |
human chorionic gonadotropin |
| β-HCG |
β-subunit of human chorionic gonadotropin |
| STGC |
syncytiotrophoblastic giant cell |
| mTOR |
mammalian target of rapamycin |
| NGGCT |
non-germinomatous germ cell tumor |
| QOL |
quality of life |
| PLAP |
placental alkaline phosphatase |
| HE |
hematoxylin eosin |
| MRI |
magnetic resonance imaging |
| CSI |
cranio-spinal irradiation |
| WVI |
whole ventricle irradiation |
| PE |
carboplatin/etoposide |
| ICE |
ifosphamide/cisplatin/etoposide |
| CDDP |
cisplatin |
| CBDCA |
carboplatin |
| VP-16 |
etoposide |
| Ifos |
ifosphamide |
| MAKEI |
Maligne Keimzelltumoren |
| SIOP |
International Society of Paediatric Oncology |
| SFOP |
Société Française d´Oncologie Pédiatrique |
| COG ACNS |
Chirdren’s Oncology Group / American Clinical neurophysiology society |
| KSPNO |
Korean Society of Pediatric Neuro-oncology |
| LH/FSH |
luteinizing hormone/ follicle stimulating hormone |
| ACTH |
adrenocorticotropic hormone |
| TSH |
thyroid stimulating hormone |
| GH |
growth hormone |
| PRL |
prolactin |
|

|
| 目次へ戻る!
|

|
| (Ⅳ)作成組織・作成方針
|

|
| 1. 作成組織
|

|
| |
1.1. 作成主体
|

|
| |
|
共通目次と共通項目参照
|

|
| |
1.2. 診療ガイドライン作成グループ
|

|
| |
中枢神経原発胚細胞腫ガイドライン診療ガイドライン作成グループ
|
| |
|
| |
氏 名 |
所属機関 |
役 割 |
| 委員長 |
中村 英夫 |
久留米大学 脳神経外科/脳神経外科 |
総括 |
| 副委員長 |
柳澤 隆昭 |
東京慈恵会医科大学脳神経外科/小児科 |
CQ5 再発時の治療方針 |
| 委員 |
唐沢 克之 |
都立駒込病院 放射線治療科/放射線治療 |
CQ3 放射線治療 |
| 協力委員 |
副島 俊典 |
神戸陽子線センター 放射線治療科 |
CQ3 放射線治療 |
| 協力委員 |
横尾 英明 |
群馬大学 病態病理学分野/病理診断 |
疾患の特徴 |
| 委員 |
西川 亮 |
埼玉医科大学国際医療センター 脳脊髄腫瘍科/放射線治療 |
CQ6 長期予後 |
| 委員 |
藤巻 高光 |
埼玉医科大学病院 脳神経外科/放射線治療 |
CQ1 診断、分類 |
| 協力委員 |
原 純一 |
大阪市立医療センター 小児血液腫瘍科/小児科 |
CQ4 化学療法 |
| 委員 |
寺島 慶太 |
国立成育医療研究センター 小児がんセンター
脳神経腫瘍科/小児科 |
CQ4 化学療法 |
| 委員 |
園田 順彦 |
山形大学 脳神経外科/脳神経外科 |
CQ2 手術 |
| 委員 |
荒川 芳輝 |
京都大学大学院医学研究科 脳神経外科学/脳神経外科 |
CQ2 手術 |
| 委員 |
隈部 俊宏 |
北里大学 脳神経外科/脳神経外科 |
他ガイドラインとの整合性 |
| 委員 |
杉山 一彦 |
広島大学 がん化学療法科/脳神経外科 |
他ガイドラインとの整合性 |
|

|
| |
1.3. システマティックレビューチーム(SR チーム)
|

|
| |
|
| 課題番号 |
課題名 |
課題責任者 |
SR |
| 1 |
診断、分類 |
藤巻高光(埼玉医科大学医学部 脳神経外科) |
福岡講平(埼玉県小児医療センター 血液腫瘍科)
高見浩数(東京大学 脳神経外科)
|
| 2 |
手術 |
荒川芳輝(京都大学大学院医学研究科 脳神経外科学) |
園田順彦(山形大学 脳神経外科)
櫻田 香(山形大学 脳神経外科)
峰晴陽平(京都大学大学院医学研究科 脳神経外科学)
|
| 3 |
初発中枢神経原発胚細胞腫に対する放射線治療 |
唐澤克之(都立駒込病院 放射線治療科) |
副島俊典(神戸陽子線センター 放射線治療科)
藤井元彰(三井記念病院 放射線治療科)
篠島直樹(熊本大学 脳神経外科)
|
| 4 |
初発中枢神経原発胚細胞腫に対する化学療法 |
寺島慶太(国立成育医療研究センター 小児がんセンター脳神経腫瘍科) |
原純一(大阪市立医療センター 小児血液腫瘍科)
山崎夏維(大阪市立総合医療センター 小児血液腫瘍科)
藤村純也(順天堂大学 小児科)
|
| 5 |
再発時の治療方針 |
柳澤隆昭(東京慈恵医科大学 脳神経外科) |
山崎文之(広島大学 脳神経外科)
高橋麻由(産業医科大学 脳神経外科)
|
| 6 |
長期予後 |
西川亮(埼玉医科大学国際医療センター 脳脊髄腫瘍科) |
鈴木智成(埼玉医科大学国際医療センター 脳脊髄腫瘍科)
佐藤伊織(東京大学医学部健康総合科学科大学院医学系研究科健康科学・看護学専攻 家族看護学分野)
|
|

|
| 2. 作成過程
|

|
| |
2.1. 作成方針
|

|
| |
|
中枢神経原発胚細胞腫瘍に対するエビデンスを整理し、診療アルゴリズムと診療ガイドラインを示すことによって、中枢神経原発胚細胞腫瘍患者の生命予後と機能予後の改善を目的とする。
|

|
| |
2.2. 使用上の注意
|

|
| |
|
共通目次と共通項目参照
|

|
| |
2.3. 利益相反
|

|
| |
|
共通目次と共通項目参照
|

|
| |
2.4. 作成資金
|

|
| |
|
共通目次と共通項目参照
|

|
| |
2.5. 組織編成
|

|
| |
|
ガイドライン統括委員会: 中枢神経原発胚細胞腫瘍に対するエビデンスを整理し、診療アルゴリズムと診療ガイドラインを示すことによって、中枢神経原発胚細胞腫瘍患者の生命予後と機能予後の改善を目的とする。
ガイドライン作成グループ:脳腫瘍診療拡大ガイドライン委員会から選出された13名にて構成されている。
システマティックレビューチーム:重要臨床課題ごとに作成グループがシステマティックレビュー(SR)チームのリーダーとなり、リーダーよりSR委員を選出してもらい、各課題3~4名で編成した。中枢神経原発胚細胞腫瘍が希少疾患であることを踏まえて、各チームひとりずつガイドライン委員が兼任することとした。
|

|
| |
2.6. 作成過程
|

|
| |
|
準備:2015年8月23日中枢神経原発胚細胞腫瘍ガイドラインWG第1回会議を開催し、ガイドライン作成グループが発足。課題をどのようにするか討議し各課題のリーダーを決定した。
スコープ:ドラフトを作成し、メール回覧のうえ、メール討議を行い、改変を繰り返して完成し、委員全体にメールで回覧し意見を募った。
システマティックレビュー:2016年1月に開始。Minds「診療ガイドライン作成マニュアル 2014」に準拠した方法により行なったが、中枢神経原発胚細胞腫瘍が希少疾患であるためエビデンスが少なく、Mindsに準拠した方法の適用が困難な場面に遭遇したが、論議しながら完成に向かった。
WG会議:WG内での会議を全体で6回行った。
第1回WG会議 2015年8月23日(東京)委員選出と役割分担について
第2回WG会議 2017年9月22日(東京)システマティックレビューに関してMinds(吉田雅博氏)より講義していただき、それぞれのレビューの進行確認
第3回WG会議 2018年1月27日(東京)各CQ、推奨、解説文に関する討議
第4回WG会議 2018年11月14日(京都)各CQ、推奨、解説文に関する討議
第5回WG会議 2019年9月14日(大阪)各CQにおける推奨グレードの決定
第6回WG会議 2019年9月15日(東京)各CQにおける推奨グレードの決定
推奨作成とその決定:重要臨床課題(CQ)ごとに担当委員が草案を作成し、メールで討議した。推奨グレードに関しては中枢神経原発胚細胞腫ガイドラインWGの委員及びSRチームの24人にて投票を行い、WG内における推奨グレードをまず決定し、最終的に2019年10月10日の脳腫瘍診療拡大ガイドライン委員会にて統括委員全員の投票により決定した。
その他、共通目次と共通項目にも追加記載あり
公開:2021年6月ホームページ上に公開した。共通目次と共通項目参照
|

|
| |
2.7. 推奨の強さの提示方法・エビデンスレベル・推奨度(臨床的意義)について
|

|
| |
|
共通目次と共通項目参照
|

|
| 3.公開後の取り組み
|

|
| |
|
共通目次と共通項目参照
|

|
| 4.脳腫瘍診療ガイドライン拡大委員会(ガイドライン統括委員会)構成委員
|

|
| |
|
共通目次と共通項目参照
|

|
| 5.日本脳腫瘍学会 脳腫瘍診療ガイドライン作成事務局
|

|
| |
|
共通目次と共通項目参照
|

|
| 目次へ戻る!
|

|
| (Ⅴ)スコープ
|

|
| 1.中枢神経原発胚細胞腫瘍の基本的特徴
|

|
| |
1)臨床的特徴
|

|
| |
|
始原生殖細胞に由来すると考えられている原発性脳腫瘍である。腫瘍起源としては、本来なら胎生第3週に出現し、後腸より背側腸間膜を経由して、4週末から5週始めに生殖堤に達し性腺原基を形成する始原生殖細胞が、何らかの遊走異常により脳に達し、異所性胚細胞として生き残り腫瘍化したと考える説が有力である1, 2)。しかし、一方ではヒトの胎生幹細胞(ES細胞)からでもgerm cellやembryoid bodyが形成されることから、脳自体のES細胞から発生した可能性もあると提唱する説もある3)。組織系の分類として、中枢神経系胚細胞腫瘍には5つの組織型が存在する。すなわち、①ジャーミノーマ、②奇形腫(成熟・未熟)、③卵黄嚢腫瘍、④絨毛癌、⑤胎児性癌である。更にこれらの組織を持つ腫瘍が単独ではなく各々の成分を混じる混合腫瘍として存在することもあり、非常に診断が困難な場合がある。画像診断もある程度有用であるが、確定診断は難しく、病理学的組織診断および、後述するが、血清および髄液の腫瘍マーカー[α-fetoprotein(AFP)、human chorionic gonadotropin(HCG)、β-subunit of human chorionic gonadotropin(β-HCG)]が確定診断に有用である。中枢神経原発胚細胞腫瘍の画像診断、病理診断所見、腫瘍マーカー、免疫組織学的染色についてまとめて表1に示す。分子生物学的解析においてはジャーミノーマにてc-Kitの高発現や遺伝子変異、KRASの遺伝子変異を含めたいくつかの遺伝子や染色体異常の報告がある4-6)。KIT/RASシグナル、AKT/mTORシグナルなどが腫瘍の生物学的特徴に関与していると言われているが、まだそれらの解明には至っていない。エピジェネティックな解析では他の胚細胞腫瘍に比べてジャーミノーマは極端にDNAのメチル化が低いということも報告されている7)。腫瘍自体が混合腫瘍(heterogeneous tumor)であることも稀ではないため、臨床的な分類において悪性腫瘍と良性腫瘍の線引きが難しい。欧米では純粋なジャーミノーマとそれ以外の胚細胞腫瘍(non-germinomatous germ cell tumor, NGGCT)の2群に分類されて論じられることが多いが、日本では臨床的予後を反映する分類として松谷らが提唱している予後良好(good prognosis)群、中間(intermediate prognosis)群、予後不良(poor prognosis)群の3型分類が用いられる場合もある8)。
|

|
| |
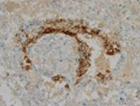
1 中枢神経原発胚細胞腫瘍の画像診断・病理所見と腫瘍マーカー
|
| |
|
| |
画像 HE染色 |
病理所見 |
腫瘍マーカー |
Immuno‐Histochemical
staining |
| ジャーミノーマ |
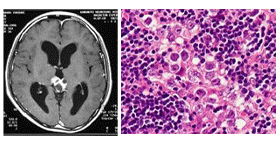 |
幼弱な胚細胞に類似、リンパ球浸潤 |
HCG(±) |
C-kit
 |
| 成熟奇形腫 |
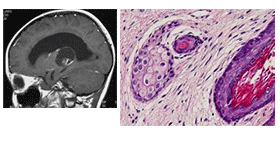 |
三胚葉成分からなる腫瘍、いずれも成熟した組織 |
- |
- |
| 未成熟奇形腫 |
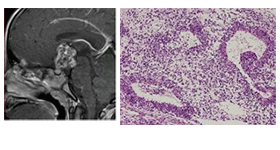 |
未熟な成分が混在、神経管構造の出現 |
HCG
AFP |
- |
| 胎児性癌 |
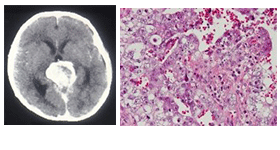 |
胎児期の未熟上皮を模倣、異型が強い |
- |
CD30
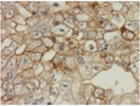 |
| 絨毛癌 |
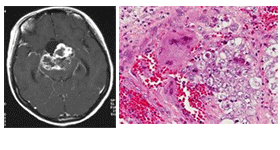 |
胎盤絨毛の栄養膜細胞へ分化、出血しやすい |
HCG |
HCG
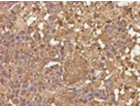 |
| 卵黄嚢腫 |
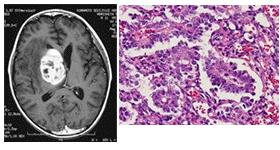 |
卵黄嚢への分化、網状構造、硝子滴、Schiler-Duval小体 |
AFP |
AFP
 |
|

|
| |
2)疫学的特徴
|

|
| |
|
中枢神経原発胚細胞腫瘍は欧米に比べて、日本を含めた東アジアに多いとされている9)。欧米に比べて3~8倍の発生率との報告があり、また北米における移民でもアジア系に発生率が高いことから、中枢神経原発胚細胞腫瘍の発生には遺伝学的要素の関与が示唆されている。日本における脳腫瘍全国集計においては、原発性脳腫瘍の2.7%、小児脳腫瘍の15.3%の頻度であり、特に10歳台に多い腫瘍で男性に多いとされている。組織型では中枢神経系胚細胞腫瘍のうち約70%がジャーミノーマであり、それ以外のそれぞれの腫瘍の頻度は10%以下である。発生部位は,80%以上が視床下部・下垂体後葉(neurohypophyseal germ cell tumors)と松果体(pineal germ cell tumors)に集中している。また、両部位に同時に発生する場合もある(bifocal tumor)。松果体部に発生するジャーミノーマはほとんどが男児であり、女児に発生するジャーミノーマは,視床下部・下垂体後葉に多いという特徴がある。頻度は低いが,大脳基底核,視床,脳幹部,脊髄,小脳にも原発することがある。5年生存率は組織型によって異なるが、ジャーミノーマにおいては95%を超えており、ほとんどの症例がQOLを保ちつつ長期生存可能である。NGGCTに関しても、かなり臨床的予後は改善しており、40~70%の症例において5年以上の無増悪生存期間を保つことができるようになってきている。初期治療後、ある期間をおいて再発することがあり、組織系によって異なるが、治療困難な症例もあり、治癒できない場合もある。
|

|
| |
3)診療の全体的な流れ
|

|
| |
|
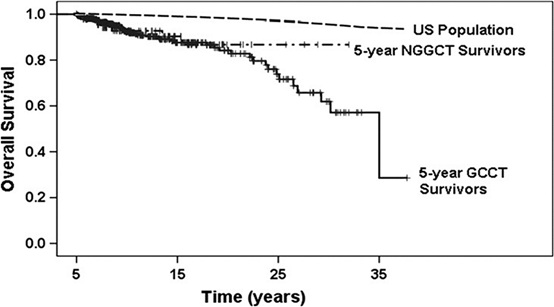
松果体部に発生した腫瘍では中脳水道閉塞による水頭症が原因で頭蓋内圧亢進症状を呈することや、中脳四丘体を圧迫もしくは浸潤することで上方注視麻痺を呈して発症することが多い。一方視床下部・神経下垂体近傍の腫瘍では視力視野障害やホルモン分泌障害に伴う症状を呈することにより発症する。特に尿崩症は80~90%の症例に認められる。下垂体前葉機能障害は成長停滞、無月経、肥満などの症状が多く、血清学的にホルモン値や電解質の異常が認められる。また、基底核部や視床にできた場合は、麻痺、感覚障害、精神症状などが認められる。これらの症状により頭部MRIなどの画像を撮影され、胚細胞腫瘍が疑われた場合は、診断を確定し治療が必要となる。診断においてはまず胚細胞腫瘍に特徴的な血清もしくは髄液腫瘍マーカー(AFP、HCG、β-HCG)の測定を行う。純粋なジャーミノーマや奇形腫の場合は腫瘍マーカーが上昇しないので、その場合は外科的に組織を採取し診断を確定する必要がある。外科的摘出により合併症が出現する可能性が高い場合は必ずしも組織確認の必要はないとの意見もある。外科的な組織生検術としては開頭にて行う場合もあるが、内視鏡を用いて行っても問題はないと考えられている。特に水頭症を合併している症例に関しては、水頭症治療と同時に内視鏡的に行われることが主流になりつつある。中枢神経原発胚細胞腫瘍の外科的介入の方法とタイミングに関しては、①腫瘍マーカーが上昇しているかどうか、②水頭症を合併しているかどうか、③腫瘍がどこに発生しているか、④化学療法、放射線療法の反応性が良いか、などの病態によって異なることが多く、複雑である。中枢神経原発胚細胞腫瘍における治療において、化学療法と放射線療法は非常に重要である。3歳未満は放射線療法を控えるが、3歳以上であれば放射線療法を行うことが多い。腫瘍の診断によって放射線療法の方法は様々であり、腫瘍の組織の悪性度が高いほど放射線の照射範囲や量が増える傾向である。化学療法はシスプラチン、カルボプラチンなどの白金製剤を中心のレジメンが考慮され、その他の抗腫瘍剤を組み合わせて行う。中枢神経原発胚細胞腫瘍の治療において、化学療法を積極的に取り入れることは、放射線の照射量を減量でき、治療成績を下げることなく放射線療法の晩発的な有害事象を減じる効果に有用であると考えられている。中枢神経原発胚細胞腫瘍において再発した場合の治療は大変困難である。ジャーミノーマに関しては、再発率は低いものの、一端再発すると治療は困難な場合がある。NGGCTに関してはジャーミノーマよりさらに再発における治癒率は低い。10年以上経過して再発する症例もあり、長期的なフォローアップが必要な疾患である。後述の課題6の長期予後において詳細に述べるが、ジャーミノーマ(図1ではGCCTと記載されている)における治療による長期的なフォローにて観察された合併症も報告されており、Kaplan-Meier生存曲線は、人口統計に比べて遙かに速いペースで、30年以上ほぼコンスタントに下がり続けている10)(図1)。つまり、中枢神経原発胚細胞腫のフォローアップは永久的に必要と考えられる。
|

|
|

|
| |
|
| |
参考文献
|
| |
|
| 1) |
Sano K, Matsutani M, Seto T. So-called intracranial germ cell tumours: personal experiences and a theory of their pathogenesis. Neurol Res. 1989;11(2):118-26.
[PMID: 2569683] |
| 2) |
Sano K. Intracranial dysembryogenetic tumors: pathogenesis and their order of malignancy. Neurosurg Rev. 2001 ;24(4):162-7; discussion 168-70.
[PMID: 11778821] |
| 3) |
Scotting PJ. Are cranial germ cell tumors really tumors of germ cells? Neuropathol Appl Neurobiol. 2006 ;32(6):569-74.
[PMID: 17083471] |
| 4) |
Wang L, Yamaguchi S, Burstein MD, et al. Novel somatic and germline mutations in intracranial germ cell tumours. Nature. 2014 ;511(7508):241-5.
[PMID: 24896186] |
| 5) |
Terashima K, Yu A, Chow WY, et al. Genome-wide analysis of DNA copy number alterations and loss of heterozygosity in intracranial germ cell tumors. Pediatr Blood Cancer. 2014;61(4):593-600.
[PMID: 24249158] |
| 6) |
Ichimura K, Fukushima S, Totoki Y, et al; Intracranial Germ Cell Tumor Genome Analysis Consortium. Recurrent neomorphic mutations of MTOR in central nervous system and testicular germ cell tumors may be targeted for therapy. Acta Neuropathol. 2016 ;131(6):889-901.
[PMID: 26956871] |
| 7) |
Fukushima S, Yamashita S, Kobayashi H, et al; Intracranial Germ Cell Tumor Genome Analysis Consortium (The iGCTConsortium). Genome-wide methylation profiles in primary intracranial germ cell tumors indicate a primordial germ cell origin for germinomas. Acta Neuropathol. 2017 ;133(3):445-62.
[PMID: 28078450] |
| 8) |
Matsutani M, Sano K, Takakura K, et al. Primary intracranial germ cell tumors: a clinical analysis of 153 histologically verified cases. J Neurosurg. 1997 ;86(3):446-55.
[PMID: 9046301] |
| 9) |
Makino K, Nakamura H, Yano S, et al; Kumamoto Brain Tumor Research Group. Incidence of primary central nervous system germ cell tumors in childhood: a regional survey in Kumamoto prefecture in southern Japan. Pediatr Neurosurg. 2013;49(3):155-8.
[PMID: 24751890] |
| 10) |
Acharya S, DeWees T, Shinohara ET, et al. Long-term outcomes and late effects for childhood and young adulthood intracranial germinomas. Neuro Oncol. 2015;17(5):741-6.
[PMID: 25422317] |
|
|

|
| 目次へ戻る!
|

|
| 2.中枢神経原発胚細胞腫瘍のスコープ作成
|

|
| |
1)診療ガイドラインがカバーする内容に関する事項
|

|
| |
| (1) |
タイトル:中枢神経原発胚細胞腫瘍の診療ガイドライン |
| (2) |
目的:生命予後、機能予後、QOLの改善 |
| (3) |
トピック:診断、生命予後、機能予後、QOLの改善 |
| (4) |
想定される利用者、利用施設:脳腫瘍を診療する医療者や施設、患者・家族 |
| (5) |
既存ガイドラインとの関係:日本では既存のガイドラインは作成されていない |
| (6) |
最重要課題
課題1:診断、分類
課題2:手術
課題3:ジャーミノーマに対する化学放射線療法
課題4:NGGCTに対する化学放射線療法
課題5:再発時の治療
課題6:長期予後
|
| (7) |
ガイドラインがカバーする範囲
脊髄に発生した胚細胞腫瘍も含む。
成人の胚細胞腫瘍も含む。
中枢神経系以外に発生した胚細胞腫瘍は含まない
|
| (8) |
CQリスト
|
| |
| 課題1:診断、分類 |
| |
CQ1 |
中枢神経原発胚細胞腫瘍における腫瘍マーカー(AFP、HCG、β-HCG)の測定は有用か。
|
| |
CQ2 |
中枢神経原発胚細胞腫瘍における病理組織診断は必要か。
|
| 課題2:手術 |
| |
CQ3 |
ジャーミノーマに対して積極的な摘出手術は必要か。
|
| |
CQ4 |
NGGCTに対して摘出手術は必要か。
|
| |
CQ5 |
中枢神経原発胚細胞腫瘍に合併した水頭症に対して手術は必要か。
|
| 課題3:ジャーミノーマに対する化学放射線療法 |
| |
CQ6 |
ジャーミノーマに対して化学放射線療法は必要か。
|
| 課題4:NGGCTに対する化学放射線療法 |
| |
CQ7 |
NGGCTに対して化学放射線療法は有用か。
|
| 課題5:再発時の治療方針 |
| |
CQ8 |
再発ジャーミノーマに対して救済治療は有用か。
|
| |
CQ9 |
再発 NGGCT に対して救済治療は有用か。
|
| 課題6:長期予後 |
| |
CQ10 |
中枢神経原発胚細胞腫瘍おけるフォローアップは必要か。
|
|
|

|
| |
2)システマティックレビューに関する事項
|

|
| |
| (1) |
実施スケジュール 文献検索:2カ月
文献の選出:2カ月
エビデンス総体の評価と統合:2カ月
|
| (2) |
エビデンスの検索
|
| |
① |
エビデンスタイプ
|
| |
|
・ |
既存のガイドライン:2003年より中枢神経原発胚細胞腫の国際カンファレンス(International CNS germ cell tumor symposium)が2017年までに5回開催されている[第1回京都(2003年)、第2回ロサンジェルス(2005年)、第3回ケンブリッジ(2013年)、第4回東京(2015年)、第5回コロンバス(2017年)]。その討論の結果合意の得られた内容に関して、論文化されている。
|
| |
|
・ |
個別研究論文:ランダム化比較試験の報告は、海外からいくつか報告されている。その他、非ランダム化比較試験、観察研究を検索対象にする。症例報告に関しては一部を除いて省略する。
|
| |
② |
データベース
|
| |
|
・ |
個別研究論文: 主にPubMed
|
| |
|
・ |
SR/MA論文について: Cochraneになし
|
| |
|
・ |
既存のガイドラインの検索: 不要
|
| |
③ |
検索方法
|
| |
|
・ |
介入の検索に関してはPICOフォーマットを用いる。
|
| |
④ |
検索対象期間
|
| |
|
・ |
すべてのデータベースで2015年11月まで
|
| (3) |
文献の選択基準,除外項目
採択条件を満たす観察研究がない場合,システマティックレビューは実施しない。
|
| (4) |
エビデンスの評価と統合の方法
エビデンス総体の強さの評価は「Minds作成手引き2014」の方法に基づく。
エビデンス総体の統合は質的な統合を基本とし,適切な場合が量的統合を実施。
|
|

|
| 目次へ戻る!
|

|
| (Ⅵ)推奨
|

|
| 課題1:診断、分類
|

|
| |
CQ1 中枢神経原発胚細胞腫における腫瘍マーカー(AFP、HCG)の測定は有用か。
|

|
| |
推奨
中枢神経原発胚細胞腫瘍では、腫瘍マーカー(AFP、HCG)を測定することを推奨する。(推奨度1A)
|
|

|
| |
解説
|

|
| |
|
中枢神経原発胚細胞腫瘍を疑う症例では、血液と可能な場合は同時に髄液中の腫瘍マーカー(AFP、HCG)を測定することが推奨される。
中枢神経原発胚細胞腫瘍の診断において、典型的な画像所見と臨床所見を呈した場合、まず行う検査が、腫瘍マーカーの測定である。中枢神経原発胚細胞腫瘍の典型的な画像所見とは、神経下垂体、松果体またはその両者における造影効果を伴う病変の存在であり、CT画像における石灰化病変は奇形腫の存在を疑わせる所見である。また典型的な臨床所見としては、神経下垂体に発生した場合は尿崩症を含めた内分泌異常による症状や視力・視野障害が、松果体に発生した場合は閉塞性水頭症の他にParinaud徴候やArgyll-Robertson瞳孔が見られやすいことが挙げられる1)。
ただし、ランゲルハンス細胞組織球症などでもHCGの上昇を認めることがあり、特に軽度上昇例においては注意が必要である2)。そのため、顕著な上昇例以外は組織採取による病理診断が推奨される(⇒CQ2を参照)。HCGの上昇例はジャーミノーマが考慮され、それが高値を示す症例は絨毛癌が疑われる。AFPの上昇は特に卵黄嚢腫瘍で見られる。未熟奇形腫や胎児性癌ではHCGとAFPの上昇を示すことがある3)。しかし、組織診断が不要となるような、HCGとAFPの顕著な上昇、あるいは著しい高値が、具体的にいくつ以上を示すのかについては定説がない。
中枢神経原発胚細胞腫瘍を他の腫瘍と鑑別するため、またnon-germinomatous germ cell tumor (NGGCT)をジャーミノーマから鑑別するための腫瘍マーカーの適切な基準値については多くの報告があるが、これも現状では国や施設によって異なり、国際的に共通した基準値のコンセンサスは得られていない。しかし、化学療法、放射線療法に対する腫瘍の反応性の指標として腫瘍マーカーの推移が有用とする報告は認められている4-7)。ジャーミノーマとNGGCTを鑑別する世界的に代表的な腫瘍マーカーの基準を表1に示す。一方、MatsutaniらはNGGCTの中の高度悪性群に関しては腫瘍マーカーの組織診断なしに診断してよい基準値を一部設けているものの、ジャーミノーマとの鑑別に関しての明確な腫瘍マーカーの基準値は設けていない1)。表1のMatsutaniらの分類では、欧米では病理学的にNGGCTに分類される成熟奇形腫は、臨床的予後を考慮して、ジャーミノーマとともに予後良好群として分類されている。
|
| |
|
表1 中枢神経原発胚細胞腫の腫瘍マーカー基準値
|
| |
|
| |
SIOP
(Calaminus)
文献(8) |
COG
(Goldman)
文献(9) |
Japan
(Matsutani)
文献(1) |
Korea
(KSPNO-S053)
文献(11) |
Taiwan
(Tai-Tong Wong)
文献(12) |
| germinoma |
病理学的に確認
かつ
AFP≦25ng/ml
HCG≦50IU/L |
病理学的に確認
かつ
AFP≦10IU/L
β-HCG≦50IU/L |
HCG(あるいはβHCG)産生腫にかかわらず
ジャーミノーマ germinoma細胞のみにて構成される腫瘍
(ただしSTGCはふくまれてもよい) |
病理学的に確認
かつ
AFP≦10ng/ml
β-HCG≦50mIU/ml |
病理学的に確認
かつ
AFP≦5ng/dl
β-HCG≦100mIU/ml |
| NGGCT |
病理学的に
CHC、YCT、ECを
確認
もしくは
AFP>25ng/ml
HCG>50IU/L |
病理学的に
CHC、YCT、ECを
確認
もしくは
AFP>10IU/L
β-HCG>50IU/L |
中等度悪性群
a)未熟奇形腫 b)悪性転化を伴う奇形腫
c)混合腫瘍 mixed tumorの内、
germinoma + teratoma および
germinoma あるいは teratomaが主体で
少量の高度悪性群要素を含むもの |
病理学的に
CHC、YCT、ECを
確認
もしくは
AFP>10ng/ml
β-HCG>50mIU/ml |
病理学的に
CHC、YCT、ECを
確認
もしくは
AFP>5ng/dl
β-HCG>100mIU/ml |
高度度悪性群
a)純毛上皮腫 b)卵黄嚢腫瘍 c)胎児性癌
d)混合腫瘍 mixed tumorの内、上記3腫瘍
要素が主体のもの
e)病理学的診断は得ていないが、治療前の
血清HCG値 2,000mIU/ml以上、あるいは
血清AFP値が2,000ng/ml以上の症例 |
|

|
| |
|
中枢神経原発胚細胞腫瘍における腫瘍マーカーの値と予後との関連については、NGGCTにおいてHCGの値による予後の差が有意であるとする報告はないが、AFPの値が高い症例は予後が悪いとされ8,9)、特に1000 ng/mlを超える症例は有意に予後不良であると報告されている8)。一方で欧米のNGGCTの基準では、HCG産生を伴うジャーミノーマも含まれており、HCG産生を伴うNGGCTの臨床的予後が実際のNGGCTの予後を反映していない可能性があり、解釈に注意を要する。
HCGの測定法は国際的に必ずしも統一されておらず注意を要する。HCGは2つのサブユニット(α、β)で構成されホルモンとして機能するが、αサブユニットのアミノ酸配列がLH(黄体化ホルモン)、FSH(卵胞刺激ホルモン)、TSH(甲状腺刺激ホルモン)と共通の構造をしており免疫学的に交差するため、HCGの測定にはβサブユニットを認識する抗体を用いて測定する。一般に妊娠などの正常な状態ではα、βサブユニット双方からなるインタクトHCGのみが産生されるが、胚細胞腫瘍など腫瘍性疾患ではβサブユニットだけのHCGなど様々な非機能的なHCGが産生される。測定システム(会社)によって測定しているものが異なり、測定しているものが、α、βサブユニットからなるインタクトHCGなのか、遊離したβ-HCGのみを測定しているのか、あるいはインタクトHCGとβ-HCG(遊離を含む)をすべて測定(トータルHCG)しているのかを意識して測定値を見る必要がある。正常な状態ではインタクトHCGとトータルHCGはほとんど同じ値であるが、腫瘍性疾患では乖離がみられうる。一般的にインタクトHCGはECLIA法を用いて測定され、単位はIU/LまたはmIU/mLである(論文においてはI(international)を省略してU/LやmU/mlとしているものもある)。一方遊離型のβ-HCGのみを測定する場合はRIA法で測定され、単位はng/mLである。またトータルHCGはCLEIA法で測定され、単位はIU/LまたはmIU/mLである。胚細胞腫瘍の臨床において、どの測定法が高い特異度であるかについて報告はないが、精巣の胚細胞腫瘍において、トータルHCGを測定する方が、治療効果、再発に関してより特異的であったと報告がある10)。
|

|
| |
|
| |
参考文献
|
| |
|
| 1) |
Matsutani M, Sano K, Takakura K, et al. Primary intracranial germ cell tumors: a clinical analysis of 153 histologically verified cases. J Neurosurg. 1997;86(3):446-55.
[PMID: 9046301] |
| 2) |
Kinoshita Y, Yamasaki F, Usui S, et al. Solitary Langerhans cell histiocytosis located in the neurohypophysis with a positive titer HCG-beta in the cerebrospinal fluid. Childs Nerv Syst. 2016;32(5):901-4.
[PMID: 26527477] |
| 3) |
Kim A, Ji L, Balmaceda C, et al. The prognostic value of tumor markers in newly diagnosed patients with primary central nervous system germ cell tumors. Pediatr Blood Cancer. 2008;51(6):768-73.
[PMID: 18802946] |
| 4) |
Kawaguchi T, Kumabe T, Kanamori M, et al. Logarithmic decrease of serum alpha-fetoprotein or human chorionic gonadotropin in response to chemotherapy can distinguish a subgroup with better prognosis among highly malignant intracranial non-germinomatous germ cell tumors. J Neurooncol. 2011;104(3):779-87.
[PMID: 21359564] |
| 5) |
Fujimaki T, Mishima K, Asai A, et al. Levels of beta-human chorionic gonadotropin in cerebrospinal fluid of patients with malignant germ cell tumor can be used to detect early recurrence and monitor the response to treatment. Jpn J Clin Oncol. 2000;30(7):291-4.
[PMID: 11007160] |
| 6) |
Seregni E, Massimino M, Nerini Molteni S, et al. Serum and cerebrospinal fluid human chorionic gonadotropin (hCG) and alpha-fetoprotein (AFP) in intracranial germ cell tumors. Int J Biol Markers. 2002;17(2):112-8.
[PMID: 12113577] |
| 7) |
Picozzi VJ, Jr., Freiha FS, Hannigan JF Jr., et al. Prognostic significance of a decline in serum human chorionic gonadotropin levels after initial chemotherapy for advanced germ-cell carcinoma. Ann Intern Med. 1984;100(2):183-6.
[PMID: 6318631] |
| 8) |
Calaminus G, Frappaz D, Kortmann RD, et al. Outcome of patients with intracranial non-germinomatous germ cell tumors-lessons from the SIOP-CNS-GCT-96 trial. Neuro Oncol. 2017;19(12):1661-72.
[PMID: 29048505] |
| 9) |
Goldman S, Bouffet E, Fisher PG, et al. Phase II Trial Assessing the Ability of Neoadjuvant Chemotherapy With or Without Second-Look Surgery to Eliminate Measurable Disease for Nongerminomatous Germ Cell Tumors: A Children's Oncology Group Study. J Clin Oncol. 2015;33(22):2464-71.
[PMID: 26101244] |
| 10) |
滝沢昭利,三浦 猛,藤浪 清ほか.精巣腫瘍におけるhCGとβHCGの意義.臨床泌尿器.2005:59(6);405-9. |
| 11) |
11) Baek HJ1, Park HJ, Sung KW, et al. Myeloablative chemotherapy and autologous stem cell transplantation in patients with relapsed or progressed central nervous system germ cell tumors: results of Korean Society of Pediatric Neuro-Oncology (KSPNO) S-053 study. J Neurooncol. 2013;114(3):329-3.
[PMID: 23824533] |
| 12) |
Wu CC, Guo WY, Chang FC, et al. MRI features of pediatric intracranial germ cell tumor subtypes. J Neurooncol. 2017 ;134(1):221-30.
[PMID: 28551848] |
|
|

|
| 目次へ戻る!
|

|
| |
CQ2 中枢神経原発胚細胞腫瘍における病理組織診断は必要か。
|

|
| |
推奨
中枢神経原発胚細胞腫瘍を疑う症例において、診断確定のためには病理組織による診断を提案する。(推奨度2C)
|
|

|
| |
解説
|

|
| |
|
中枢神経原発胚細胞腫瘍の診断において、MRI画像診断や腫瘍マーカーもその一助になりうるが、前述のようにHCGの上昇はランゲルハンス細胞組織球症など他の疾患でも認められ得るため、生検によってのみ確定診断が得られる症例は少なからず存在する。Wuらは、85例の頭蓋内原発胚細胞腫瘍において様々なMRI撮像法においてジャーミノーマとNGGCTの鑑別ができないかを後方視的コホート研究として検討しており、T1高信号の部分があること、造影パターン、ADC値を組み合わせることによってジャーミノーマとNGGCTの鑑別がある程度可能であると報告している1)。しかし、彼らの登録症例においても術前総合的に中枢神経原発胚細胞腫瘍と診断していたが、病理組織診断すると全く胚細胞腫ではなかった症例が1例存在したと報告している。Aizerらは、1998~2012年までに治療した頭蓋内原発胚細胞腫瘍71例について検討し、14例がbifocal tumorであり、うち10例で組織診断を行い、7例がジャーミノーマ、3例はNGGCTであり、NGGCTの3例はいずれもβ-HCGが正常値で、AFPは正常か軽度上昇であったことを報告している2)。CalaminusらはSIOP-CNS-GCT-96 trialにおいて1996~2005年まで149例のNGGCTの治療成績を検討している。彼女らのNGGCTの診断基準は病理学的にNGGCTが証明されるか、HCG>50IU/LもしくはAFP>25ng/mlであるという条件を満たすかであるが、全例腫瘍マーカーの検査を行っており、10例(7%)の症例においてNGGCTと病理学的に診断されたにも関わらず、いずれの腫瘍マーカーの上昇も認められなかったと報告している。成熟奇形腫であれば、腫瘍マーカーの上昇が認められなくてもよいが、これらの10例には奇形腫は含まれていない。病理学的に奇形腫は5例確認されており、すべての症例においてAFPの上昇が認められている3)。このように、腫瘍マーカーや画像・臨床所見からは中枢神経原発胚細胞腫瘍が疑われる場合でも、例外(胚細胞腫瘍ではない腫瘍や、腫瘍マーカーが上昇してない成熟奇形腫以外のNGGCTなど)は存在するので手術による組織診断が推奨される。特に、非典型的な臨床経過や画像所見を有する場合は、病理組織診断を行うべきである。一方でNGGCTに対しては、ジャーミノーマと同様に手術による組織診断を奨めるという意見と必ずしも必要ないという意見がある。Nakamuraらは14例のNGGCTを生検による病理診断ではなく、腫瘍マーカーの上昇にて診断し、化学放射線治療を先行させ、腫瘍マーカーが陰性になった時点で3例は腫瘍が完全に消失したが、11例は腫瘍が残存したために、それらの摘出を試みている。彼らの14例のNGGCTにおける5年無病生存割合、5年生存割合はそれぞれ86%と93%であった4)。彼らは最初に病理組織診断をしないメリットについては、播種再発を減少させる可能性を述べている。TakahashiらもNGGCTを同じようなneo-adjuvant therapyのプロトコールにて治療することにより、彼らの施設における過去に実施された治療成績より優れた治療成績が得られたと報告している5)。前述のCQ1の解説文でも取り上げている欧州でのSIOP-96という臨床試験の大規模なNGGCTの報告においても、149例中73例は病理診断が行われずに腫瘍マーカーにてNGGCTと診断している。これらの報告がジャーミノーマでは比較的病理診断を強く推奨するのに対し、NGGCTでは必須ではないとせざるを得ない理由である。しかし、これらの報告における懸念として、腫瘍マーカーだけによる診断はジャーミノーマの混在やNGGCTの脱落があり、正確なNGGCTの予後を反映していない可能性はある。つまり、HCG高値の、しかし組織学的には ジャーミノーマ だった場合には過剰治療、腫瘍マーカーが陰性の未熟奇形腫や胎児性癌(あるいはそれらを含む混合性腫瘍)の場合は 過少治療になる可能性があるということである。それ故、β-HCGや AFPが著しく高値(CQ1参照)を示した場合は組織診断を行わずに化学放射線療法を考慮してもよいということでは意見は一致しているが、NGGCTにおいても腫瘍マーカーだけでの診断が困難な場合は病理組織による診断が必要という意見もあり、現時点では結論づけることができない。
|

|
| |
|
| |
参考文献
|
| |
|
| 1) |
Wu CC, Guo WY, Chang FC, et al. MRI features of pediatric intracranial germ cell tumor subtypes. J Neurooncol. 2017;134(1):221-30.
[PMID: 28551848] |
| 2) |
Aizer AA, Sethi RV, Hedley-Whyte ET, et al. Bifocal intracranial tumors of nongerminomatous germ cell etiology: diagnostic and therapeutic implications. Neuro Oncol. 2013;15(7):955-60.
[PMID: 23640532] |
| 3) |
3Calaminus G, Frappaz D, Kortmann RD, et al. Outcome of patients with intracranial non-germinomatous germ cell tumors-lessons from the SIOP-CNS-GCT-96 trial. Neuro Oncol. 2017;19(12):1661-72.
[PMID: 29048505] |
| 4) |
Nakamura H, Makino K, Kochi M, et al. Evaluation of neoadjuvant therapy in patients with nongerminomatous malignant germ cell tumors. J Neurosurg Pediatr. 2011;7(4):431-8.
[PMID: 21456918] |
| 5) |
Takahashi S, Yoshida K, Kawase T. Intracranial Germ Cell Tumors: Efficacy of Neoadjuvant Chemo-radiotherapy without Surgical Biopsy. Keio J Med. 2011;60(2): 56-64.
[PMID: 21720201] |
|
|

|
| |
|
<課題1のシステマティックレビュー結果>
|
| |
|
| # |
検索式 |
文献数 |
| #1 |
germinoma AND classification |
492
|
| #2 |
germ cell tumor AND embryonal AND central nervous system |
872
|
| #3 |
neoplasms AND germ cell AND classification |
1,116
|
| #4 |
#3 AND central nervous system |
112
|
| #5 |
germ cell tumor AND tumor marker |
26,120
|
| #6 |
#5 AND central nervous system |
2,153
|
| #7 |
#6 AND diagnosis |
1,666
|
|
| |
|
|
以上の検索式より、以上>の一次スクリーニングとして141の文献を抽出し、45の文献の構造化抄録を作成した。それらのエビデンス総体をもとに、推奨と解説文を作成したが、その後にもいくつかの文献を加える必要があり、随時訂正し、最終的に、CQ1では12文献、CQ2では5文献を最終的に抽出するに至った。
|
|

|
| 目次へ戻る!
|

|
| 課題2:手術
|

|
| |
CQ3 ジャーミノーマに対して積極的な摘出手術は必要か。
|

|
| |
推奨
ジャーミノーマに対して積極的な摘出をしないことを推奨する。(推奨度1B)
|
|

|
| |
解説
|

|
| |
|
Aizerらは、1998~2012年までに治療した頭蓋内原発胚細胞腫瘍71例について検討し、14例がbifocal tumorであり、うち10例で組織診断を行い、7例がジャーミノーマ、3例はNGGCTであり、NGGCTの3例はいずれもβ-HCGが正常値で、AFPは正常か軽度上昇であったことを報告した1)。即ちbifocal tumorであったとしてもジャーミノーマであるとは断定できない。また、Delphi committeeでは、2回の投票とrevisionを経て、38のconsensus statements draftのうち34のstatementに合意が得られた。手術に関しては、statement 17において腫瘍マーカーの上昇がない場合は生検による組織診断が必要であるとされた2)。これは世界各国の主要な臨床家による投票であり、必ずしも文献的な高いエビデンスを要求していないが、識者によるコンセンサスといえるものである。以上よりbifocal tumor でジャーミノーマが強く疑われても、また腫瘍マーカーが全て陰性であっても、生検は推奨される。
Linstadtらは、生検で組織診断したジャーミノーマ13例、未生検の鞍上部・松果体病変20例に対する放射線療法の成績を報告した3)。放射線療法は腫瘍に対して40~55Gy照射している。生検によるジャーミノーマ診断例は観察期間中央値5.3年で再発例は認めず、5年生存率100%であったが、未生検例では、20例中3例(15%)が再発後死亡しており、再発後の病理組織は確認されていない。未生検では再発率が高いことより、ジャーミノーマ以外の腫瘍型が混入することが示唆される。つまり、古典的な診断的照射は不適切であり、組織診断が必要であると考えられるようになった。一方、Sawamuraらは、29例のジャーミノーマに対して、16例で生検、5例で部分摘出、8例で全摘出を行った結果を報告している4)。術後全例で放射線療法を行い、化学療法はそれぞれ16例、4例、4例で行った。その結果、約40ヶ月のフォロー期間中に再発したものは、全摘出した症例1例のみであり、摘出度による差は認められなかった。ジャーミノーマは化学放射線療法が奏効することから(放射線療法の項目で詳述)、組織診断のための生検術に留めても予後は劣らないと考えられ、多少ともリスクのある積極的な摘出は推奨できない。生検術の術式は、腫瘍部位によって、開頭術、経蝶形骨洞手術,定位脳手術、内視鏡手術などから選択する。
Lutherらは、腫瘍マーカー陰性で組織学的にもジャーミノーマと診断した6例中、1例は放射線療法にてCR後10カ月で再発を認め、初発時11U/Lであった髄液β-HCGが再発時57.4U/Lと上昇を認めたと報告した5)。彼らは再発後の病理組織は確認していないが、腫瘍マーカーの上昇を考慮し、ジャーミノーマ以外の腫瘍の混在を示唆している。また、Kinoshitaらは、21例の内視鏡的診断を行った症例の初回診断において16例のジャーミノーマという病理学的診断を得ているが、そのうち1例(診断時HCG陰性、AFP 33.2μg/l)において、化学放射線療法にて完全に腫瘍の縮小が得られないという理由で残存腫瘍を摘出した。2回目の病理組織診断でimmature teratomaの診断を得ており、内視鏡的生検術のpitfallとして報告している6)。これらの報告から、小さな組織で診断する生検術の限界には留意する必要がある。
|

|
| |
|
| |
参考文献
|
| |
|
| 1) |
Aizer AA, Sethi RV, Hedley-Whyte ET, et al. Bifocal intracranial tumors of nongerminomatous germ cell etiology: diagnostic and therapeutic implications. Neuro Oncol. 2013;15(7):955-60.
[PMID: 23640532] |
| 2) |
Murray MJ, Bartels U, Nishikawa R, et al. Consensus on the management of intracranial germ-cell tumours. Lancet Oncol. 2015;16(9):e470-7.
[PMID: 26370356] |
| 3) |
Linstadt D, Wara WM, Edwards MS, et al. Radiotherapy of primary intracranial germinomas: the case against routine craniospinal irradiation. Int J Radiat Oncol Biol Phys. 1988;15(2):291-7.
[PMID: 3403312] |
| 4) |
Sawamura Y, de Tribolet N, Ishii N, et al. Management of primary intracranial germinomas: diagnostic surgery or radical resection? J Neurosurg. 1997;87(2):262-6.
[PMID: 3403312] |
| 5) |
Luther N, Edgar MA, Dunkel IJ, et al. Correlation of endoscopic biopsy with tumor marker status in primary intracranial germ cell tumors. J Neurooncol. 2006;79(1):45-50.
[PMID: 16598424] |
| 6) |
Kinoshita Y, Yamasaki F, Tominaga A, et al. Pitfalls of Neuroendoscopic Biopsy of Intraventricular Germ Cell Tumors. World Neurosurg. 2017;106:430-4.
[PMID: 28711530] |
|
|

|
| 目次へ戻る!
|

|
| |
CQ4 NGGCTに対して摘出手術は必要か。
|

|
| |
| 推奨
|
| 1. |
成熟奇形腫に対して摘出術を推奨する。(推奨度1B) |
| 2. |
成熟奇形腫以外のNGGCTについては、化学放射線療法を行った後に、残存する腫瘍に対する摘出術を推奨する。(推奨度1C) |
|

|
| |
解説
|

|
| |
|
Zygourakisらの報告では、奇形腫11例で手術を行い、8例で全摘出を得、7例が混合胚細胞腫瘍で、うち1例のみで再発を認めた1)。Noudelらは奇形腫14例について報告し、14例中10例は初期治療として摘出術を行い、残りの3例は化学療法後に摘出を行った。成熟奇形腫8例において平均9年の経過観察で87.5%の生存率を得た2)。Matsutaniらは16例の成熟奇形腫で手術を行い、10年生存率が78.3%であった3)。Kageyamaらは成熟奇形腫5例に対して全摘出を行い、全例が社会復帰したと報告している4)。Delphi committeeにおいて、成熟奇形腫、悪性転化のない未熟奇形腫に対しては全摘出を選択するとされた5)。以上のように、成熟奇形腫は摘出により良好な予後が得られることから、摘出術が奨められる。
Nakamuraらは、AFP level(>100 ng/mL)、もしくはHCGまたはβ-HCG(>100 mIU/mL)を呈した14例の連続NGGCTに対して組織診断を行わずに術前化学放射線療法を行った。11例で残存腫瘍を認め手術を行った。摘出腫瘍の組織学的診断は成熟奇形腫3例、線維性組織3例、壊死組織2例で、その他の3例においては奇形腫あるいは中胚葉性の腫瘍組織が認められた。5年無増悪生存率が86%、5年生存率が93%であり、腫瘍マーカーによる診断治療介入とsecond-look surgeryの有用性を示した5)。Goldmanらの102人のNGGCT患者(腫瘍マーカーによる診断、3~24歳、中央値12歳)を対象とした前向き試験では規定の化学療法先行後PDでない症例に対し、CRであれば放射線療法を、CRでなければsecond-look surgery後に放射線療法 ないしsecond-look surgery後に大量化学療法を行って、さらに引き続き放射線療法を行った。結果は5年無増悪生存率84%、5年生存率93%であったが、この臨床試験のサブ解析にて診断時播種のなかった症例においてsecond-look surgeryを行った症例の5年無増悪生存率92%、5年生存率98%と極めて良い結果であった9)。初回治療後にsecond-look surgeryを行った症例は15例であったが、摘出組織は腫瘍が2例(胎児性癌1例、混合性胚細胞腫瘍1例)、奇形腫9例(成熟奇形腫6例、悪性奇形腫3例)、そして繊維組織が主体で腫瘍細胞を認めないものが4例であった。腫瘍再発時にsecond-look surgeryを行った症例は5例で、その組織は全て奇形腫であった。
Delphi committeeにおいても、画像診断と腫瘍マーカーの上昇により胚細胞腫瘍と診断される場合には生検術は必須ではないとされた6)。NGGCTに対しては、β-HCGやAFPが高値を示す場合は組織診断のための手術を行わずに化学放射線療法を考慮してもよい。しかしどの程度の値であれば組織診断のための手術を実施しなくてよいのか、については国際的なコンセンサスは存在しない(CQ1解説参照)。
Kimらは、NGGCT 52例のうち21%にgrowing teratoma syndromeを認めたことを報告しており、化学療法から診断までの期間が平均12.8カ月で、9例で全摘出が行われて再発は1例であった7)。Ogiwaraらは、胚細胞腫瘍23例中7例(30%)で再増大後に手術を行い、病理診断は成熟奇形腫5例、異型細胞を伴う繊維形成が1例、繊維形成のみが1例であり、全例で全摘出を行って再発なく経過したことを報告した8)。
以上のように、NGGCTでは、化学放射線療法中あるいは後に腫瘍が増大することを認識し、化学あるいは放射線療法後に残存腫瘍が存在する場合に手術を考慮する必要がある。化学放射線療法中あるいは後の摘出組織は、上述のように成熟奇形腫であることが多いと報告されているが、治療後修飾された組織での診断であり、初発時の組織が成熟奇形腫であったことを意味するわけでない。
|

|
| |
|
| |
参考文献
|
| |
|
| 1) |
Zygourakis CC, Davis JL, Kaur G, et al. Management of central nervous system teratoma. J Clin Neurosci. 2015;22(1):98-104.
[PMID: 25150764] |
| 2) |
Noudel R, Vinchon M, Dhellemmes P, et al. Intracranial teratomas in children: the role and timing of surgical removal. J Neurosurg Pediatr. 2008 ;2(5):331-8.
[PMID: 18976103] |
| 3) |
Matsutani M, Takakura K, Sano K. Primary intracranial germ cell tumors: pathology and treatment. Prog Exp Tumor Res. 1987;30:307-12.
[PMID: 2819945] |
| 4) |
Kageyama N, Kobayashi T, Kida Y, et al. Intracranial germinal tumors. Prog Exp Tumor Res. 1987;30:255-67.
[PMID: 3628811] |
| 5) |
Nakamura H, Makino K, Kochi M, et al. Evaluation of neoadjuvant therapy in patients with nongerminomatous malignant germ cell tumors. J Neurosurg Pediatr. 2011 ;7(4):431-8.
[PMID: 21456918] |
| 6) |
Goldman S, Bouffet E, Fisher PG, et al. Phase II Trial Assessing the Ability of Neoadjuvant Chemotherapy With or Without Second-Look Surgery to Eliminate Measurable Disease for Nongerminomatous Germ Cell Tumors: A Children's Oncology Group Study. J Clin Oncol. 2015:33(22): 2464-71.
[PMID: 26101244] |
| 7) |
Murray MJ, Bartels U, Nishikawa R, et al. Consensus on the management of intracranial germ-cell tumours. Lancet Oncol. 2015;16(9):e470-7.
[PMID: 26370356] |
| 8) |
Kim CY, Choi JW, Lee JY, et al. Intracranial growing teratoma syndrome: clinical characteristics and treatment strategy. J Neurooncol. 2011;101(1):109-15.
[PMID: 20532955] |
| 9) |
Ogiwara H, Kiyotani C, Terashima K, et al. Second-look surgery for intracranial germ cell tumors. Neurosurgery. 2015;76(6):658-61.
[PMID: 25988926] |
|
|

|
| 目次へ戻る!
|

|
| |
CQ5 中枢神経原発胚細胞腫に合併した水頭症に対して手術は必要か。
|

|
| |
推奨
内視鏡下第3脳室底開窓術などの水頭症を解除する手術を推奨する。(推奨度1B)
|
|

|
| |
解説
|

|
| |
|
Shonoらは、12例のジャーミノーマに対して、軟性鏡を用いて内視鏡下生検術を行い、8例は同時に第3脳室底開窓術を施行した1)。手術死亡や永続的な合併症は認めず、その後のシャント手術は不要であった。化学放射線療法にて全例でCRを得た。Lutherらは、第3脳室底開窓術と生検術を同時に行った32例において、NGGCTを含む胚細胞腫瘍、松果体芽腫、上衣腫の髄液播種リスクの高いと判断された22例の2年無髄液播種生存率は94.7%で、同様の疾患の髄液播種率が8~24%であることから、第3脳室底開窓術と生検術の同時施行が髄液播種リスクを上昇しないと報告した2)。水頭症を合併する例では、内視鏡手術による生検と同時に第3脳室底開窓術などの水頭症を解除する手術を推奨する。ただし、化学放射線療法による腫瘍縮小で水頭症が解除されうることを念頭に置く必要がある。
水頭症の解除を脳室腹腔シャント術で行って良いかどうかについて、Xuらは、原発性中枢神経系腫瘍のシャント術に関連する神経管外転移についてシステマティックレビューを行い、106例のシャントに関連する神経管外転移の内25例(25%)(VPシャント24例、VAシャント1例)がジャーミノーマであったと報告した。この25例全例(100%)腹腔内に転移しており、さらに同時にリンパ節に4%、骨に4%の神経管外転移が認められている。これは、髄芽腫の22例(21%)より多く、最も多い腫瘍組織型であったことから、中枢神経原発胚細胞腫に合併した水頭症に対するシャント術による神経管外転移に注意を要する3)。こうした合併症を避けるためにも、中枢神経原発胚細胞腫に合併した水頭症に対しては、可能な限り第3脳室開窓術が推奨される。
|

|
| |
|
| |
参考文献
|
| |
|
| 1) |
Shono T, Natori Y, Morioka T, et al. Results of a long-term follow-up after neuroendoscopic biopsy procedure and third ventriculostomy in patients with intracranial germinomas. J Neurosurg Pediatr. 2007;107(3):193-8.
[PMID: 17918523] |
| 2) |
Luther N, Stetler WR Jr., Dunkel IJ, et al. Subarachnoid dissemination of intraventricular tumors following simultaneous endoscopic biopsy and third ventriculostomy. J Neurosurg Pediatr. 2010;5(1):61-7.
[PMID: 20043737] |
| 3) |
Xu K, Khine KT, Ooi YC, et al. A systematic review of shunt-related extraneural metastases of primary central nervous system tumors. Clin Neurol Neurosurg. 2018 ;174:239-43.
[PMID: 30292900] |
|
|

|
| |
|
<課題2のシステマティックレビュー結果>
|
| |
|
このクリニカルクエスチョンに応えるため、中枢神経原発胚細胞腫の手術について下記検索式による検索を2017年3月に行った。
|
| |
|
| # |
検索式 |
文献数 |
| #1 |
intracranial germ cell tumor AND surgery |
4,384
|
| #2 |
intracranial germ cell tumor AND biopsy |
5,100
|
| #3 |
intracranial germ cell tumor AND basal ganglia |
131
|
| #4 |
intracranial germ cell tumor AND basal ganglia AND biopsy |
93
|
| #5 |
intracranial germ cell tumor AND pituitary stalk |
135
|
| #6 |
intracranial germ cell tumor AND endoscopy |
124
|
| #7 |
intracranial germ cell tumor AND endoscopic |
172
|
| #8 |
intracranial germ cell tumor AND surgery AND teratoma |
444
|
| #9 |
intracranial germ cell tumor AND surgery AND mature teratoma |
262
|
| #10 |
intracranial germ cell tumor AND surgery AND hydrocephalus |
409
|
| #11 |
intracranial germ cell tumor AND surgery AND ventriculostomy |
52
|
| #12 |
intracranial germ cell tumor AND surgery AND non-germinomatous germ cell tumor |
24
|
|
| |
|
| 以上の検索式より、一次スクリーニングとして90の文献を抽出し、56文献の構造化抄録を作成した。それらのエビデンス総体をもとに、推奨と解説文を作成したが、その後にもいくつかの文献を加える必要があり、随時訂正し、最終的に、CQ3では6文献、CQ4では9文献、CQ5では3文献を抽出するに至った。 |
|

|
| 目次へ戻る!
|

|
| 課題3:ジャーミノーマに対する治療
|

|
| |
CQ6 ジャーミノーマにおいて化学放射線療法は必要か。
|

|
| |
| 推奨
|
| 1. |
脊髄播種のないジャーミノーマにおいては化学療法を併用した全脳室を照射野内に含める放射線照射を推奨する。(推奨度1B) |
| 2. |
脊髄播種のないジャーミノーマに対しては、予防的脊髄照射を行わないことを推奨する。(推奨度1C) |
| 3. |
化学療法単独で治療しないことを推奨する。(推奨度1B) |
|

|
| |
解説
|

|
| |
|
ジャーミノーマは放射線治療と化学療法への感受性が高い腫瘍であり、腫瘍摘出術を行わなくても、適切な治療を行えば、非常に高い生存率が期待できる悪性脳腫瘍である。ジャーミノーマは、脳室壁を伝うような腫瘍進展をきたすことが知られており、腫瘍への局所照射のみでは、照射野外への再発を十分に予防することができない。しかし、脊髄予防照射を行っていない症例で脊髄再発の報告が非常に少ないことから、ジャーミノーマの脊髄腫瘍進展はほぼないと考えられる。一方で、全脳脊髄照射は非常に有効な治療であり、一定以上の放射線量を全脳または全脳脊髄照射を行うことにより、ジャーミノーマの5年無病生存率は90%を超える1,2)。しかしながら、長期生存が期待される小児および若年成人において、全脳または全脳脊髄への放射線療法が成長発達に与える影響は大きく、高次機能異常や内分泌異常などの問題が、長期にわたって若年生存者に大きくのしかかる3-6)。Dennisらは、対象疾患はWilms腫瘍であるが、脊髄にも照射された25例の放射線療法の長期生存例の脊椎発達障害について報告している。脊髄照射に伴う小児の脊椎発達障害は何らかほぼ全例で発生しており、3歳未満では8Gy、3歳以上では14Gy以上の照射で照射後5年以内に5%の割合で生ずるとされており、長期生存が期待されるジャーミノーマ患者において脊髄照射は留意すべき点であると考えられる7)。
播種のないジャーミノーマに対してドイツで行われた全脳脊髄照射(CSI)による前向き多施設共同試験MAKEI83/86/89の報告によると、MAKEI83/86(11例)では全脳脊髄照射36Gy+局所照射14Gy、MAKEI89(49例)では全脳脊髄照射30Gy+局所照射15Gyが照射され、それぞれの5年無増悪生存率は100%、88.8%、5年全生存率は100%、92%と報告されている1)。Choらは60例のジャーミノーマに対して段階的に腫瘍部分の総線量を59から39.3Gy(中央値45Gy)、全脳脊髄照射の線量を36.5から19.5Gy(うち22例は脊髄線量が19.5Gy)まで減少させる照射を行い、全例で再発を認めておらず、照射線量は腫瘍部分には39.3Gy、脊髄には19.5Gyまで減少させることができると報告している8)。
照射野の設定については、播種のないジャーミノーマにおける照射後の再発と照射野との関連を評価することを目的に行われたSFOP TGM-TC-90試験では、カルボプラチン、エトポシド、イホスファミドによる化学療法を先行後、腫瘍局所(腫瘍部分+2cmマージン)に40Gyの照射が行われた。60症例中10例に再発を認め、うち8例は脳室周囲であった。この結果から腫瘍局所のみの照射は再発のリスクが高く、播種のないジャーミノーマにおいても全脳室照射は必要であると結論された9)。
同様に播種のないジャーミノーマに対する非ランダム化試験であるSIOP CNS GCT96試験では、全脳脊髄照射24Gy+局所照射16Gyの放射線療法単独群と化学療法を併用した40Gyの局所照射群との比較が行われた。放射線療法単独群125人中4人で腫瘍局所に再発を認める一方、化学療法併用局所照射群65人中7人に再発を認め、うち6人は照射野外の脳室内再発であった。化学療法併用であっても照射範囲に全脳室を含める必要があると考えられる10)。このように、ジャーミノーマの放射線療法の線量と照射野については、将来的なQOLを考慮しながら、化学療法を併用することで、放射線量の減量と照射野の縮小を図る試みが、日本をはじめ世界各地で行われてきた。中枢神経外胚細胞腫瘍の化学療法として、ブレオマイシン、エトポシド、シスプラチンの3剤を併用するBEP療法が確立しているが、中枢神経系ジャーミノーマの化学放射線治療においては、プラチナ系薬剤とエトポシドの2剤による併用療法、あるいはイホマイドなどのアルキル化剤も加えた3剤による併用療法が、臨床試験で繰り返し選ばれている。SIOP CNS 96試験に加えて、Matsutani 及び日本小児脳腫瘍研究グループ11,12)は75例の脊髄播種のないジャーミノーマに対し3コースのカルボプラチン、エトポシドと拡大局所照射野に視床下部—下垂体系の耐容線量とも言われる24Gyを併用する前向き臨床試験を行い、92%にCRが得られて、中央値が2.9年の観察期間において12%に再発が認められ、10年全生存率は97.5%と報告した。この「拡大局所照射野」は後の全脳室照射野に近いが、全脳室照射野に比べて第四脳室下半がカバーされていない。両試験において、再発は照射外で多く認めた一方で、脊髄再発はほとんど観察されていない。Khatua Sら13)は、脊髄播種のないジャーミノーマ20例(うち混合腫瘍でないジャーミノーマ19例)に対して4コースのカルボプラチン、エトポシドによる化学療法を、その後に全脳室照射21.6Gy、及び腫瘍局所へのブースト(総線量30~30.6Gy)の放射線療法を同時もしくは逐次で行い、後方視的に解析した。3年無再発生存率は89%で全生存率は100%であった。これらの良好な結果から、現在SIOPではSIOP CNS GCT II 14)において、脊髄播種のないジャーミノーマに対し、化学療法によるCR症例には投与線量を全脳室照射 24Gyまで、また我が国においてもカルボプラチン、エトポシド療法と投与線量を全脳室照射23.4Gyまで低減させる臨床試験(jRCTs031180223)が行われている。これらの観察が、ジャーミノーマにおいて脳室照射を推奨する根拠である。さらなる放射線療法の減量や縮小は、臨床試験の中で行われるべきである。ジャーミノーマのなかで基底核および視床に発生した腫瘍に関しては例外的な治療を推奨する報告もある15)。Wangらは、15例の基底核もしくは視床の胚細胞腫の治療成績を報告しているが、9例はジャーミノーマであり、再発はない。彼らは他の部位のジャーミノーマと比較して基底核や視床の胚細胞腫は脳実質への浸潤の可能性が高いため、全脳室照射より全脳照射(20~24Gy)に加えて局所照射をおこない40~45Gyの照射を推奨している17)。
シスプラチンとカルボプラチンの比較試験は、中枢神経外の胚細胞腫瘍において行われているが、中枢神経ジャーミノーマにおいては、その優劣を検証した臨床試験はない16,17)。また、プラチナ系薬剤とエトポシドの2剤による併用療法、あるいはアルキル化剤も加えた3剤による併用療法を比較した臨床試験もこれまでに行われていないため、治療毒性を考慮すると、中枢神経ジャーミノーマにおいては、プラチナ系薬剤とエトポシドの2剤による併用療法が推奨される。また、SIOPにおけるレジメンにおいては、カルボプラチンとエトポシドの2剤投与とサイクロフォスファミドとエトポシドの2剤が交互に投与され、良好な治療成績を得ているが、どちらのレジメンが優れているかとの評価は難しい10)。放射線療法の毒性を取り除くために、強力な化学療法単独でジャーミノーマを治療する試みは行われてきた。最初の化学療法単独のトライアルとして、Balmacedaらは71例の中枢神経原発胚細胞腫において45例のジャーミノーマをカルボプラチン、エトポシド、ブレオマイシンのレジメンにて治療しているが、50%以上の症例において再発をきたしている18)。Kellieらは19例の腫瘍マーカー陰性のジャーミノーマの症例において、レジメンA(シスプラチン、エトポシド、サイクロフォスファミド、ブレオマイシン)と強力な化学療法から導入し、レジメンB(カルボプラチン、エトポシド、ブレオマイシン)の維持療法を追加するという治療を行っている。結果は19例中8例に再発がみられ、放射線療法が追加されている19)。da Silvaらは、25例の中枢神経原発胚細胞腫を初期治療として化学療法のみ(第1クール:カルボプラチンとエトポシド、第2クール:サイクロフォスファミドとエトポシドを交互に2回ずつ投与)、で治療を行っており、そのうち15例はジャーミノーマにも関わらず、7例に再発し放射線療法の追加治療を行っている20)。これらの複数の臨床試験から示された再発率の高さから、化学療法単独による治療は推奨されない。
播種のないジャーミノーマに対する脊髄照射については、多数の文献から症例を集めたRogersらの報告によると、播種のないジャーミノーマに対して全脳全脊髄照射+局所照射を行った343症例のうち、脊髄播種を認めたものは4例(1%)であったのに対して、全脳もしくは全脳室照射+局所照射を行った276症例のうち、脊髄播種を認めたものは8例(3%)と報告されている21)。また、脊髄照射の生存への寄与を検討したShikamaらの報告では、国内6施設から180人のデータを集め、多変量解析が行われた。その結果、脊髄照射のハザード比は1.050(95% 信頼区間:0.355-3.170)と脊髄照射は必ずしも生存に寄与していないことが示された22)。播種のないジャーミノーマに対する予防的脊髄照射の必要性は乏しい。
|

|
| |
|
| |
参考文献
|
| |
|
| 1) |
Bamberg M, Kortmann RD, Calaminus G, et al. Radiation therapy for intracranial germinoma: results of the German cooperative prospective trials MAKEI 83/86/89. J Clin Oncol. 1999;17(8):2585-92.
[PMID: 10561326] |
| 2) |
Ogawa K, Shikama N, Toita T, et al. Long-term results of radiotherapy for intracranial germinoma: a multi-institutional retrospective review of 126 patients. Int J Radiat Oncol Biol Phys. 2004;58(3):705-13.
[PMID: 14967424] |
| 3) |
Sands SA, Kellie SJ, Davidow AL, et al. Long-term quality of life and neuropsychologic functioning for patients with CNS germ-cell tumors: from the First International CNS Germ-Cell Tumor Study. Neuro Oncol. 2001;3(3): 174-83.
[PMID: 11465398] |
| 4) |
Liang SY, Yang TF, Chen YW, et al. Neuropsychological functions and quality of life in survived patients with intracranial germ cell tumors after treatment. Neuro Oncol. 2013;15(11): 1543-51.
[PMID: 24101738] |
| 5) |
Martens T, Rotermund R, Eulenburg CZ, et al. Long-term follow-up and quality of life in patients with intracranial germinoma. Neurosurg Rev. 2014;37(3): 445-50; discussion 451.
[PMID: 24715277] |
| 6) |
Park Y, Yu ES, Ha B, et al. Neurocognitive and Psychological Functioning of Children with an Intracranial Germ Cell Tumor. Cancer Res Treat. 2017;49(4): 960-9.
[PMID: 28052648] |
| 7) |
Heaston DK, Libshitz HI, Chan RC. Skeletal effects of megavoltage irradiation in survivors of Wilms’s tumor. AJR Am J Roentgenol. 1979;133(3):389-95.
[PMID: 6291840] |
| 8) |
Cho J, Choi JU, Kim DS, et al. Low-dose craniospinal irradiation as a definitive treatment for intracranial germinoma. Radiother Oncol. 2009;91(1):75-9.
[PMID: 19019472] |
| 9) |
Alapetite C, Brisse H, Patte C, et al. Pattern of relapse and outcome of non-metastatic germinoma patients treated with chemotherapy and limited field radiation: the SFOP experience. Neuro Oncol. 2010;12(12): 1318-25.
[PMID: 20716594] |
| 10) |
Calaminus G, Kortmann R, Worch J, et al. SIOP CNS GCT 96: final report of outcome of a prospective, multinational nonrandomized trial for children and adults with intracranial germinoma, comparing craniospinal irradiation alone with chemotherapy followed by focal primary site irradiation for patients with localized disease. Neuro Oncol. 2013;15(6): 788-96.
[PMID: 23460321] |
| 11) |
Matsutani M, Japanese Pediatric Brain Tumor Study Group. Combined chemotherapy and radiation therapy for CNS germ cell tumors--the Japanese experience. J Neurooncol. 2013; 54(3): 311-6.
[PMID: 11767296] |
| 12) |
Matsutani M, Proceedings of the 3rd International CNS Germ Cell Tumour Symposium. Br J Neurosurg. 2013; 27 (4) e1–e25. |
| 13) |
Khatua S, Dhall G, O'Neil S, et al. Treatment of primary CNS germinomatous germ cell tumors with chemotherapy prior to reduced dose whole ventricular and local boost irradiation. Pediatr Blood Cancer.2010;55(1):42-6.
[PMID: 20222020] |
| 14) |
https://clinicaltrials.gov/ct2/show/record/NCT01424839 |
| 15) |
Wang M, Zhou P, Zhang S, et al. Clinical features, radiologic findings, and treatment of pediatric germ cell tumors involving the basal ganglia and thalamus: a retrospective series of 15 cases at a single center. Childs Nerv Syst. 2018; 34(3):423-30.
[PMID: 29067503] |
| 16) |
Horwich A, Sleijfer DT, Fosså SD, et al. Randomized trial of bleomycin, etoposide, and cisplatin compared with bleomycin, etoposide, and carboplatin in good-prognosis metastatic nonseminomatous germ cell cancer: a Multiinstitutional Medical Research Council/European Organization for Research and Treatment of Cancer Trial. J Clin Oncol. 1997;15(5): 1844-52.
[PMID: 9164194] |
| 17) |
Mann JR, Raafat F, Robinson K, et al. UKCCSG's germ cell tumour (GCT) studies: improving outcome for children with malignant extracranial non-gonadal tumours--carboplatin, etoposide, and bleomycin are effective and less toxic than previous regimens. United Kingdom Children's Cancer Study Group. Med Pediatr Oncol. 1998;30(4): 217-27.
[PMID: 9473756] |
| 18) |
Balmaceda C, Heller G, Rosenblum M, et al. Chemotherapy without irradiation--a novel approach for newly diagnosed CNS germ cell tumors: Results of an international cooperative trial. J Clin Oncol. 1996; 14(11): 2908-15.
[PMID: 8918487] |
| 19) |
Kellie SJ, Boyce H, Dunkel IJ, et al. Intensive cisplatin and cyclophosphamide-based chemotherapy without radiotherapy for intracranial germinomas: failure of a primary chemotherapy approach. Pediatr Blood Cancer. 2004; 43(2): 126-33.
[PMID: 15236278] |
| 20) |
da Silva NS, Cappellano AM, Diez B, et al. Primary chemotherapy for intracranial germ cell tumors: results of the third international CNS germ cell tumor study. Pediatr Blood Cancer. 2020; 54(3): 377-83.
[PMID: 20063410] |
| 21) |
Rogers SJ, Mosleh-Shirazi MA, Saran FH. Radiothraphy of localized intracranial germinoma: time to sever historical ties?, Lancet Oncol. 2005; 6(7): 509-19.
[PMID: 15992700] |
| 22) |
Shikama N, Ogawa K, Tanaka S, et al. Lack of benefit of spinal irradiation in the primary treatment of intracranial germinoma: a multiinstitutional, retrospective review of 180 patients. Cancer. 2005;104(1): 126-34.
[PMID: 15895370] |
|
|

|
| |
|
<課題3のシステマティックレビュー結果>
|
| |
|
このクリニカルクエスチョンに応えるため、最初は放射線治療と化学療法を別の課題として2017年2月に検索したが、最終的には、ジャーミノーマの化学放射線療法としてまとめた。検索式はジャーミノーマに関してのものを放射線療法と化学療法から抽出し、下記に示す。
|
| |
|
| # |
検索式 |
文献数 |
| #1 |
germinoma AND radiotherapy |
2,498
|
| #2 |
#1 AND intracranial |
380
|
| #3 |
intracranial germ cell tumor AND drug therapy |
1,793
|
| #4 |
intracranial germ cell tumor AND chemotherapy |
2,453
|
| #5 |
central nervous system germ cell tumor AND drug therapy |
4,602
|
| #6 |
central nervous system germ cell tumor AND chemotherapy |
5,856
|
| #7 |
intracranial germinoma AND drug therapy |
183
|
| #8 |
intracranial germinoma AND chemotherapy |
335
|
|
| |
|
| 最初、一次スクリーニングとして中枢神経原発胚細胞腫の放射線療法で96.化学療法で270の文献を抽出し、それぞれ26文献、35文献の構造化抄録を作成した。それらのエビデンス総体をもとに、推奨と解説文を作成したが、その後にもいくつかの文献を加える必要があり、随時訂正を加えた。途中で中枢神経原発胚細胞腫の放射線療法と化学療法として課題を別にするより、ジャーミノーマの化学放射線療法、NGGCTの化学放射線療法として課題を作成した方が理解しやすいとの結論に達し、課題3はジャーミノーマの化学放射線療法とし、最終的に、CQ6では24文献を抽出するに至った。
|
|

|
| 目次へ戻る!
|

|
| 課題4:NGGCTに対する治療
|

|
| |
CQ7 NGGCTには化学放射線療法を行うことが有用か。
|

|
| |
推奨
成熟奇形腫を除くNGGCTでは化学放射線療法を推奨する。(推奨度1B)
|
|

|
| |
解説
|

|
| |
|
NGGCTはジャーミノーマ以外の複数の胚細胞腫瘍組織型の総称であり、さらにはジャーミノーマを含む複数の異なる組織型の成分が混在する混合型NGGCTが多い。強力な集学的治療を行っても生存率が低い、卵黄嚢腫、胎児性癌、絨毛癌が大部分を占めるタイプから、比較的生存率の高い、奇形腫やジャーミノーマ中心の混合性タイプ、さらには手術摘出が基本で後治療を行わなくても再発が稀な成熟奇形腫まで、予後が大きく異なる腫瘍が含まれることがNGGCTの治療を複雑にしている。
NGGCTの多くでは、血中または脳脊髄液中にHCG/β-HCGやAFPといった腫瘍マーカーが検出される。診断を補助する有用な腫瘍マーカーである一方で、NGGCTが組織診断されずに腫瘍マーカーのみで診断されて、化学放射線治療で治療開始されることが多く、その場合に腫瘍の適切なリスク分類が困難となる。とくに欧米では比較的低い腫瘍マーカーの閾値でNGGCTを臨床診断し、全脳脊髄照射やアルキル化剤を含む強力な治療を開始することが多く、NGGCTの一部の患者で過剰治療の懸念があり、さらには発生頻度が比較的低い高悪性度NGGCTの真の治療成績が臨床試験の結果に反映されていない可能性がある。
日本においては、東京大学シリーズ(1963~1994)および旧厚生省がん研究助成金による多施設前向き試験(1995~2003)において、NGGCTの中で組織型と腫瘍マーカー高値によって、治療成績が異なる中間リスク群と高リスク群に分類できることを示した。中間リスクNGGCTは拡大局所照射(腫瘍床、第3脳室、側脳室、トルコ鞍、松果体を含む、全脳室照射とほぼ同等の照射野)または全脳室分割放射線照射約23.4Gyと局所への追加照射合計50.4Gyとカルボプラチンとエトポシドによる2剤併用化学療法で、平均観察期間3.7年時点での中間報告によると、無増悪生存率は89%であった1)。高リスクNGGCTに対しては、旧厚生省がん研究助成金による多施設前向き試験をはじめとする国内外の臨床試験で、放射線療法とプラチナ系、イホマイドなどのアルキル化剤、エトポシドによる3剤併用化学療法によって治療が行われており、一定の生存率が得られている。放射線療法の方法や化学療法の強度や期間について、臨床試験ごとに異なっており、比較試験は行われたことがなく、標準的な化学放射線療法は定まっていない1-3)。高リスクNGGCTの治療成績は依然として満足のいくものでなく、初期からの治療抵抗例、早期の播種再発例も少なくない。脊髄播種がなくても全脳脊髄照射が必要であるのかという問いに対して、まだ答えは示されていない1)。脊髄播種のないNGGCTにおける放射線療法の照射野については議論がある。大半の脊髄播種のないNGGCTにおいて、化学療法を併用した場合に全脳脊髄照射が不要であることは、SIOP GCT 96試験および旧厚生省がん研究助成金による多施設前向き試験(1995~2003)で示唆された1,2)。ジャーミノーマとの混合性腫瘍が多い中間リスクNGGCTにおいて、局所照射で充分であるのか、全脳室照射が必要かどうかは、さらなる検証が必要である。
ジャーミノーマと異なりNGGCTは3~4歳未満の低年齢小児に発生することがあり、中枢神経への放射線療法の影響が甚大である低年齢患者に対する、年長児や若年成人とは異なった治療戦略が必要である。しかし、低年齢のNGGCTに対しても、現時点で標準的といえる治療法は確立していない。 乳幼児に対する脳腫瘍摘出術と強力な多剤併用化学療法が施行できる専門施設での治療が望まれる。
NGGCTにおける化学療法先行後の残存腫瘍へのsecond-look surgeryについてはCQ4の推奨2を参照のこと。
|

|
| |
|
| |
参考文献
|
| |
|
| 1) |
Matsutani M, Japanese Pediatric Brain Tumor Study Group. Combined chemotherapy and radiation therapy for CNS germ cell tumors--the Japanese experience. J Neurooncol. 2001; 54(3): 311-6.
[PMID: 11767296] |
| 2) |
Calaminus G, Frappaz D, Kortmann RD, et al. Outcome of patients with intracranial non-germinomatous germ cell tumors-lessons from the SIOP-CNS-GCT-96 trial. Neuro Oncol. 2017; 19(12): 1661-72.
[PMID: 29048505] |
| 3) |
Goldman, S., E. Bouffet, P. G. Fisher, et al. Phase II Trial Assessing the Ability of Neoadjuvant Chemotherapy With or Without Second-Look Surgery to Eliminate Measurable Disease for Nongerminomatous Germ Cell Tumors: A Children's Oncology Group Study. J Clin Oncol. 2015; 33(22): 2464-71.
[PMID: 26101244] |
|
|

|
| |
|
<課題4のシステマティックレビュー結果>
|
| |
|
このクリニカルクエスチョンに応えるため、最初は放射線治療と化学療法を別の課題として2017年2月に検索したが、最終的には、NGGCTの化学放射線療法としてまとめた。検索式はNGGCTに関してのものを放射線療法と化学療法から抽出し、下記に示す。
|
| |
|
| # |
検索式 |
文献数 |
| #1 |
germ cell tumor AND radiotherapy |
31,763
|
| #2 |
#1 AND central nervous system |
4,351
|
| #3 |
#1 AND intracranial |
2,157
|
| #4 |
non germinomatous germ cell tumor AND radiotherapy |
1,793
|
| #5 |
intracranial germ cell tumor AND chemotherapy |
2,453
|
| #6 |
central nervous system germ cell tumor AND drug therapy |
4,602
|
| #7 |
central nervous system germ cell tumor AND chemotherapy |
5,856
|
| #8 |
intracranial non germinomatous germ cell tumor AND drug therapy |
23
|
| #9 |
intracranial non germinomatous germ cell tumor AND chemotherapy |
42
|
|
| |
|
| 最初、一次スクリーニングとして中枢神経原発胚細胞腫の放射線療法で96.化学療法で270の文献を抽出し、それぞれ26文献、35文献の構造化抄録を作成した。それらのエビデンス総体をもとに、推奨と解説文を作成したが、その後にもいくつかの文献を加える必要があり、随時訂正を加えた。途中で中枢神経原発胚細胞腫の放射線療法と化学療法として課題を別にするより、ジャーミノーマの化学放射線治療、NGGCTの化学放射線療法として課題を作成した方が理解しやすいとの結論に達し、課題4はNGGCTの化学放射線療法とし、最終的に、CQ7は3文献を抽出するに至った。
|
|

|
| 目次へ戻る!
|

|
| 課題 5 :再発時の治療方針
|

|
| |
CQ8 再発ジャーミノーマに対し救済治療を行う必要があるか。
|

|
| |
推奨
治癒を目指して治療を行うことを推奨する。(推奨度1B)
|
|

|
| |
解説
|

|
| |
|
再発ジャーミノーマについては、救済治療により治癒可能であることが報告されている。いずれの報告も、症例報告または症例報告の記述的研究1)であり、後方視的解析2)であり、これらの報告から、再発時に何らかの救済治療追加を行うことは有意義であることは読み取れるが、治療方法の優劣を判断するのは困難であり、標準的な治療方針を確定することはできない。
Kamoshimaらは、再発までの期間の中央値が50カ月の晩期再発ジャーミノーマ25例について、再発様式の解析と再発後の救済治療の転帰を報告している。初発の治療法、再発時の治療は統一されたものではない。25例のうち、治療により救命されたのは17例(68%)である。再発時に化学放射線療法を行った13例は13例全例が生存しているのに対し、放射線療法のみで治療された11例は7例が、化学療法のみで治療された1例が再発のために死亡したと報告している。化学放射線療法を行った13例の放射線療法は8例がCSI、4例が局所照射、1例が全脳室照射であり、放射線のみで治療された11例は7例が死亡しており、それらはすべて局所照射が行われている。生存の4例中2例はCSI、2例が局所照射である。つまり再発時には放射線の局所照射だけでは治癒できないと思われる2)。
Huらは、11例の再発ジャーミノーマに対する救済治療とその転帰について報告している。初発時の放射線療法は、全脳照射、全脳室照射、腫瘍への局所照射、ガンマナイフ治療と異なった治療を受けた患者から構成される。再発時の救済治療も全脳脊髄照射(CSI)単独4例、全脳脊髄照射と化学療法併用5例、全脳照射と化学療法併用1例、ガンマナイフ治療1例と異なっている。全体の5年生存率が71%であるのに対して、CSIを採用した患者は92%で、再発時のCSI採用の有無が予後因子になっていたと報告している3)。
Modakらは、初期治療中の治療抵抗例および再発中枢神経系胚細胞腫瘍に対する、チオテパを中心とした大量化学療法の有用性を検討した報告の中で、9例の再発ジャーミノーマの転帰を示している。初発時には放射線療法のみのもの、放射線治療と化学療法併用を受けたものが含まれる。9例中7例(78%)が、生存期間中央値48カ月で、無病生存していると報告している4)。生存7例のうち4例は放射線療法を行っておらず、2例は全脳照射で、1例がCSIであり、死亡した2例において1例は放射線療法を行っておらず、1例は局所照射である。
Baekらは、初期治療中の治療抵抗例および再発中枢神経系胚細胞腫瘍に対する大量化学療法の臨床試験KSPNO S-053(KSPNO:Korean Society of Pediatric Neuro-Oncology)の結果を報告している。対象となった20例中10例は、2回目の大量化学療法を施行された。前向き試験であるが、初発時の治療法は異なっており、再発時にも、治療法が統一されていない。再発ジャーミノーマ9例のうち、大量化学療法のみで治療された7 例中4例が無病生存しているのに対して、大量化学療後に放射線療法を併用した2例は2例とも無病生存している5)。
救済治療後の障害やQuality of Life(QOL)については、Baekらの報告では、特に大量化学療法を行うことで重篤な有害事象を来すことやQOLを極端に落とすということはないという記載がある。しかし、これまでの報告症例数が少なく、放射線療法単独、化学放射線療法、大量化学療法、大量化学療法の併用の治療法について、優劣を判断することはできない。
|

|
| |
|
| |
参考文献
|
| |
|
| 1) |
Janjetovic S, Bokemeyer C, Fiedler W,et al. Late recurrence of a pineal germinoma 14 years after radiation and chemotherapy: a case report and review of the literature. Onkologie. 2013;36(6):371-3.
[PMID: 23774153] |
| 2) |
Kamoshima Y, Sawamura Y, Ikeda J,et al. Late recurrence and salvage therapy of CNS germinomas. J Neurooncol. 2008;90(2):205-11.
[PMID: 18604473] |
| 3) |
Hu YW, Huang PI, Wong TT, et al. Salvage treatment for recurrent intracranial germinoma after reduced-volume radiotherapy: a single-institution experience and review of the literature.Int J Radiat Oncol Biol Phys. 2012;84(3):639-47.
[PMID: 22361082] |
| 4) |
Modak S, Gardner S, Dunkel IJ, et al. Thiotepa-based high-dose chemotherapy with autologous stem-cell rescue in patients with recurrent or progressive CNS germ cell tumors. J Clin Oncol. 2004 ;22(10):1934-43.
[PMID: 15143087] |
| 5) |
Baek HJ, Park HJ, Sung KW,et al. Myeloablative chemotherapy and autologous stem cell transplantation in patients with relapsed or progressed central nervous system germ cell tumors: results of Korean Society of Pediatric Neuro-Oncology (KSPNO) S-053 study. J Neurooncol. 2013;114(3):329-38.
[PMID: 23824533] |
|
|

|
| 目次へ戻る!
|

|
| |
CQ9 再発 NGGCT に対し救済治療は有用か。
|

|
| |
推奨
寛解を目指した治療を提案する。治療反応性が不良の場合は、緩和的治療を提案する。(推奨度2C)
|
|

|
| |
解説
|

|
| |
|
再発NGGCTの予後はかなり厳しい。再発ジャーミノーマと異なり、再発NGGCT対して救済治療による救命例の報告は少なく、いずれも症例報告またはケースシリーズの記述的研究2)、後方視的解析3)であり、一般的に治療方針を推奨することはできない。
Modakらは1)、初期治療中の治療抵抗例および再発中枢神経系胚細胞腫瘍に対する、チオテパを中心とした大量化学療法の有用性を検討した報告の中で、12例の再発NGGCTの転帰を示している。12例中、無病生存しているのは、生存期間中央値35カ月で、4例(33%)であると報告している。この4例においては、初発時1例のみ局所の放射線療法を行っており、残りの3例はシスプラチン、イホマイド、エトポシドの化学療法だけ施行している。再発時、チオテパを中心とした大量化学療法を行っているが、その後の放射線療法は初発時放射線治療を行っていない2例に追加照射をされている。彼らは導入化学療法による完全寛解の達成の有無が予後を決定すると解析している。
Baekらは、初期治療中の治療抵抗例および再発中枢神経系胚細胞腫瘍に対する大量化学療法の臨床試験KSPNO S-053の結果を報告している2)。対象となった20例中10例は、2回目の大量化学療法を施行された。再発NGGCT 11例のうち、無病生存は導入化学療法で完全寛解となった4例であり、導入化学療法による完全寛解達成の成否が予後を左右すると解析している。これらの4例中3例は、再発後に23.4Gyから39.6Gyの全脳脊髄照射を含む放射線療法を併用されているが、そのうち1例は初発部位(松果体および視床下部)に合計75.6Gy(初回45Gy、再発時30.6Gy)照射されている。残りの1例は初発時に50Gy初発部位(松果体)に照射されているため、再発時放射線療法は施行されていない。
Murrayらは、SIOP-96の臨床研究にて登録されたNGGCTの再発例32例について検討しており、再発時の大量化学療法を行った症例22例とスタンダードな化学療法(カルボプラチンもしくはシスプラチン、イホマイド、エトポシドなど)を行った10例における5年生存率を比較している3)。SIOP-96の臨床研究におけるNGGCTに対する治療プロトコールは、単発例であればシスプラチン、イホマイド、エトポシド(ICE)のレジメンで4コースの化学療法を行い、54Gyの局所の放射線療法を行い、bifocal tumor以外の多発例には30Gyの全脳脊髄照射および24Gyの局所の照射を行うものである。再発時スタンダードな化学療法を行った症例の5年生存率は0であり、大量化学療法を行った症例でも22例中5年生存できた症例は3例だけであった。この3例に対する再発時の放射線療法は、1例において局所照射されているが、他の2例において放射線療法は施行されていない。この結果からは、再発時放射線療法が可能であったかどうかは予後に影響しないと言える。
これらの報告のように、再発時のNGGCTの救済治療は初期治療、特に放射線療法の有無は再発時の照射に影響する。大量化学療法が施行できても、寛解する例は多くない。また、再発NGGCTの治療による無病生存例の報告においても、治療後の障害やQuality of Life(QOL)についての情報は乏しい。大量化学療法、連続大量化学療法と放射線療法の併用による無病生存の達成があるものの、これらの救済治療による生存率は高いとは言えず、新規の治療法が開発される必要がある。
|

|
| |
|
| |
参考文献
|
| |
|
| 1) |
Modak S, Gardner S, Dunkel IJ, et al. Thiotepa-based high-dose chemotherapy with autologous stem-cell rescue in patients with recurrent or progressive CNS germ cell tumors. J Clin Oncol. 2004 May 15;22(10):1934-43.
[PMID: 15143087] |
| 2) |
Baek HJ, Park HJ, Sung KW,et al. Myeloablative chemotherapy and autologous stem cell transplantation in patients with relapsed or progressed central nervous system germ cell tumors: results of Korean Society of Pediatric Neuro-Oncology (KSPNO) S-053 study. J Neurooncol. 2013;114(3):329-38.
[PMID: 23824533] |
| 3) |
Murray MJ, Bailey S, Heinemann K, et al. Treatment and outcomes of UK and German patients with relapsed intracranial germ cell tumors following uniform first-line therapy. Int J Cancer. 2017;141(3):621-35.
[PMID: 28463397] |
|
|

|
| |
|
<課題5のシステマティックレビュー結果>
|
| |
|
このクリニカルクエスチョンに応えるため、中枢神経原発胚細胞腫における再発の治療方針について下記検索式による検索を2017年7月に行った。
|
| |
|
| # |
検索式 |
文献数 |
| #1 |
intracranial AND germ cell tumor AND recurrent |
527
|
| #2 |
central nervous system AND germinoma AND recurrent |
1,184
|
| #3 |
germinoma AND recurrent AND central nervous system |
51
|
| #4 |
non germinomatous germ cell tumor AND recurrent AND central nervous system |
7
|
|
| |
|
| 以上の検索式より、以上の一次スクリーニングとして420 の文献を抽出し、41の文献の構造化抄録を作成した。それらのエビデンス総体をもとに、推奨と解説文を作成したが、その後にもいくつかの文献を加える必要があり、随時訂正し、最終的に、CQ8では5文献、CQ9では3文献を最終的に抽出するに至った。
|
|

|
| 目次へ戻る!
|

|
| 課題6:長期予後
|

|
| |
CQ10 中枢神経原発胚細胞腫におけるフォローアップは必要か。
|

|
| |
推奨
可能な限り長期に追跡することを推奨する。(推奨度1B)
|
|

|
| |
解説1:長期的なフォローアップについて
|

|
| |
|
CNSGCTの追跡としては、長くても10年程度までの報告が多い。MAKEI89やSIOP-CNS-GCT-96による前向き試験のnon-germinomatous germ cell tumors(NGGCT)の報告によれば1,2)、5年から10年で生存割合はプラトーに到達するように見える。しかし、CNSGCTの、より長期の予後について、前述の米国SEER databaseに1973~2005年までに報告されたジャーミノーマ 405例とNGGCT 94例のデータが報告によると、5年以上の生存者について、ジャーミノーマにおいてKaplan-Meier生存曲線は、人口統計に比べて遙かに速いペースで、30年以上ほぼコンスタントに下がり続けることが分かる3)。(1.中枢神経原発胚細胞腫瘍の基本的特徴(総論)図1を参照のこと。)ジャーミノーマの5年以上生存者405例において見られた46例の死亡の16%は癌死で、その約半数は胚細胞腫の再発であり、再発死亡例の死亡までの期間中央値は9.1年であった。従って、このKaplan-Meier生存曲線がコンスタントに下がり続けることを考えると、胚細胞腫の再発はおよそ20年で出尽くすともいえるかもしれない。ところが腫瘍再発による死亡以外の死因では、主に放射線療法による晩期障害と考えられる脳卒中が多く、脳卒中による死亡の危険率は人口統計よりも59倍であり、脳卒中による死亡までの期間中央値は23.8年とのことであった。Kaplan-Meier生存曲線が20年を超える辺りから加速度的に下がり続けるように見えるのは、この脳卒中など原病以外の疾病が原因と考えられる。従って、CNSGCTの追跡は、疾病管理という意味でも、またQOLや社会的なサポートという意味でも、永続的な診療やケアが必要であると考えられる。
|

|
| |
|
| |
参考文献
|
| |
|
| 1) |
Calaminus G, Bamberg M, Harms D, et al. AFP/beta-HCG secreting CNS germ cell tumors: long-term outcome with respect to initial symptoms and primary tumor resection. Results of the cooperative trial MAKEI 89. Neuropediatrics. 2005; 36(2):71-7.
[PMID: 15822019] |
| 2) |
Calaminus G, Frappaz D, Kortmann RD, et al. Outcome of patients with intracranial non-germinomatous germ cell tumors-lessons from the SIOP-CNS-GCT-96 trial. Neuro Oncol. 2017;19(12):1661-72.
[PMID: 29048505] |
| 3) |
Acharya S, DeWees T, Shinohara ET, et al. Long-term outcomes and late effects for childhood and young adulthood intracranial germinomas. Neuro Oncol. 2015 ;17(5):741-6.
[PMID: 25422317] |
|
|

|
| |
解説2:フォローアップにおける具体的な事項
|

|
| |
|
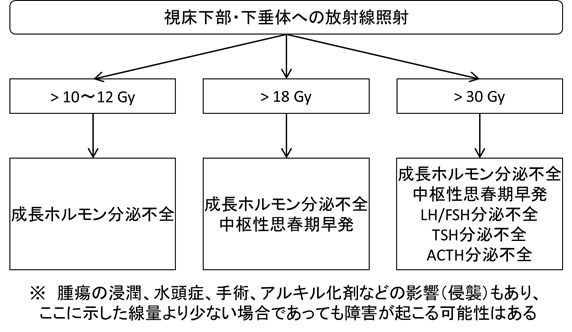
長期フォローアップにおける基礎的な背景因子として、それぞれの治療による障害の可能性を認識することが第1である。いずれも単変量解析ではあるが、全脳照射と基底核部病変が認知機能についての予後不良因子と報告されている1)。放射線療法の影響の程度は、線量・照射野・照射時年齢など様々な要因に影響される。目安として、照射線量ごとの認知機能・内分泌機能予後を示した(図1、表1)。また、化学療法に関しても表2に示すように、それぞれの薬剤に対して長期的に考慮すべき合併症が存在する。
フォローアップにおいては以下の項目について観察を行うことが推奨される。
【神経症状、脳脊髄MRI、腫瘍マーカー】
神経症状、脳と脊髄のMRIおよび腫瘍マーカーによる再発の有無の観察を行う。神経症状ならびに脳と脊髄のMRIは、放射線療法による脳血管腫や二次癌(髄膜腫やグリオーマ等)の有無の観察2)のため、再発のおそれがなくなったとしても継続して行うことを考慮する。更に胚細胞腫に限らず、ステロイドなどの投与歴などの症例において、副腎不全による死亡も報告されており、定期的な副腎機能のチェックは必要と思われる3)。画像検査の間隔については、治療終了後少なくとも2年間は3カ月毎、それ以降は4カ月~1年毎の頭部MRIを行うことが一般的である29)。
【認知機能、就学・就労】
小児CNSGCT経験者には認知機能障害の中でも特に、記憶障害が多く見られるため、全般的知能検査に記憶機能検査を加えることが重要である13)。通常の教育を受けられる者も多いが、学習困難があれば特別支援教育が必要となる。CNSGCT経験者にとって就労が困難となる原因には、認知機能のほかに視覚機能(視力・視野・眼球運動障害)も指摘されており、障害者枠就労や障害年金も考慮される10,11,14)。Sugiyamaらは、中学もしくは高校卒業後に就職したジャーミノーマ長期生存者11名中、7名が30歳以上になって記憶・計算の問題により失職したことを報告している4)。これらのことから、認知機能について、少なくとも就学前・進学前・就職前(進路選択)のタイミングを含めつつ、その後も定期的な評価が必要と考えられる。検査にあたっては、視覚機能や運動機能についても評価し5,6,15)、その結果を認知機能検査者にあらかじめ伝える必要がある。
【下垂体前葉、後葉機能および妊孕性】
内分泌合併症は、CNSGCTの長期生存者に最も多い合併症である6)。尿崩症については、治療後にも改善せず存在し続けることが報告されている15)。成長ホルモン投与の遅れは、成長障害のみならず、骨量減少のリスクを高めるため、早期補充が必要である8,9)。性機能については、性腺機能低下だけでなく思春期早発も起こるなど多様な症状が生じる6,10)。甲状腺機能低下や脂質代謝・糖代謝異常による肥満の報告もあり、これらの内分泌異常は治療後新たに起こることも稀ではない5,6,10-12)。中枢神経原発胚細胞腫瘍治療に対する妊孕性の温存に関しては、児や親権者の理解度,また倫理的な背景も考慮すべきであるが,小児がん経験者における不妊の問題を直視し,児や親権者の理解度,倫理的な背景を考慮して対応することが求められる。詳細に関しては日本がん治療学会の妊孕性ガイドラインを参照している(http://www.jsco-cpg.jp/fertility/)。
|
| |
|
|
| |
|
| 図1 放射線照射量ごとの視床下部―下垂体系内分泌合併症(European Society of EndocrinologyおよびPediatric Endocrine Societyによる文献16における図を日本語訳・一部改変)
|
|

|

|
| |
|
表1 胚細胞腫瘍治療後の認知機能に影響する主な要因
(文献1,4,10,11,17-27をもとに作成)
|
| |
|
| 要因 |
影響 |
局所(特に基底核)照射 >50Gy
全脳・全脳脊髄照射 >30G
7歳未満での照射 >18Gy
4歳未満での照射(極低線量でも)
|
●明らかに認知機能の障害を引き起こす
●全般的知能検査による知能指数(IQ)低下
|
| 全脳・全脳脊髄照射 >18Gy
|
●認知機能の障害を引き起こす可能性が高い
●特に以下の領域に影響しやすい
動作性知能(PIQ)
処理速度
記憶機能
遂行機能
|
何らかの放射線照射(極低線量でも)
頭蓋内手術
|
●全般的知能検査では正常範囲内
●ワーキングメモリや遂行機能など認知機能の
一部に障害(高次機能障害)が起こりうる
|
|
| |
|
※放射線療法が認知機能に及ぼす影響は、年単位での時間経過とともに進行する。小児期の治療と認知機能障害は、その後の学習にも困難をもたらす。この表に記載した要因に加えて、様々な要因(病前知能、身体的後遺症、環境など)が影響することに留意する
|

|
| |
|
表2 さまざまな機能予後因子と化学療法薬(文献28をもとに作成)
|
| |
|
| 障害部位 |
観察項目 |
アルキル化剤 |
白金製剤 |
その他 |
| CPM |
IFOS |
CBDCA |
CDDP |
VP16 |
VCR |
VBL |
BLM |
| 聴力 |
聴力、耳鳴、めまい |
|
|
◯ |
◯ |
|
|
|
|
| 末梢神経 |
感覚障害 |
|
|
◯ |
◯ |
|
◯ |
◯ |
|
| 運動障害 |
|
|
|
|
|
◯ |
◯ |
|
| 末梢血管 |
レイノー症状 |
|
|
|
|
|
◯ |
◯ |
|
| 肺 |
呼吸器症状 |
|
|
|
|
|
|
|
◯ |
精巣ホルモン分泌
/精子形成 |
思春期発来、性成熟、精巣容積、成長曲線 |
◯ |
◯ |
◯ |
◯ |
|
|
|
|
卵巣ホルモン分泌
/卵胞形成 |
思春期発来、性成熟、
成長曲線、月経関連症状、
更年期症状 |
◯ |
◯ |
◯ |
◯ |
|
|
|
|
| 腎機能 |
血圧 |
|
◯ |
◯ |
◯ |
|
|
|
|
| 尿路 |
血尿、尿失禁 |
◯ |
◯ |
|
|
|
|
|
|
| 二次癌(白血病) |
易疲労、易出血 |
◯ |
◯ |
◯ |
◯ |
◯ |
|
|
|
| 二次癌(膀胱) |
血尿、尿失禁 |
◯ |
|
|
|
|
|
|
|
|
| |
|
BLM:ブレオマイシン、CBDCA:カルボプラチン、CDDP:シスプラチン、CPM:シクロフォスファミド、IFOS:イホスファミド、
VCR:ビンクリスチン、VBL:ビンブラスチン、VP16:エトポシド
|

|
| |
|
| |
参考文献
|
| |
|
| 1) |
Liang SY, Yang TF, Chen YW, et al. Neuropsychological functions and quality of life in survived patients with intracranial germ cell tumors after treatment. Neurooncol. 2013;15(11):1543-51.
[PMID: 24101738] |
| 2) |
Nakamura H, Makino K, Ushio Y, et al. Therapy-associated secondary tumors in patients with non-germinomatous malignant germ cell tumors. J Neurooncol. 2011;105(2):359-64.
[PMID: 21533838] |
| 3) |
Puar TH, Stikkelbroeck NM, Smans LC, et al. Adrenal Crisis: Still a Deadly Event in the 21st Century. Am J Med. 2016;129(3):339.e1-9.
[PMID: 26363354] |
| 4) |
Sugiyama K, Yamasaki F, Kurisu K, et al. Quality of life of extremely long-time germinoma survivors mainly treated with radiotherapy. Prog Neurol Surg. 2009;23:130-9.
[PMID: 19329867] |
| 5) |
Saeki N, Tamaki K, Murai H, et al. Long-term outcome of endocrine function in patients with neurohypophyseal germinomas. Endocr J. 2000;47(1):83-9.
[PMID: 10811297] |
| 6) |
Calaminus G, Bamberg M, Harms D, et al. AFP/β-HCG secreting CNS germ cell tumors: long-term outcome with respect to initial symtoms and primary tumor resection. Results of the cooperative trial MAKEI 89. Neuropediatrics 2005;36(2):71-7.
[PMID: 15822019] |
| 7) |
Gonzalez BL, Grill J, Bourdeaut F, et al. Water and electrolyte disorders at long-term post-treatment follow-up in paediatric patients with suprasellar tumours include unexpected persistent cerebral salt-wasting syndrome. Horm Res Paediatr. 2014;82(6):364-71.
[PMID: 25377653] |
| 8) |
Okita Y, Narita Y, Miyakita Y, et al. Long-term follow-up of vanishing tumors in the brain: how should a lesion mimicking primary CNS lymphoma be managed? Clin Neurol Neurosurg. 2012;114(9):1217-21.
[PMID: 22445618] |
| 9) |
Kang MJ, Kin SM, Lee YA, et al. Risk factors for osteoporosis in long-term survivors of intracranial germ cell tumors. Osteoporos Int. 2012;23(7):1921-9.
[PMID: 22057549] |
| 10) |
Benesch M, Lackner H, Schageri S, et al. Tumor- and treatment-related side effects after multimodal therapy of childhood intracranial germ cell tumors. Acta Paediatr. 2001;90(3):264-70.
[PMID: 11332165] |
| 11) |
Jereb B, Korenjak R, Krzisnik C, et al. Late sequelae in children treated for brain tumors and leukemia. Acta Oncol. 1994;33(2):159-64.
[PMID: 8204270] |
| 12) |
Shim KW, Park EK, Lee YH, et al. Treatment strategy for intracranial primary pure germinoma. Childs Nerv Syst. 2013;29(2):239-48.
[PMID: 22965772] |
| 13) |
Wilkening GN, Madden JR, Barton VN, et al. Memory deficits in patients with pediatric CNS germ cell tumors. Pediatr Blood Cancer. 2011;57(3):486-91.
[PMID: 21548009] |
| 14) |
Sano K, Matsutani M. Pinealoma (germinoma) trated by direct surgery and postoperative irradiation: a long-term follow-up. Childs Brain. 1981;8(2):81-97.
[PMID: 7249817] |
| 15) |
Goldenberg-Cohen N, Haber J, Ron Y, et al. Long-term ophthalmological follow-up of children with Parinaud syndrome. Ophthalmic Surg Lasers Imaging. 2010;41(4):467-71.
[PMID: 20438046] |
| 16) |
Sklar CA, Antal Z, Chemaitilly W, et al. Hypothalamic–Pituitary and Growth Disorders in Survivors of Childhood Cancer: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2018;103(8): 2761-84.
[PMID: 29982476] |
| 17) |
Armstrong GT, Reddick WE, Petersen RC, et al. Evaluation of memory impairment in aging adult survivors of childhood acute lymphoblastic leukemia treated with cranial radiotherapy. J Natl Cancer Inst. 2013;105(12):899-907.
[PMID: 23584394] |
| 18) |
Clanton NR, Klosky JL, Li C, et al. Fatigue, vitality, sleep, and neurocognitive functioning in adult survivors of childhood cancer: a report from the Childhood Cancer Survivor Study. Cancer. 2011;117(11):2559-68.
[PMID: 21484777] |
| 19) |
Krull KR, Zhang N, Santucci A, et al. Long-term decline in intelligence among adult survivors of childhood acute lymphoblastic leukemia treated with cranial radiation. Blood. 2013;122(4):550-3.
[PMID: 23744583] |
| 20) |
Brinkman TM, Krasin MJ, Liu W, et al. Long-term neurocognitive functioning and social attainment in adult survivors of pediatric CNS tumors: results from the St Jude Lifetime Cohort Study. J Clin Oncol. 2016;34(12):1358-67.
[PMID: 26834063] |
| 21) |
Ris MD, Packer R, Goldwein J, et al. Intellectual outcome after reduced-dose radiation therapy plus adjuvant chemotherapy for medulloblastoma: a Children’s Cancer Group study. J Clin Oncol. 2001;19(15): 3470-6.
[PMID: 11481352] |
| 22) |
Mulhern RK, Kepner JL, Thomas PR, et al. Neuropsychologic functioning of survivors of childhood medulloblastoma randomized to receive conventional of reduced-dose craniospinal irradiation: a Pediatric Oncology Group study. J Clin Oncol. 1998;16(5): 1723-8.
[PMID: 9586884] |
| 23) |
Krull KR, Brinkman TM, Li C, et al. Neurocognitive outcomes decades after treatment for childhood acute lymphoblastic leukemia: a report from the St Jude Lifetime Cohort Study. J Clin Oncol. 2013;31(35): 4407-15.
[PMID: 24190124] |
| 24) |
O'Neil S, Ji L, Buranahirun C, et al. Neurocognitive outcomes in pediatric and adolescent patients with central nervous system germinoma treated with a strategy of chemotherapy followed by reduced-dose and volume irradiation. Pediatr Blood Cancer. 2011;57(4): 669-73.
[PMID: 21495164] |
| 25) |
Sands SA, Kellie SJ, Davidow AL, et al. Long-term quality of life and neuropsychologic functioning for patients with CNS germ-cell tumors: from the First International CNS Germ-Cell Tumor Study. Neuro Oncol. 2001;3(3): 174-83.
[PMID: 11465398] |
| 26) |
Park Y, Yu ES, Ha B, et al. Neurocognitive and Psychological Functioning of Children with an Intracranial Germ Cell Tumor. Cancer Res Treat. 2017;49(4): 960-9.
[PMID: 28052648] |
| 27) |
Sønderkær S, Schmiegelow M, Carstensen H, et al. Long-term neurological outcome of childhood brain tumors treated by surgery only. J Clin Oncol. 2003;21(7):1347-51.
[PMID: 12663725] |
| 28) |
Children’s Oncology Group. Long-Term Follow-Up Guidelines for Survivors of Childhood, Adolescent, and Young Adult Cancers, Version 5.0-October 2018 http://www.survivorshipguidelines.org/pdf/2018/COG_LTFU_Guidelines_v5.pdf
|
| 29) |
Cheung V, Segal D, Gardner SL, et al. Utility of MRI versus tumor markers for post-treatment surveillance of marker-positive CNS germ cell tumors.J Neurooncol. 2016;129(3):541-4.
[PMID: 27406584] |
|
|

|
| |
|
<課題6のシステマティックレビュー結果>
|
| |
|
このクリニカルクエスチョンに応えるため、中枢神経原発胚細胞腫の長期予後について下記検索式による検索を2016年12月に行った。
|
| |
|
| # |
検索式 |
文献数 |
| #1 |
intracranial AND central nervous system germinoma AND follow-up studies |
43
|
| #2 |
intracranial AND central nervous system germ cell tumor AND follow-up studies |
314
|
| #3 |
intracranial AND central nervous system germinoma AND follow-up |
72
|
| #4 |
intracranial AND central nervous system germ cell tumor AND follow-up |
7
|
|
| |
|
以上の検索式より、以上の一次スクリーニングとして295の文献を抽出し、32の文献のエビデンス総体を作成した。それらの構造化抄録をもとに、推奨と解説文を作成したが、その後にもいくつかの文献を加える必要があり、随時訂正し、最終的に、CQ10では解説文を2つに分け、解説1では3文献、解説2では29文献を抽出するに至った。
|

|
| 目次へ戻る!
|

|
|

|
| |

|
|

|
|
|

|
|

