 |

|

|
| 視神経視床下部神経膠腫(optic pathway/hypothalamic glioma:OPHG)ガイドライン 第1版
|

|
| 目 次:各メニューをクリックすると該当項目にリンクします。
|

|
| |
|
| |
|

|
| (Ⅰ)ガイドラインサマリー
|

|
| |
| |
<課題1:診断>
|
| |
CQ1 |
: |
臨床経過、臨床所見、画像検査からOPHGと診断することは推奨されるか。
|
| |
推奨 |
: |
臨床経過、臨床所見、画像所見がOPHGに典型的な臨床的特徴を呈する場合はOPHGと診断し治療方針を決定することを提案する。非典型的な臨床的特徴を呈する場合は病理組織診断を行うことを推奨する。(推奨度1C)
|

|
| |
<課題2:遺伝的背景>
|
| |
CQ2 |
: |
遺伝学的背景の探索は必要か。
|
| |
推奨 |
: |
視神経視床下部神経膠腫(OPHG)は神経線維腫症I型(NF1)との合併がしばしば報告されておりNF1遺伝子異常の探索は二次的な中枢神経系腫瘍の発生等を留意することにおいて意義はあるが、推奨・提案するレベルではない。(推奨度2D)
|

|
| |
<課題3:外科的治療>
|
| |
CQ3 |
: |
外科的治療の意義はあるか。
|
| |
推奨 |
: |
絶対的に推奨される外科治療介入時期はなく、症例毎に患者年齢、視機能、水頭症の有無、NF1合併の有無などを考慮し、小児科・眼科・腫瘍内科・放射線治療科・放射線診断科・脳神経外科等から成り立つ集学的治療チームによって検討することを推奨する。(推奨度1C)
|
| |
CQ4 |
: |
腫瘍切除率は予後に影響するか。
|
| |
推奨 |
: |
可及的摘出によって治療成績が上がるというエビデンスはなく、手術操作に伴った合併症も無視できず、摘出率を追求するような摘出を行わないことを推奨する。(推奨度1D)
|
| |
CQ5 |
: |
再発時摘出の意義はあるのか。
|
| |
推奨 |
: |
QOLの維持を念頭に置いて腫瘍容積減量によって神経症状が改善することが期待できる場合に部分摘出を行うこと提案する。(推奨度2D)
|

|
| |
<課題4:薬物治療>
|
| |
CQ6 |
: |
初期治療として化学療法は有効か。
|
| |
推奨 |
: |
初期治療としての化学療法(維持療法を含む)は、腫瘍の縮小や進行の抑制を期待できるため、行うことを推奨する。(推奨度1B)
|
| |
CQ7 |
: |
再発時の化学療法は生命予後を改善するか。
|
| |
推奨 |
: |
再発時の化学療法は腫瘍の進行を抑制し、生命予後の改善をもたらす可能性があるため行うことを推奨する。(推奨度1C)
|

|
| |
<課題5:放射線療法>
|
| |
CQ8 |
: |
放射線治療は有効か。
|
| |
推奨 |
: |
手術及び化学療法が優先されるが、限られた場合*に放射線療法が行われることを提案する。(推奨度2C)
|
| |
|
|
* |
限られた場合とは、放射線療法の局所制御のメリットから、化学療法が不応であり、腫瘍の増大部位や大きさ、速度によって、手術による減圧が不能であったり、視機能温存が不能であったりする場合など、を想定している。また有害事象としての血管障害発生の頻度が10歳以上の照射では減少するため、この年齢以上では根治的な放射線療法も提案されうる。
|
|

|
| 目次へ戻る!
|

|
| (Ⅱ)OPHGの診療アルゴリズム
|

|
| |
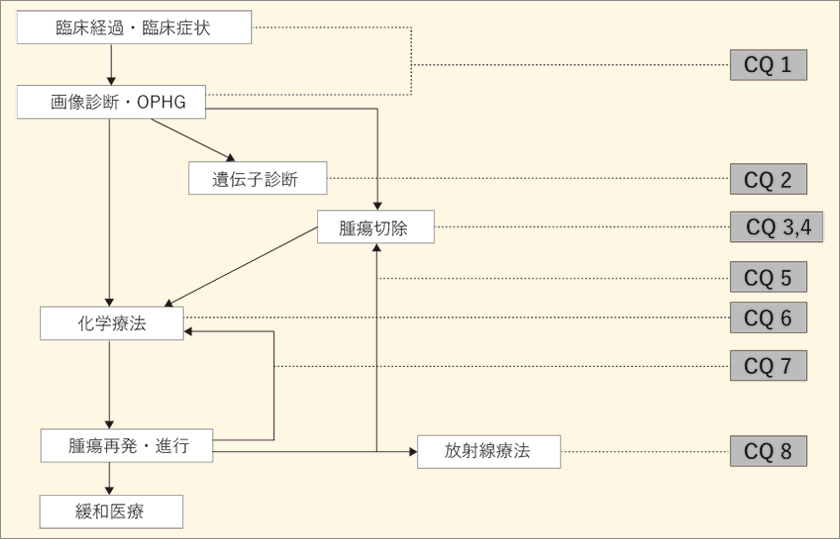
|
| 目次へ戻る!
|

|
| (Ⅲ)略語一覧
|

|
| |
| 略語名 |
正式名称 |
和語 |
| OPHG |
optic pathway/hypothalamic glioma |
視神経視床下部神経膠腫 |
| NF1 |
neurofibromatosis type 1 |
神経線維腫症1型 |
| AYA |
adolescent and young adult |
思春期・若年成人 |
| QOL |
quality of life |
クオリティオブライフ,生活の質 |
| OS |
overall survival |
全生存期間 |
| PFS |
progression-free survival |
無増悪生存期間 |
|

|
| 目次へ戻る!
|

|
| (Ⅳ)作成組織・作成方針
|

|
| 1. 作成組織
|

|
| |
1.1. 作成主体
|

|
| |
|
共通目次と共通項目参照
|

|
| |
1.2. 診療ガイドライン作成グループ
|

|
| |
視神経視床下部神経膠腫 (optic pathway/hypothalamic glioma; OPHG) 診療ガイドライン作成グループ
|
| |
|
| 代表 |
氏 名 |
所属機関/専門分野 |
作成上の役割 |
| ○ |
廣瀬 雄一 |
藤田医科大学医学部 脳神経外科/脳神経外科 |
OPHGガイドライン作成ワーキンググループ
委員長 統括
|
| |
西川 亮 |
埼玉医科大学国際医療センター脳脊髄腫瘍科/脳神経外科 |
OPHGガイドライン作成ワーキンググループ
副委員長 |
| |
竹島 秀雄 |
宮崎大学医学部 脳神経外科/脳神経外科 |
診断に関するCQ |
| |
坂本 博昭 |
大阪市立総合医療センター小児脳神経外科/脳神経外科 |
診断・外科的治療に関するCQ
|
| |
中村 英夫 |
久留米大学医学部 脳神経外科/脳神経外科 |
遺伝子検査に関するCQ |
| |
隈部 俊宏 |
北里大学医学部 脳神経外科/脳神経外科 |
外科的治療に関するCQ |
| |
唐澤 克之 |
都立駒込病院 放射線診療科/放射線科 |
放射線治療に関するCQ |
| |
中田 光俊 |
金沢大学医薬保健研究域医学系 脳・脊髄機能制御学/脳神経外科 |
薬物療法に関するCQ |
| |
原 純一 |
大阪市立総合医療センター 小児血液腫瘍科/小児科 |
薬物療法に関するCQ |
| |
杉山 一彦 |
広島大学病院 がん化学療法科/脳神経外科 |
他のガイドラインとの整合性 |
|

|
| |
1.3. システマティックレビューチーム(SR チーム)
|

|
| |
|
| 代表 |
氏 名 |
所属機関/専門分野 |
作成上の役割 |
| ○ |
坂本 博昭 |
大阪市立総合医療センター 小児脳神経外科/脳神経外科 |
診断
|
| |
竹島 秀雄 |
宮崎大学医学部 脳神経外科/脳神経外科 |
診断 |
| |
渡邉 孝 |
宮崎大学医学部脳 神経外科/脳神経外科 |
診断 |
| |
宇田 武弘 |
大阪市立大学医学部 脳神経外科/脳神経外科 |
診断 |
| ○ |
中村 英夫 |
久留米大学医学部 脳神経外科/脳神経外科 |
OPHGの分子生物学的特徴 |
| |
牧野 敬史 |
熊本市立熊本市民病院 脳神経外科/脳神経外科 |
OPHGの分子生物学的特徴 |
| ○ |
隈部 俊宏 |
北里大学医学部 脳神経外科/脳神経外科 |
外科的治療 |
| |
坂本 博昭 |
大阪市立総合医療センター 小児脳神経外科/脳神経外科 |
外科的治療 |
| |
齋藤 竜太 |
名古屋大学 脳神経外科/脳神経外科 |
外科的治療 |
| |
石橋 謙一 |
大阪市立総合医療センター 脳神経外科/脳神経外科 |
外科的治療 |
| ○ |
唐澤 克之 |
都立駒込病院 放射線診療科/放射線科 |
放射線治療 |
| |
藤井 元彰 |
三井記念病院 放射線治療科/放射線科 |
放射線治療 |
| ○ |
中田 光俊 |
金沢大学医薬保健研究域医学系 脳・脊髄機能制御学/脳神経外科 |
薬物療法 |
| |
原 純一 |
大阪市立総合医療センター 小児血液腫瘍科/小児科 |
薬物療法 |
| |
笹川 泰生 |
金沢大学医薬保健研究域医学系 脳・脊髄機能制御学/脳神経外科 |
薬物療法 |
| |
多賀 祟 |
滋賀医科大学 小児科/小児科 |
薬物療法 |
| |
清谷 知賀子 |
成育医療研究センター 脳神経腫瘍科/小児科 |
薬物療法 |
|

|
| 目次へ戻る!
|

|
| 2. 作成過程
|

|
| |
2.1. 作成方針
|

|
| |
|
視神経視床下部神経膠腫(optic pathway/hypothalamic glioma:OPHG)に対するエビデンスを整理し,診療アルゴリズムと診療ガイドラインを示すことによって,OPHG患者の生命予後と機能予後の改善を目的とする。
|

|
| |
2.2. 使用上の注意
|

|
| |
|
共通目次と共通項目参照
|

|
| |
2.3. 利益相反
|

|
| |
|
共通目次と共通項目参照
|

|
| |
2.4. 作成資金
|

|
| |
|
共通目次と共通項目参照
|

|
| |
2.5. 組織編成
|

|
| |
|
ガイドライン統括委員会: ガイドライン作成を統括する脳腫瘍診療拡大ガイドライン委員会は,2009年11月に日本脳腫瘍学会の内部組織として設置され,当時の理事と協力委員2名で構成された。その後,日本脳腫瘍学会の新理事が委員として加わった。また,対象疾患ごとに関連学会から協力委員の参加を得ている。
ガイドライン作成グループ: 脳腫瘍診療拡大ガイドライン委員会から選出された6名に加えて,新たに関連学会からの協力委員2名に参加いただいた。
システマティックレビューチーム: 重要臨床課題ごとにSRチームを2~4名で編成した。OPHGが希少疾患であることをふまえて,各チームひとりずつガイドライン委員が兼任することとした。
|

|
| |
2.6. 作成過程
|

|
| |
|
準備: 2014年11月30日の脳腫瘍診療拡大ガイドライン委員会で,OPHGのガイドライン作成グループが発足。若干の課題については委員の追加を行った。
スコープ:ドラフトを作成し,メール回覧のうえ,メール討議を行い,改変を繰り返して完成し、委員全体にメールで回覧し意見を募った。
システマティックレビュー:2015年10月に開始。Minds「診療ガイドライン作成マニュアル 2014」に準拠した方法により行なったが、OPHGが希少疾患であるためエビデンスが少なく,上記の方法の適用が困難な場面に遭遇した。
推奨作成とその決定:臨床課題(CQ)ごとに担当委員が草案を作成し,本ガイドライン作成グループが各CQに対する推奨内容について討議した上で、決定のための郵送による投票を行った。最終的に2020年8月3日の脳腫瘍診療拡大ガイドライン委員会にて参加委員全員の投票により決定した。
その他、小児脳腫瘍編 各ガイドラインの共通項目にも追加記載あり。
最終化:共通目次と共通項目参照
公開:共通目次と共通項目参照
公開後の取り組み:共通目次と共通項目参照
|

|
| |
2.7. 推奨の強さの提示方法・エビデンスレベル・推奨度(臨床的意義)について
|

|
| |
|
共通目次と共通項目参照
|

|
| |
2.8.外部評価を求めた団体・委員
|

|
| |
|
共通目次と共通項目参照
|

|
| 3.公開後の取り組み
|

|
| |
|
共通目次と共通項目参照
|

|
| 4.脳腫瘍ガイドライン拡大委員会(ガイドライン統括委員会)組織構成
|

|
| |
|
共通目次と共通項目参照
|

|
| 5.日本脳腫瘍学会 脳腫瘍診療ガイドライン作成事務局
|

|
| |
|
共通目次と共通項目参照
|

|
| 目次へ戻る!
|

|
| (Ⅴ)スコープ
|

|
| 1. 視神経視床下部神経膠腫(optic pathway/hypothalamic glioma:OPHG)の基本的特徴
|

|
| |
1.1. 臨床的特徴
|

|
| |
|
視神経・視交叉から視床下部に発生する浸潤性の脳実質内腫瘍で、小児脳腫瘍の2~5%を占める。過半数が5歳以下に発生し、10歳までの例は毛様細胞性星細胞腫が多い。神経線維腫症Ⅰ型(NF1)に伴って生じるものもあり、その場合は視交叉より後方には発生しにくく、比較的良好な予後をたどるなど、NF1の合併例と非合併例との間には臨床像や予後に差異があることも報告されている。ただし、乳幼児期の孤発例ではNF1の臨床的診断基準を満たさないながらNF1に伴って生じた腫瘍と同様に良好な予後を示すことがある1-4)。
神経症状や所見としては、視力低下や失明、視野欠損など視機能障害で発症することが多いが、年少時では視機能障害の発見は遅れる。水平性の振子様眼振(pendular nystagmus)はこの腫瘍でみられる特徴的な眼振である。NF1の例では一側眼窩内の視神経腫瘍によって患側の視機能障害や眼球突出を来すことがある。内分泌学的異常では低身長など下垂体前葉ホルモンの障害が多いが、尿崩症も発生する。また、視床下部障害により思春期早発、過度の肥満が発生することがあり、乳幼児期にるいそうを呈する間脳症候群 (diencephalic syndrome)はこの腫瘍に特徴的である。発達遅滞やけいれんを呈することもある。腫瘍によって非交通性の水頭症を合併すれば、頭蓋内圧亢進の症状や所見を呈し、進行すれば意識障害をきたす。
典型例では上記のような神経徴候を含めた臨床所見と画像検査(MRI)で診断しうるが、非典型例では組織診断を要することもある。視機能障害の評価が困難な乳幼児の例、あるいはNF1の例でOPHGのスクリーニング検査では、MRIにより診断や腫瘍増大の有無が評価できる。腫瘍の局在はMRIを用いて分類され5)、視覚路にあたる視神経(一側あるいは両側)、視神経交叉、視索、外側膝状体、視放線に腫瘤を形成し、視覚路に沿って、あるいはその周囲の脳実質内に伸展する。腫瘍はT1強調画像で等信号、T2強調画像で等信号から高信号を呈し、びまん性で不均一な造影効果を受けやすく、著明な増強効果を受けることも少なくない。水頭症は15~30%に合併する。嚢胞の合併、視床下部や第三脳室への伸展、あるいはトルコ鞍上部で脳実質内からくも膜下腔へのexophyticな進展があってもよい。石灰化の所見はまれである。
OPHGの名称は組織型による分類ではなく、腫瘍の発生部位と画像所見に基づくものである。すなわち典型例では神経徴候を含めた臨床学的所見と画像検査で診断された腫瘍の総称であり、単一の組織診断が下されるとは限らないのが実情である。組織診断された場合にはWHO grade Iの毛様細胞性星細胞腫であることが多いが、Grade II以上の悪性度を持つ神経膠腫や神経膠腫以外の腫瘍もこの部位には発生する。
|
| |
|
|
| 参考:日本皮膚科学会【神経線維腫症1型(レックリングハウゼン病)の診断基準2018
|
(概念)
カフェ・オ・レ班、神経繊維腫を主徴とし、皮膚、神経系、眼、骨などに多種病変が年齢の変化とともに出現し、多彩な症候を呈する全身性母斑症であり、常染色体優性の遺伝性疾患である。
|
(診断基準)
1)遺伝学的診断基準
|
NF1遺伝子の病因となる変異が同定されれば、神経線維腫症1型と診断する。ただし、その判定(特にミスセンス変異)においては専門家の意見を参考にする。
本邦で行われた次世代シーケンサーを用いた変異の同定率は90%以上と報告されているが、遺伝子検査で変異が同定されなくとも神経線維腫病1型を否定するわけではなく、その診断に臨床的診断基準を用いることに何ら影響を及ぼさないことに留意する。
(2018年1月現在保険適用外)
|
|
2)臨床的診断基準
|
| |
1. |
6個以上のカフェ・オ・レ班*1 |
| |
2. |
2個以上の神経線維腫(皮膚の神経繊維腫や神経の神経繊維腫など)またはびまん性神経繊維腫*2 |
| |
3. |
腋窩あるいは鼠径部の雀卵斑様色素斑(freckling) |
| |
4. |
視神経膠腫(optic glioma) |
| |
5. |
2個以上の虹彩小結節(Lisch nodule) |
| |
6. |
特徴的な骨病変の存在(脊柱・胸郭の変形, 四肢骨の変形, 頭蓋骨・顔面骨の骨欠損) |
| |
7. |
家系内(第一度近親者)に同症 |
| |
7項目中2項目以上で神経線維腫症1型と診断する。 |
| |
<その他の参考所見> |
| |
1. |
大型の褐色斑 |
| |
2. |
有毛性褐青色斑 |
| |
3. |
若年性黄色肉芽腫 |
| |
4. |
貧血母斑 |
| |
5. |
脳脊髄腫瘍 |
| |
6. |
Unidentified bright object(UBO) |
| |
7. |
消化管間質腫瘍(Gastrointestinal stromal tumor, GIST) |
| |
8. |
褐色細胞腫 |
| |
9. |
悪性末梢神経鞘腫瘍 |
| |
10. |
限局性学習症(学習障害)・注意欠如多動症・自閉スペクトラム症 |
|
| (診断のポイント)
|
| *1:
|
多くは出生時からみられる扁平で盛り上がりのない斑であり, 色は淡いミルクコーヒー色から濃い褐色に至るまで様々で色素斑内に色の濃淡はみられない。通常大きさは1~5 cm程度で形は長円形のものが多く, 丸みを帯びた滑らかな輪郭を呈する(小児では大きさが0.5 cm以上あればよい)。
|
| *2:
|
皮膚の神経線維腫は常色あるいは淡紅色の弾性軟の腫瘍であり, 思春期頃より全身に多発する。圧痛, 放散痛を伴う神経の神経線維腫やびまん性に隆起した神経線維腫がみられることもある。
|
| (診断する上での注意点)
|
| |
1. |
患者の半数以上は孤発例で両親ともに健常のことも多い。 |
| |
2. |
幼少時期にはカフェ・オ・レ斑以外の症候はみられないことも多いため, 疑い例では時期をおいて再度診断基準を満たしているかどうかの確認が必要である。 |
| |
3. |
個々の患者にすべての症候がみられるわけではなく、症候によって出現する時期も異なるため, 本邦での神経線維腫症1型患者にみられる症候のおおよその合併率と初発年齢(表1)を参考にして診断を行う。 |
|
|

|
| |
1.2. 疫学的特徴
|

|
| |
|
比較的多数の症例を含む臨床研究において腫瘍発生に関する性差は示されていないが、カナダのHospital for Sick Children in Torontoからの報告6)ではNF1合併例では男児の発生が多かったとされている。また同研究の中でNF1合併例でのOPHG診断年齢は5.05歳であったのに対してNF1非合併例でのOPHG診断年齢は7.09歳であり、統計的に有意な差であったことも報告されているが、NF1合併例では早期にスクリーニング検査が行われた可能性もあることには注意を要する。NF1(出生約3,000人に1人の割合で生じる)全体の中でOPHGが発生する割合は報告によって異なるが、MRIでスクリーニングを行なった複数の研究結果を合わせると、その10~15%にOPHGが発生すると考えられる。
Brain Tumor Registry of Japan(2017)7)によれば、視床下部腫瘍の10%、視神経腫瘍の37%が毛様細胞性星細胞腫であったと報告されており、神経上皮由来腫瘍では毛様細胞性星細胞腫が最も多い。ただし、全年齢での脳実質内腫瘍という点では視床下部では中枢神経系原発悪性リンパ腫が最も多く(16%)、毛様細胞性星細胞腫はこれに次ぐ。なお、毛様細胞性星細胞腫は7.2%が視神経、5%が視床下部、42.3%が小脳に発生したと報告されている。本疾患は必ずしも外科的手術の絶対的な対象とされなかったことが影響し腫瘍組織型が確認されていない症例が数多く含まれるため、組織型の正確な情報を得ることは難しい。
|

|
| |
1.3. 診療の全体的な流れ
|

|
| |
|
一般的に脳腫瘍の診断では画像所見と病理診断から診断を確定することが望ましい。しかし、OPHGでは非症候性もしくは症状が軽微な場合には経過観察も一つの選択肢であり、画像所見のみによる診断も許容され、生検も含めた外科的腫瘍切除は必要とされないこともある。視機能障害や水頭症など腫瘍による圧排に基づく症状が進行性である場合や、画像検査で明らかな病変拡大が認められる場合は、局所病変を制御するために腫瘍切除が行われることがある。前述の通り本疾患は毛様細胞性星細胞腫であることが最も多いが、より悪性度が高い腫瘍である可能性が否定できないことは念頭におく必要がある。OPHGは小脳に発生する毛様細胞性星細胞腫とは腫瘍生物学的に異なる可能性があり、この点は腫瘍の組織学的評価に遺伝子診断まで加えるべきかという議論にも関連する。放射線治療は、腫瘍制御の観点からは治療効果が高いことが確認されているが、視床下部機能障害、二次的悪性腫瘍、脳血管障害、高次機能障害などの発現の危険があり、これらの晩期合併症は一旦発生すれば重篤であるため、長期生存が期待できる症例では薬物療法が優先される。放射線治療後の二次がんの発生率はNF1に合併するOPHGでは非合併例よりも高い(CQ8解説参照)。放射線治療は腫瘍の局在と大きさなどのために手術困難な場合や、薬物療法に対する治療反応性が低い場合に行われることが多い。薬物療法の主体は化学療法であるが、今後分子標的薬の導入も見込まれている。
|

|

|
| |
|
| |
参考文献
|
| |
|
| 1) |
Deliganis AV, Geyer JR, Berger MS. Prognostic significance of type 1 neurofibromatosis (von Recklinghausen Disease) in childhood optic glioma. Neurosurgery. 1996;38(6):1114-9.
[PMID: 8727140] |
| 2) |
Laithier V, Grill J, Le Deley MC, et al; French Society of Pediatric Oncology. Progression-free survival in children with optic pathway tumors: dependence on age and the quality of the response to chemotherapy--results of the first French prospective study for the French Society of Pediatric Oncology. J Clin Oncol. 2003;21(24):4572-8.
[PMID: 14673044] |
| 3) |
Nicolin G, Parkin P, Donald Mabbott D, et al. Natural history and outcome of optic pathway gliomas in children. Pediatr Blood Cancer. 2009;53(7):1231-7.
[PMID: 19621457] |
| 4) |
Stokland T, Liu JF, Ironside JW, et al. A multivariate analysis of factors determining tumor progression in childhood low-grade glioma: a population-based cohort study (CCLG CNS9702). Neuro Oncol. 2010;12(12):1257-68.
[PMID: 20861086] |
| 5) |
Taylor T, Jaspan T, Milano G, et al; PLAN Study Group. Radiological classification of optic pathway gliomas: experience of a modified functional classification system. Br J Radiol. 2008;81(970):761-6.
[PMID: 18796556] |
| 6) |
Lassaletta A, Scheinemann K, Zelcer SM, et al. Phase II weekly vinblastine for chemotherapy-naïve children with progressive low-grade glioma: A Canadian Pediatric Brain Tumor Consortium Study. J Clin Oncol. 2016; 34(29): 3537-43.
[PMID: 27573663] |
| 7) |
The Committee of Brain Tumor Registry of Japan. Report of Brain Tumor Registry of Japan (2005-2008), 14th edition. Neurol Med Chir (Tokyo). 2017; 57 (Suppl 1): 9-102. |
|
|

|
| 目次へ戻る!
|

|
| 2. スコープ作成
|

|
| |
2.1. 診療ガイドラインがカバーする内容に関する事項
|

|
| |
| (1) |
タイトル:OPHGの診療ガイドライン |
| (2) |
目的:生命予後、機能予後の改善 |
| (3) |
トピック:OPHGの生命予後、機能予後の改善 |
| (4) |
想定される利用者、利用施設:小児脳腫瘍を診療する医療者や施設、患者・家族、ケアギバー(caregiver) |
| (5) |
既存ガイドラインとの関係:日本・海外とも既存のガイドラインは作成されていない |
| (6) |
最重要課題
課題1:診断方法の確立
課題2:外科的治療の意義
課題3:薬物治療の意義
課題4:放射線治療の意義
|
| (7) |
ガイドラインがカバーする範囲
初発治療時が小児がんとしてみなされる年齢(15歳未満)の小児例に加え15~29歳のAYA(adolescent and young adult)世代
|
| (8) |
CQリスト
|
| |
| 課題1:診断法の確立に対するCQ |
| |
CQ1 |
臨床経過、臨床所見、画像検査からOPHGと診断することは推奨されるか
|
| |
CQ2 |
遺伝学的背景の探索は必要か
|
| 課題2:外科的治療の意義に対するCQ |
| |
CQ3 |
外科的治療の意義はあるか
|
| |
CQ4 |
腫瘍切除率は予後に影響するか
|
| |
CQ5 |
再発時摘出の意義はあるのか
|
| 課題3:薬物治療の意義に対するCQ |
| |
CQ6 |
初期治療として化学療法は有効か
|
| |
CQ7 |
再発時の化学療法は生命予後を改善するか
|
| 課題4:放射線治療の意義に対するCQ |
| |
CQ8 |
放射線治療は有効か
|
|
|

|
| |
2.2. ステマティックレビューに関する事項
|

|
| |
| (1) |
実施スケジュール
文献検索:1カ月
文献の選出:3カ月
エビデンス総体の評価と統合:4カ月
|
| (2) |
エビデンスの検索
|
| |
① |
エビデンスタイプ
|
| |
|
・ |
既存のガイドライン:OPHGに関してはなし
|
| |
|
・ |
個別研究論文:ランダム化比較試験はなく、非ランダム化比較試験、観察研究のみならず症例報告も検索対象にする。
|
| |
② |
データベース
|
| |
|
・ |
個別研究論文:主にPubMed、医中誌
|
| |
③ |
検索方法
|
| |
|
・ |
介入の検索に関してはPICOフォーマットを用いる。
|
| |
④ |
検索対象期間
|
| |
|
・ |
すべてのデータベースで2019年6月まで
|
| (3) |
文献の選択基準,除外項目
採択条件を満たす観察研究がない場合、システマティックレビューは実施しない。
|
| (4) |
エビデンスの評価と統合の方法
エビデンス総体の強さの評価は「Minds作成手引き2014」の方法に基づく。
エビデンス総体の統合は質的な統合を基本とし、適切な場合は量的統合を実施。
|
|

|
| 目次へ戻る!
|

|
| (Ⅵ)推奨
|

|
| 課題1:診断
|

|
| |
CQ1 臨床経過、臨床所見、画像検査からOPHGと診断することは推奨されるか
|

|
| |
推奨
臨床経過、臨床所見、画像所見がOPHGに典型的な臨床的特徴を呈する場合はOPHGと診断し治療方針を決定することを提案する。非典型的な臨床的特徴を呈する場合は病理組織診断を行うことを推奨する。(推奨度1C)
|
|

|
| |
解説
|
| |
1.CQの設定
|
| |
|
一般的に組織診断をもって最終診断とする脳腫瘍診療の中で、OPHGは他の腫瘍と異なり組織診断名ではなく特徴的な発生部位や臨床症状を呈する疾患群の呼称である。組織学的には高分化型星細胞腫である毛様細胞性星細胞腫(WHO grade I)がOPHGの主体を占めるが、より悪性度の高い腫瘍の場合があるため、臨床診断されたOPHGの治療方針は一様であるとは言えない。OPHGでは組織学的悪性度と予後は有意に関連しているため、適切な治療を行うための診断法の妥当性、とくに組織診断の必要性について検証を行う。また、OPHGはNF1合併の有無によって臨床像や予後が異なるため、NF1遺伝子異常の探索の必要性について検証する。
アウトカム:QOLの維持、生存期間の延長、入院期間の延長、外科的手技による侵襲
|

|
| |
2.推奨の解説
|
| |
|
(1)NF1合併例
1990年代前半までは、NF1合併例において視覚路に発生しOPHGと臨床診断された腫瘍では、摘出(生検)を行なって組織診断が施行されることが多かった1, 2)。白金製剤を中心とした化学療法が低悪性度神経膠腫に有効であるとPackerらが1997年に報告した後、外科的摘出を治療の第1選択としない報告が増えていった。1990年後半からは、NF1に合併するOPHGとして典型的な臨床経過、臨床所見、画像所見を呈していれば、組織診断なしで毛様細胞性星細胞腫として治療方針が決定されている3-13)。
しかし、NF1合併例でもOPHG特に毛様細胞性星細胞腫としては非典型的な症例、即ち10歳以上、視床下部や第3脳室の腫瘍、脳実質外伸展を呈する腫瘍、嚢胞病変を伴う腫瘍の中には、WHO grade II あるいはIIIの神経膠腫、あるいは神経膠腫以外の腫瘍の可能性があるため組織診断が行われる14, 15)。上記の場合に加え、治療を開始してからではあるが、急激な腫瘍の増大や化学療法が有効ではない例も組織診断が必要であるとする報告がある16)。腫瘍摘出(生検)を行うには、腫瘍の摘出に伴う種々の合併症(CQ4の解説文を参照)を考慮する必要がある。
OPHGでは組織学的悪性度と予後は有意に関連している17)ため、腫瘍がWHO grade Iの毛様細胞性星細胞腫として臨床的に典型的ではない点があれば、組織診断が必要と判断するのが妥当である。NF1合併例の推奨文では「臨床経過(発症年齢など)、臨床所見(視覚障害や内分泌障害など)、画像所見(腫瘍の局在や形態など)がOPHGに典型的な所見を呈する例では、毛様細胞性星細胞腫と判断して治療方針を決定してもよいが、非典型的な点があれば組織診断を勧める」と提案する。
(2)NF1非合併例
NF1非合併例においても視覚路に発生した腫瘍がOPHGとして典型的な臨床所見を呈する場合は、腫瘍摘出や生検による組織診断は必ずしも必要ではないとする報告がある18-21)。しかし、NF1非合併例でOPHGと臨床診断された47例中45例で組織診断が行なわれ、40例(症例全体の85%)は毛様細胞性星細胞腫であったが、残り5例(同11%)は他の低悪性度神経膠腫であったとする報告がある22)。このようにNF1合併例よりも非合併例では、臨床的な特徴からOPHGと診断された腫瘍でも毛様細胞性星細胞腫以外の腫瘍である割合が高い傾向にあり、NF1合併例と比較して非合併例では腫瘍の摘出や生検による組織診断を行う傾向にある6, 12, 23-30)。
臨床的にOPHGと診断された例で、診断時の年齢が10歳を越せば組織学的悪性度が有意に高く17)、18歳以上のAYA(adolescents and young adults)世代の例では高悪性度神経膠腫であったとする報告がある17, 31)。OPHGでは、診断時の年齢が10歳未満の例と比較して10歳以上の群で有意に生検率が高く26)、診断時の年齢が10歳以上の例が多く含まれる報告では組織診断が施行される割合が76~100%と高率である25, 32-26)。
腫瘍の局在や形態から述べると、腫瘍が視床下部や第3脳室周囲に存在する例、あるいは脳実質外伸展例に対しては、毛様細胞性星細胞腫以外の神経膠腫や頭蓋咽頭腫の可能性を考慮する必要がある19)。また、囊胞病変を伴う例で手術到達が可能な症例、あるいは減圧が必要な症例では摘出手術により組織診断がなされている14, 37)。腫瘍により水頭症を合併している乳幼児例では、髄液シャント時に神経内視鏡による生検が施行されている20)。これらに加え、急激な腫瘍の増大がみられる場合や、毛様細胞性星細胞腫として予想される治療効果が得られない場合、生検を考慮すべきとする報告もある37)。腫瘍摘出(生検)を行うには、NF1合併例と同様に、腫瘍の摘出に伴う合併症(CQ4の解説文を参照)を考慮する。
以上、NF1非合併例ではOPHGと臨床診断できても、毛様細胞性星細胞腫より高悪性度の神経膠腫であったり、それ以外の腫瘍である可能性がNF1合併例よりも高い傾向にあるため、OPHGとして典型的な臨床所見に欠ける場合はより積極的に組織診断を勧める。
|

|
| |
|
システマティックレビュー結果
<検索式>
|
| |
|
(((((((((((optic nerve) OR optic chiasma) OR optic tract) OR optic pathway) OR hypothalamus)) AND glioma) AND (hasabstract[text] AND English[lang] AND ( (infant[MeSH] OR child[MeSH] OR adolescent[MeSH]) OR young adult[MeSH] ) ))) NOT ((((((((optic nerve) OR optic chiasma) OR optic tract) OR optic pathway) OR hypothalamus)) AND glioma) AND (Case Reports[ptyp] AND hasabstract[text] AND English[lang] AND ( (infant[MeSH] OR child[MeSH] OR adolescent[MeSH]) OR young adult[MeSH] ) )))) AND mri
この検索式で得られた報告の中で、OPHGの診断方法で病理組織診断に対する臨床診断の優位性を統計学的に検討したものはなかった。そのため、症例数の多い報告を採用して二次スクリーニング文献とし、定性的なシステマテックレビューを行なった。
|
|

|
| |
|
| |
<二次スクリーニング文献>
|
| |
|
| 1) |
Cummings TJ, Provenzale JM, Hunter SB, et al. Gliomas of the optic nerve: histological, immunohistochemical (MIB-1 and p53), and MRI analysis. Acta Neuropathol. 2000; 99(5): 563-70.
[PMID: 10805102] |
| 2) |
Hupp M, Falkenstein F, Bison B, et al. Infarction following chiasmatic low grade glioma resection. Child's Nervous System. 2012; 28(3): 391-8.
[PMID: 21987345] |
| 3) |
Astrup J. Natural history and clinical management of optic pathway glioma. Br J Neurosurg. 2003; 17(4): 327-35.
[PMID: 14579898] |
| 4) |
Avery RA, Bouffet E, Packer RJ, et al. Feasibility and comparison of visual acuity testing methods in children with neurofibromatosis type 1 and/or optic pathway gliomas. Invest Ophthalmol Vis Sci. 2013; 54(2): 1034-8.
[PMID: 23329671] |
| 5) |
Fouladi M, Wallace D, Langston JW, et al. Survival and functional outcome of children with hypothalamic/chiasmatic tumors. Cancer. 2003; 97(4): 1084-92.
[PMID: 12569610] |
| 6) |
Hug EB, Muenter MW, Archambeau JO, et al. Conformal proton radiation therapy for pediatric low-grade astrocytomas. Strahlenther Onkol. 2002; 178(1): 10-7.
[PMID: 11977386] |
| 7) |
Lama G, Esposito Salsano M, Grassia C, et al. Neurofibromatosis type 1 and optic pathway glioma. A long-term follow-up. Minerva Pediatrica. 2007; 59(1): 13-21.
[PMID: 17301720] |
| 8) |
Leonard JR, Perry A, Rubin JB, et al. The role of surgical biopsy in the diagnosis of glioma in individuals with neurofibromatosis-1. Neurology. 2006; 67(8): 1509-12.
[PMID: 17060590] |
| 9) |
Mandiwanza T, Kaliaperumal C, Khalil A, et al. Suprasellar pilocytic astrocytoma: one national centre's experience. Childs Nerv Syst. 2014; 30(7): 1243-8.
[PMID: 24566674] |
| 10) |
Nicolin G, Parkin P, Mabbott D, et al. Natural history and outcome of optic pathway gliomas in children. Pediatr Blood Cancer. 2009; 53(7): 1231-7.
[PMID: 19621457]
|
| 11) |
Prada CE, Hufnagel RB, Hummel TR, et al. The Use of Magnetic Resonance Imaging Screening for Optic Pathway Gliomas in Children with Neurofibromatosis Type 1. J Pediatr. 2015; 167(4): 851-6.e1.
[PMID: 26233602]
|
| 12) |
Segal L, Darvish-Zargar M, Dilenge ME, et al. Optic pathway gliomas in patients with neurofibromatosis type 1: follow-up of 44 patients. J AAPOS. 2010; 14(2): 155-8.
[PMID: 20451859]
|
| 13) |
Silva MM, Goldman S, Keating G, et al. Optic pathway hypothalamic gliomas in children under three years of age: the role of chemotherapy. Pediatr Neurosurg. 2000; 33(3): 151-8.
[PMID: 11096362]
|
| 14) |
Dutton JJ. Gliomas of the anterior visual pathway. Surv Ophthalmol. 1994; 38(5): 427-52.
[PMID: 8009427]
|
| 15) |
El Beltagy MA, Reda M, Enayet A, et al. Treatment and Outcome in 65 Children with Optic Pathway Gliomas. World Neurosurg. 2016; 89: 525-34.
[PMID: 26898488]
|
| 16) |
Jaing TH, Lin KL, Tsay PK, et al. Treatment of optic pathway hypothalamic gliomas in childhood: experience with 18 consecutive cases. J Pediatr Hematol Oncol. 2008; 30(3): 222-4.
[PMID: 18376285]
|
| 17) |
Kornreich L, Blaser S, Schwarz M, et al. Optic pathway glioma: correlation of imaging findings with the presence of neurofibromatosis. AJNR. 2001; 22(10): 1963-9.
[PMID: 11733333]
|
| 18) |
Martinez R, Honegger J, Fahlbusch R, Buchfelder M. Endocrine findings in patients with optico-hypothalamic gliomas. Exp Clin Endocrinol Diabetes. 2003; 111(3): 162-7.
[PMID: 12784190]
|
| 19) |
Mishra MV, Andrews DW, Glass J, et al. Characterization and outcomes of optic nerve gliomas: a population-based analysis. J Neurooncol. 2012; 107(3): 591-7.
[PMID: 22237948]
|
| 20) |
Parkhurst E, Abboy S. Optic Gliomas in Neurofibromatosis Type 1. Journal of Pediatric Ophthalmology and Strabismus. 2016; 53(6): 334-8.
[PMID: 27537249]
|
| 21) |
Suarez JC, Viano JC, Zunino S, et al. Management of child optic pathway gliomas: new therapeutical option. Childs Nerv Syst. 2006; 22(7): 679-84.
[PMID: 16389565]
|
| 22) |
Shofty B, Constantini S, Bokstein F, et al. Optic pathway gliomas in adults. Neurosurgery. 2014; 74(3): 273-9; discussion 9-80.
[PMID: 24335817]
|
| 23) |
Alshail E, Rutka JT, Becker LE, Hoffman HJ. Optic chiasmatic-hypothalamic glioma. Brain Pathol. 1997; 7(2): 799-806.
[PMID: 9161730]
|
| 24) |
Avery RA, Hwang EI, Ishikawa H, et al. Handheld optical coherence tomography during sedation in young children with optic pathway gliomas. JAMA Ophthalmol. 2014; 132(3): 265-71.
[PMID: 24435762]
|
| 25) |
Chikai K, Ohnishi A, Kato T, et al. Clinico-pathological features of pilomyxoid astrocytoma of the optic pathway. Acta Neuropathol. 2004; 108(2): 109-14.
[PMID: 15168135]
|
| 26) |
Chong AL, Pole JD, Scheinemann K, et al. Optic pathway gliomas in adolescence--time to challenge treatment choices? Neuro Oncol. 2013; 15(3): 391-400.
[PMID: 23295772]
|
| 27) |
Khafaga Y, Hassounah M, Kandil A, et al. Optic gliomas: a retrospective analysis of 50 cases. Int J Radiat Oncol Biol Phys. 2003; 56(3): 807-12.
[PMID: 12788189]
|
| 28) |
Kuenzle C, Weissert M, Roulet E, et al. Follow-up of optic pathway gliomas in children with neurofibromatosis type 1. Neuropediatrics. 1994; 25(6): 295-300.
[PMID: 7770126]
|
| 29) |
Rakotonjanahary J, De Carli E, Delion M, et al. Mortality in Children with Optic Pathway Glioma Treated with Up-Front BB-SFOP Chemotherapy. PloS One. 2015; 10(6): e0127676.
[PMID: 26098902]
|
| 30) |
Shuper A, Horev G, Kornreich L, et al. Visual pathway glioma: an erratic tumour with therapeutic dilemmas. Arch Dis Child. 1997; 76(3): 259-63.
[PMID: 9135269]
|
| 31) |
Oh KS, Hung J, Robertson PL, et al. Outcomes of multidisciplinary management in pediatric low-grade gliomas. Int J Radiat Oncol Biol Phys. 2011; 81(4): e481-8.
[PMID: 21470783]
|
| 32) |
Ahn Y, Cho BK, Kim SK, et al. Optic pathway glioma: outcome and prognostic factors in a surgical series. Childs Nerv Syst. 2006; 22(9): 1136-42.
[PMID: 16628460]
|
| 33) |
Campagna M, Opocher E, Viscardi E, et al. Optic pathway glioma: long-term visual outcome in children without neurofibromatosis type-1. Pediatr Blood Cancer. 2010; 55(6): 1083-8.
[PMID: 20979170]
|
| 34) |
Garvey M, Packer RJ. An integrated approach to the treatment of chiasmatic-hypothalamic gliomas. J Neurooncol. 1996; 28(2-3): 167-83.
[PMID: 8832460]
|
| 35) |
Goodden J, Pizer B, Pettorini B, et al. The role of surgery in optic pathway/hypothalamic gliomas in children. J Neurosurg Pediatr. 2014; 13(1): 1-12.
[PMID: 24138145]
|
| 36) |
Gutmann DH, James CD, Poyhonen M, et al. Molecular analysis of astrocytomas presenting after age 10 in individuals with NF1. Neurology. 2003; 61(10): 1397-400.
[PMID: 14638962]
|
| 37) |
Sawamura Y, Kamada K, Kamoshima Y, et al. Role of surgery for optic pathway/hypothalamic astrocytomas in children. Neuro Oncol. 2008; 10(5): 725-33.
[PMID: 18612049]
|
|
|

|
| 目次へ戻る!
|

|
| 課題2:遺伝的背景
|

|
| |
CQ2 遺伝学的背景の探索は必要か
|

|
| |
推奨
NF1遺伝子異常の探索は二次的な中枢神経系腫瘍の発生等を留意することにおいて意義はあるが推奨するレベルではない。(推奨度2D)
|
|

|
| |
解説
|

|
| |
|
1. CQの設定
一般的に組織診断をもって最終診断とする脳腫瘍診療の中で、OPHGは他の腫瘍と異なり組織診断名ではなく特徴的な発生部位や臨床症状を呈する疾患群の呼称である。組織学的には高分化型星細胞腫である毛様細胞性星細胞腫(WHO grade I)がOPHGの主体を占めるが、より悪性度の高い腫瘍の場合があるため、臨床診断されたOPHGの治療方針は一様であるとは言えない。OPHGでは組織学的悪性度と予後は有意に関連しているため、適切な治療を行うための診断法の妥当性、とくに組織診断の必要性について検証を行う。また、OPHGはNF1合併の有無によって臨床像や予後が異なるため、NF1遺伝子異常の探索の必要性について検証する。
アウトカム:QOLの維持、生存期間の延長、入院期間の延長、外科的手技による侵襲
|

|
| |
|
2.推奨の解説
OPHGはしばしばNF1患者に発生する。NF1の患者で経過観察中にOPHGが発生する場合もあるが、脳腫瘍の方が先に発症し診断され、しかし実はNF1合併例であるというOPHGの患者も存在する。しかし視力障害発症例はNF1合併例よりも非合併例に多いと報告されている1)。OPHG患者のNF1遺伝子異常の検出はNF1の臨床症状が不確実であった場合に有用であるが、巨大なNF1遺伝子の解析の困難さを考えると必ずしも必須ではないと思われる。NF1患者の中で、視神経膠腫を持つ症例では、NF1遺伝子の5'端領域に遺伝子変異が集中するという報告もあれば2)、関係ないという報告もある3)。皮膚症状などの臨床診断基準を満たせば、ある程度NF1合併例かどうか予測できる。非NF1とNF1関連視神経膠腫では、発生部位に違いがあり、非NF1では視索に多いことで水頭症の併発が多いという報告もある1)NF1以外の遺伝子異常に関しては症例報告がいくつかあるが4-8)、確立された事象ではない。OPHGにおいてNF1患者と非NF1患者での予後の比較の報告に関しては、Stoklandらは157例のOPHGにおいて、OSでは差がないものの、PFSにおいてNF1例では5年のPFSが70.8%、非NF1例では46.7%と単変量解析にてp<0.001、Kaplan-Meier法におけるlog-rank testにてp=0.003と有意にNF1例の方が良好であったと報告している9)。現在NF1に合併するOPHGに対しての分子標的薬剤なども存在せず、単にPFSがNF1例において良好であるということだけでは、NF1の遺伝子診断を積極的に推奨する理由にはならない。また、NF1では家族歴にNF1が存在しない弧発例が50%程度であるが、OPHGの患者でNF1かどうか判別できない症例において、NF1遺伝子変異があるかどうかの診断をつけることによってその後の治療法の選択が何か変わることはない。以上のことを総合的に勘案すると、現時点で積極的にNF1(を含めた)遺伝子診断は、患者や家族が望む場合に限定されると考える。
|

|
| |
|
システマティックレビュー結果
<検索式>
|
| |
|
| ((optic pathway glioma AND neurofiromatosis type 1) AND hypothalamus) OR (optic pathway hypothalumus glioma AND neurofibromatosis type 1) OR (optic pathway glioma AND genetic analysis) OR (optic pathway glioma AND molecular analysis)
これを全て一次スクリーニングとし、マニュアルで二次スクリーニング文献を決定した。
|
|

|
| |
|
| |
<二次スクリーニング文献>
|
| |
|
| 1) |
Singhal S, Birch JM, Kerr B, et al. Neurofibromatosis type 1 and sporadic optic gliomas. Arch Dis Child. 2002;87(1):65-70.
[PMID: 12089128] |
| 2) |
Bolcekova A, Nemethova M, Zatkova A, et al. Clustering of mutations in the 5' tertile of the NF1 gene in Slovakia patients with optic pathway glioma. Neoplasma. 2013;60(6):655-65
[PMID: 23906300] |
| 3) |
Hutter S, Piro RM, Waszak SM, et al. No correlation between NF1 mutation position and risk of optic pathway glioma in 77 unrelated NF1 patients. Hum Genet. 2016 ;135(5):469-75.
[PMID: 26969325] |
| 4) |
Gonzalez-Martin J, Glover S, Dixon S, et al. Neurofibromatosis type 1 and McCune-Albright syndrome occurring in the same patient. Br J Dermatol. 2000 ;143(6):1288-91.
[PMID: 11122036] |
| 5) |
Kebudi R, Tuncer S, Upadhyaya M, et al. A novel mutation in the NF1 gene in two siblings with neurofibromatosis type 1 and bilateral optic pathway glioma. Pediatr Blood Cancer. 2008;50(3):713-5.
[PMID: 17514731] |
| 6) |
Erbay SH, Oljeski SA, Bhadelia R. Rapid development of optic glioma in a patient with hybrid phakomatosis: neurofibromatosis type 1 and tuberous sclerosis. AJNR Am J Neuroradiol. 2004 ;25(1):36-8.
[PMID: 14729526] |
| 7) |
Yeung JT, Pollack IF, Shah S, et al. Optic pathway glioma as part of a constitutional mismatch-repair deficiency syndrome in a patient meeting the criteria for neurofibromatosis type 1. Pediatr Blood Cancer. 2013;60(1):137-9.
[PMID: 22848017]
|
| 8) |
Kocova M, Kochova E, Sukarova-Angelovska E. Optic glioma and precocious puberty in a girl with neurofibromatosis type 1 carrying an R681X mutation of NF1: case report and review of the literature. BMC Endocr Disord. 2015;15:82.
[PMID: 26666878]
|
| 9) |
Stokland T, Liu JF, Ironside JW, Ellison DW, et al. A multivariate analysis of factors determining tumor progression in childhood low-grade glioma: a population-based cohort study (CCLG CNS9702). Neuro Oncol. 2010;12(12):1257-68.
[PMID: 20861086]
|
|
|

|
| 目次へ戻る!
|

|
| 課題3:外科的治療
|

|
| |
CQ3 外科的治療の意義はあるか
|

|
| |
推奨
絶対的に推奨される外科治療介入時期はなく、症例毎に患者年齢、視機能、水頭症の有無、NF1合併の有無などを考慮し、小児科・眼科・腫瘍内科・放射線治療科・放射線診断科・脳神経外科等から成り立つ集学的治療チームによって検討することを推奨する。(推奨度1C)
|
|

|
| |
解説
|

|
| |
|
1.CQの設定
OPHGはその好発年齢及び局在のため、根治を目指した積極的切除が行われることは多いとは言えず、外科的治療は薬物療法や放射線療法も含めた集学的治療の一部として考えられる。機能予後・生命予後の改善のための外科治療の意義について検証する。
アウトカム:QOLの維持、生存期間の延長、有害事象の発生
|

|
| |
|
2.推奨の解説
外科治療の適応及びその推奨される時期はいつかという臨床上の問題に対して、生活の質の維持、生存期間の延長、有害事象の発生を評価項目として検討した。現時点でこの質問に答えるための資料は後方視的症例集積研究しか存在しない1-4)。症候性になった場合に手術を含めた治療が選択されているが、手術単独ではなく化学放射線療法を含めての治療であり、純粋に手術に対して評価することは難しい。手術適応やこれらの治療方法は一貫しておらず、いずれの評価項目においても大きなバイアスを有する。したがって手術療法開始時期に関してのエビデンスレベルの高い推奨を述べることはできない。現時点では、症例毎に患者年齢、視機能評価、水頭症の有無、NF1合併の有無などを考慮し、小児科・眼科・腫瘍内科・放射線治療科・放射線診断科・脳神経外科等から成り立つ集学的治療チームによって手術時期を決定すべきであると考えられる。
|

|
| |
|
システマティックレビュー結果
<検索式>
下記のようにOPHG全体をcoverするようにPubMedを用いて検索し、172件ヒットした。
|
| |
|
| (("optic nerve glioma"[MeSH Terms] OR ("optic"[All Fields] AND "nerve"[All Fields] AND "glioma"[All Fields]) OR "optic nerve glioma"[All Fields] OR ("optic"[All Fields] AND "glioma"[All Fields]) OR "optic glioma"[All Fields]) AND ("surgery"[Subheading] OR "surgery"[All Fields] OR "surgical procedures, operative"[MeSH Terms] OR ("surgical"[All Fields] AND "procedures"[All Fields] AND "operative"[All Fields]) OR "operative surgical procedures"[All Fields] OR "surgery"[All Fields] OR "general surgery"[MeSH Terms] OR ("general"[All Fields] AND "surgery"[All Fields]) OR "general surgery"[All Fields]) AND resection[All Fields]) OR (("hypothalamus"[MeSH Terms] OR "hypothalamus"[All Fields] OR "hypothalamic"[All Fields]) AND ("glioma"[MeSH Terms] OR "glioma"[All Fields]) AND ("surgery"[Subheading] OR "surgery"[All Fields] OR "surgical procedures, operative"[MeSH Terms] OR ("surgical"[All Fields] AND "procedures"[All Fields] AND "operative"[All Fields]) OR "operative surgical procedures"[All Fields] OR "surgery"[All Fields] OR "general surgery"[MeSH Terms] OR ("general"[All Fields] AND "surgery"[All Fields]) OR "general surgery"[All Fields]) AND resection[All Fields])
でPubMedを用いて検索した。172件ヒットした。その中から該当する論文を二次スクリーニングとしてpick upした。
|
|

|
| |
|
| |
<二次スクリーニング文献>
|
| |
|
| 1) |
Fouladi M, Wallace D, Langston JW, et al. Survival and functional outcome of children with hypothalamic/chiasmatic tumors. Cancer. 2003; 97(4): 1084-92.
[PMID: 12569610] |
| 2) |
Goodden, J, Pizer B, Pettorini B, et al. The role of surgery in optic pathway/hypothalamic gliomas in children. J Neurosurg Pediatr. 2014; 13(1): 1-12.
[PMID: 24138145] |
| 3) |
Massimi L, Tufo T, Di Rocco C. Management of optic-hypothalamic gliomas in children: still a challenging problem. Expert Rev Anticancer Ther. 2007;7(11): 1591-610.
[PMID: 18020927] |
| 4) |
Varan A, Batu A, Cila A, et al. Optic glioma in children: a retrospective analysis of 101 cases. Am J Clin Oncol. 2013; 36(3): 287-92.
[PMID: 22547006] |
|
|

|
| 目次へ戻る!
|

|
| |
CQ4 腫瘍切除率は予後に影響するか
|

|
| |
推奨
可及的摘出によって治療成績が上がるというエビデンスはなく、手術操作に伴った合併症も無視できず、摘出率を追求するような摘出を行わないことを推奨する。(推奨度1D)
|
|

|
| |
解説
|

|
| |
|
1.CQの設定
OPHGはその好発年齢及び局在のため、根治を目指した積極的切除が行われることは多いとは言えず、外科的治療は薬物療法や放射線療法も含めた集学的治療の一部として考えられる。機能予後・生命予後の改善のための外科治療の意義について検証する。
アウトカム:QOLの維持、生存期間の延長、有害事象の発生
|

|
| |
|
2.推奨の解説
腫瘍切除率は予後に影響するか、という臨床上の問題に対して、生活の質の維持、生存期間の延長、有害事象の発生を評価項目として検討した。現時点でこの質問に答えるための資料は後方視的症例集積研究しか存在しない。バイアスリスクや非一貫性、不精確性、非直接性のすべてに問題がある。結論として、腫瘍摘出率が治療予後を改善するという報告は過去一切認められない1, 2)。Ahnらによる韓国において1982~1999年に手術摘出が行われた33症例報告を見ると、術後8例(24%)が放射線治療追加を受けているという条件下で、手術後の5年無増悪生存率は52.4%であり、少なくとも手術単独では5年後に半分以上は再発することになる1)。視交叉に腫瘍が浸潤せずに片側の視神経に限局し、有効な視力が得られず眼瞼下垂があり痛みが化学療法によっても改善しない場合、手術適応があると提唱する報告は見られる3, 4)が、例え片側の視神経に限局し完全摘出した場合でも手術単独では5~10%の確率で視交叉に再発する可能性があることには注意しなければならない1)。また摘出率を高くすることによって、追加治療の中心となる化学療法の治療効果を向上することも判明していない5)。
腫瘍摘出率を上げることによって、再発までの期間や全生存期間の延長が証明されなかったとしても、例えばQOLを改善する、化学放射線療法開始までの期間を延長するという評価項目でその利点を明示することができれば摘出率を向上させる意義があるが、この点においてもエビデンスは存在しない。従って摘出率を追い求めるような手術は推奨されない6, 7)。
さらに手術の問題点として合併症発生が避けて通れないことが挙げられる。手術合併症としては、意識障害・視機能障害の悪化・内分泌機能障害・脳梗塞が特に問題となる8, 9)。
合併症に関して最近の論文で最も良くまとめられているのは、2012年のHuppらの論文8)である。彼らは1992~2009年にドイツの国立神経放射線データセンターに蓄積された84例に対する102手術手技を検討した。その結果17/102(16.7%)で術後画像上脳梗塞が確認された。2歳未満では7/17(41.2%)の高率であった。なお脳梗塞による症状を呈したものは13/102(12.7%)であり、また生検では一例も脳梗塞は生じていなかった。この結果と対比するために、2004~2009年の51例の小脳の低悪性度神経膠腫に対する65手術を検討したところ、わずか1例(1.5%)の全摘出症例のみで脳梗塞を生じていたに過ぎなかった。なお脳梗塞発生に関して組織型やDodge分類は関係しなかった。
Sawamuraらの2007年の報告9)では、1992年以降の19例(年齢中央値3.1歳)を検討し、生検5/12(41.6%)、摘出術5/7(71.4%)で、全体としては10/19(52.6%)で合併症を生じていた。生検で合併症出現頻度が高いのは、澤村らは生検術の範疇に限局した開頭摘出を含めている(11/12例)からと考えられる。画像評価が含まれていないために梗塞を生じた評価はあくまでも症状によるものであるが、その頻度は2/19(10.5%)であった。したがって、症候性脳梗塞の頻度は、Huppらの検討とほぼ同様となる。
Ahnらの報告1)では、1982~1999年の33症例(平均年齢8.3歳)を検討している。この内、27例は90%を超えた可及的摘出術、6例は部分摘出術を行なった。2例(6%)が術後一年以内に肺梗塞とびまん性脳梗塞で死亡した。その他の合併症は、5例で一過性片麻痺、2例で感染症、1例でシャント機能不全、を生じた。彼らの結論は、OPHGに対しての可及的摘出術はPFSの延長や神経内分泌学的症状の改善には役立たず、手術は腫瘍拡大時における水頭症コントロールのため、もしくは放射線治療開始延期を目的に行うべきとしている。彼らが提唱している治療アルゴリズムには、年代が古いために化学療法の概念が入っていない点に注意が必要となる。
Steinbokらの2002年の報告10)では、18例のOPHGに対して17回の手術を行なっている。8例は亜全摘、6例は部分摘出、3例は限局した摘出術であった。限局した手術で特に間脳機能温存に注意を払うと合併症発生率は低くなると報告している。摘出率と腫瘍再発との間には関連がなかった。これらの結果から、彼らはOPHGに対する手術は組織確認と視神経や髄液循環系への減圧を目的に行うべきであるとしている。
Valduezaらの1994年の報告11)では、初回から摘出術を1980~1993年に行なった20例(年齢中央値9歳)を検討している。10例は70~90%の亜全摘、6例は部分摘出、4例は生検術であった。腫瘍再発時に4回の追加手術が行われた。これら24手術の内5回(20.8%)で合併症を生じた。1例は脳梗塞のため片麻痺と失語症、4例で内分泌障害、4例で視機能障害の悪化を来した。彼らは可及的摘出は良好な結果で遂行できたと評価している。7歳未満の場合、視索を含まない大きな腫瘍に対しては摘出を、視索を含む場合には放射線治療の前に減圧手術を、再発時には腫瘍の位置によって放射線治療の前に摘出を考慮すべきであるとしている。また7歳以上の場合は再発腫瘍に対して摘出術を勧めている。
Nicolinらによる2009年の133小児例中の治療を要した69例の検討5)では、化学療法単独、化学療法と手術併用、手術単独の間でPFSには有意差がなかったと報告している。
このようにOPHGに対して可及的摘出にてより治療成績が上がるというエビデンスはなく、上記のような手術操作に伴った合併症を生ずることから、生検術に取って代わって摘出率を追い求めるような摘出を行う論理的根拠はない。
しかしながら近年、初発のみならず再発時にもより積極的に手術(部分摘出術, debulking)を行うという考え方があらためて提唱されている12)。彼らは、問題となる手術合併症を生ずることなく、13/17(76.5%)(初発症例では7/10、再発症例では6/7)で手術単独で腫瘍制御ができ、また可及的摘出と化学療法を併用した4例は全例腫瘍制御ができていることを強調している。また10例のケースシリーズにて、より安全に摘出率を上げる方法として、術中MRIを用いる方法も提唱されている13)。画像診断もきちんとできていなかった古き時代と比較し、MRI・ニューロナビゲーションシステム・術中MRIといった手術支援システムと手術技術の進歩があることは間違いないであろう。しかしこれらの報告で、PFS, OSが改善したという結果は明示できていない。本疾患は症例数が少なすぎることと、観察期間が少なくとも10年といった年限で評価しないと結果が判明しないことにより、純粋に手術の効果を明らかにすることは今後も難しいことが予想されるが、今後手術の役割が重要視される可能性はあるかもしれない。
|

|
| |
|
システマティックレビュー結果
<検索式>
下記のようにOPHG全体をcoverするようにPubMedを用いて検索し、172件ヒットした。
|
| |
|
| (("optic nerve glioma"[MeSH Terms] OR ("optic"[All Fields] AND "nerve"[All Fields] AND "glioma"[All Fields]) OR "optic nerve glioma"[All Fields] OR ("optic"[All Fields] AND "glioma"[All Fields]) OR "optic glioma"[All Fields]) AND ("surgery"[Subheading] OR "surgery"[All Fields] OR "surgical procedures, operative"[MeSH Terms] OR ("surgical"[All Fields] AND "procedures"[All Fields] AND "operative"[All Fields]) OR "operative surgical procedures"[All Fields] OR "surgery"[All Fields] OR "general surgery"[MeSH Terms] OR ("general"[All Fields] AND "surgery"[All Fields]) OR "general surgery"[All Fields]) AND resection[All Fields]) OR (("hypothalamus"[MeSH Terms] OR "hypothalamus"[All Fields] OR "hypothalamic"[All Fields]) AND ("glioma"[MeSH Terms] OR "glioma"[All Fields]) AND ("surgery"[Subheading] OR "surgery"[All Fields] OR "surgical procedures, operative"[MeSH Terms] OR ("surgical"[All Fields] AND "procedures"[All Fields] AND "operative"[All Fields]) OR "operative surgical procedures"[All Fields] OR "surgery"[All Fields] OR "general surgery"[MeSH Terms] OR ("general"[All Fields] AND "surgery"[All Fields]) OR "general surgery"[All Fields]) AND resection[All Fields])
でPubMedを用いて検索した。172件ヒットした。その中から該当する論文を二次スクリーニングとしてpick upした。
|
|

|
| |
|
| |
<二次スクリーニング文献>
|
| |
|
| 1) |
Ahn Y, Cho BK, Kim SK, et al. Optic pathway glioma: outcome and prognostic factors in a surgical series. Childs Nerv Syst. 2006; 22(9):1136-42.
[PMID: 16628460] |
| 2) |
Mishra MV, Andrews DW, Glass J, et al. Characterization and outcomes of optic nerve gliomas: a population-based analysis. J Neurooncol. 2012;107(3):591-7.
[PMID: 22237948] |
| 3) |
Borghei-Razavi H, Shibao S, Schick U. Prechiasmatic transection of the optic nerve in optic nerve glioma: technical description and surgical outcome. Neurosurg Rev. 2017; 40(1):135-41.
[PMID: 27230830] |
| 4) |
Massimi L, Tufo T, Di Rocco C. Management of optic-hypothalamic gliomas in children: still a challenging problem. Expert Rev Anticancer Ther. 2007; 7(11): 1591-610.
[PMID: 18020927] |
| 5) |
Nicolin G, Parkin P, Mabbott D, et al. Natural history and outcome of optic pathway gliomas in children. Pediatr Blood Cancer. 2009; 53(7):1231-7.
[PMID: 19621457] |
| 6) |
Fouladi M, Wallace D, Langston JW, et al. Survival and functional outcome of children with hypothalamic/chiasmatic tumors. Cancer. 2003; 97(4):1084-92.
[PMID: 12569610] |
| 7) |
Sutton LN, Molloy PT, Sernyak H, et al. Long-term outcome of hypothalamic/chiasmatic astrocytomas in children treated with conservative surgery. J Neurosurg. 1995; 83(4):583-9.
[PMID: 7674005] |
| 8) |
Hupp M, Falkenstein F, Bison B, et al. Infarction following chiasmatic low grade glioma resection. Childs Nerv Syst. 2012, 28(3): 391-8.
[PMID: 21987345] |
| 9) |
Sawamura Y, Kamada K, Kamoshima Y, et al. Role of surgery for optic pathway/hypothalamic astrocytomas in children. Neuro Oncol. 2008; 10(5):725-33.
[PMID: 18612049] |
| 10) |
Steinbok, P, Hentschel S, Almqvist P, et al. Management of optic chiasmatic/hypothalamic astrocytomas in children. Can J Neurol Sci. 2002; 29(2): 132-8.
[PMID: 12035834] |
| 11) |
Valdueza, JM., Lohmann F, Dammann O, et al. Analysis of 20 primarily surgically treated chiasmatic/hypothalamic pilocytic astrocytomas. Acta Neurochir (Wien). 1994; 126(1): 44-50.
[PMID: 8154322] |
| 12) |
Goodden, J., B. Pizer, B. Pettorini, D. et al. The role of surgery in optic pathway/hypothalamic gliomas in children. J Neurosurg Pediatr. 2014; 13(1): 1-12.
[PMID: 24138145] |
| 13) |
Millward CP, Perez Da Rosa S, et al. The role of early intra-operative MRI in partial resection of optic pathway/hypothalamic gliomas in children. Childs Nerv Syst. 2015; 31(11):2055-62.
[PMID: 26216059] |
|
|

|
| 目次へ戻る!
|

|
| |
CQ5 再発時摘出の意義はあるのか。
|

|
| |
推奨
QOLの維持を念頭に置いて腫瘍容積減量によって神経症状が改善することが期待できる場合に部分摘出を行うこと提案する。(推奨度2D)
|
|

|
| |
解説
|

|
| |
|
1.CQの設定
OPHGはその好発年齢及び局在のため、根治を目指した積極的切除が行われることは多いとは言えず、外科的治療は薬物療法や放射線療法も含めた集学的治療の一部として考えられる。機能予後・生命予後の改善のための外科治療の意義について検証する
アウトカム:QOLの維持、生存期間の延長、有害事象の発生
|

|
| |
|
2.推奨の解説
再発時摘出の意義はあるのか、という臨床上の問題に対して、生活の質の維持、生存期間の延長、有害事象の発生を評価項目として検討した。現時点でこの質問に答えるための資料は後方視的症例集積研究しか存在しない。バイアスリスクや非一貫性、不精確性、非直接性のすべてに問題がある。再発時の摘出術が有益であることをはっきりと示した論文はないと結論づけざるを得ない。さらに、2000年より以前の報告は、Packerレジメンを中心とした化学療法が治療の中心となった現在とは再発時の治療概念が異なるため、外科治療の役割も現在求められるものとは異なっている事に注意が必要である。すなわち、放射線治療を行なった後での再発に対しては、手術摘出によって状況を改善させざるを得なかったのである。近年はOPHGに対しては化学療法が積極的に行われ、治療手段としての放射線治療を先延ばしにした上で、さらに強度変調放射線治療(IMRT)を中心とした精密な放射線治療が可能となっているので、再発時においてもこれらの治療法とうまく組み合わせることを考慮して、摘出率のみを追求せず、QOLの維持を念頭に置いて外科治療を行うべきであると考えられる。
こういった中で少数例であるが、化学療法を行った後の再発に対してや、腫瘍容積減量によって神経症状が改善することが期待できる場合に部分摘出を行っている報告がある。再発時の手術は、化学療法によってもうまく腫瘍を制御できなかった場合に、減圧手術、嚢胞性病変に対する開放術・オンマヤリザーバー挿入・シャント手術を考慮すべきであるとされている1)。ただし、再手術は必ずしも容易ではないことも注意喚起されており2)、外科療法を行う場合、細心の注意を払った上での介入が必要である。
|

|
| |
|
システマティックレビュー結果
<検索式>
下記のようにOPHG全体をcoverするようにPubMedを用いて検索し、172件ヒットした。
|
| |
|
| (("optic nerve glioma"[MeSH Terms] OR ("optic"[All Fields] AND "nerve"[All Fields] AND "glioma"[All Fields]) OR "optic nerve glioma"[All Fields] OR ("optic"[All Fields] AND "glioma"[All Fields]) OR "optic glioma"[All Fields]) AND ("surgery"[Subheading] OR "surgery"[All Fields] OR "surgical procedures, operative"[MeSH Terms] OR ("surgical"[All Fields] AND "procedures"[All Fields] AND "operative"[All Fields]) OR "operative surgical procedures"[All Fields] OR "surgery"[All Fields] OR "general surgery"[MeSH Terms] OR ("general"[All Fields] AND "surgery"[All Fields]) OR "general surgery"[All Fields]) AND resection[All Fields]) OR (("hypothalamus"[MeSH Terms] OR "hypothalamus"[All Fields] OR "hypothalamic"[All Fields]) AND ("glioma"[MeSH Terms] OR "glioma"[All Fields]) AND ("surgery"[Subheading] OR "surgery"[All Fields] OR "surgical procedures, operative"[MeSH Terms] OR ("surgical"[All Fields] AND "procedures"[All Fields] AND "operative"[All Fields]) OR "operative surgical procedures"[All Fields] OR "surgery"[All Fields] OR "general surgery"[MeSH Terms] OR ("general"[All Fields] AND "surgery"[All Fields]) OR "general surgery"[All Fields]) AND resection[All Fields])
でPubMedを用いて検索した。172件ヒットした。その中から該当する論文を二次スクリーニングとしてpick upした。
|
|

|
| |
|
| |
<二次スクリーニング文献>
|
| |
|
| 1) |
Bowers DC, Krause TP, Aronson LJ, et al. Second surgery for recurrent pilocytic astrocytoma in children. Pediatr Neurosurg. 2001; 34(5): 229-34.
[PMID: 11423771] |
| 2) |
Sawamura Y, Kamada K, Kamoshima Y, et al. Role of surgery for optic pathway/hypothalamic astrocytomas in children. Neuro Oncol. 2008; 10(5): 725-33.
[PMID: 18612049] |
|
|

|
| 目次へ戻る!
|

|
| 課題4:薬物治療
|

|
| |
CQ6 初期治療として化学療法は有効か
|

|
| |
推奨
初期治療としての化学療法(維持療法を含む)は、腫瘍の縮小や進行の抑制を期待できるため、行うことを推奨する。(推奨度1B)
|
|

|
| |
解説
|

|
| |
|
1.CQの設定
OPHGに対する薬物療法も集学的治療の一部として考えられる。その適否、使用薬剤、及び有害事象について検証する。
アウトカム:QOLの維持、生存期間の延長、有害事象の発生
|

|
| |
|
2.推奨の解説
様々な化学療法レジメが施行されているが、first lineとしてカルボプラチン注1)とビンクリスチン注2)の組み合わせが広く行われている。また、second lineとしてビンブラスチン注3)が用いられることが多い。これらの薬剤を含めた治療成績を以下に解説する。
OPHGの腫瘍増殖は一般的に緩徐であるが、その発生部位により視神経や視床下部の機能障害が大きく、治療介入が必要になる。手術は視交叉以前の片側視神経に生じたもの以外の完全な摘出は困難である(CQ3を参照)。放射線治療は、認知機能障害、内分泌障害や血管障害、二次がん等の晩期合併症が指摘されているので、その適応は限定的に考えられている(CQ8を参照)。そこで、進行例や有症状例に対して、腫瘍安定化、症状改善、放射線治療遅延を目的に化学療法が行われるようになった。OPHGは増殖が緩徐であることから強度の強い化学療法を短期間行うより、強度の弱い治療を長期間行うほうが効果的と考えられ1)、欧米では比較的治療期間の長い、全治療期間が1年から1年半程度の臨床試験が行われ、一定の効果をあげている。各臨床試験において導入療法と維持療法の区別が明確でない試験も多く、また治療内容、期間もさまざまである。下記に欧米中心に行われた大規模な臨床試験の結果の概略を示す。なお、本邦では大規模試験は行われていない。
Packerらは1990年代初めに、手術以外未治療の15歳以下の進行性low-grade glioma(LGG)78例(OPHG 56例を含む)に、カルボプラチン 175mg/m2/週とビンクリスチン 1.5mg/m2/週による10週間の導入療法後、画像ないし臨床的改善・安定を得た例にはカルボプラチン(週1回4週間), ビンクリスチン(週1回3週間)を 7 週毎、計12サイクル反復する維持療法を行い、OPHGで59%の治療反応率(CR:complete response+PR:partial response+MR:minor response)と、98%の腫瘍安定率(CR+PR+MR+SD:stable disease)を得たと報告した1)。
米国Pediatric Oncology Study Group(POG)は、1989~1994年に5歳以下のOPHGに対し、カルボプラチン 560mg/m2を4週おきに、効果があれば18サイクル行うPhase II試験(POG8936)を行った。50例(うち21例がNF1陽性)に治療がなされ、3年無再発生存率/全生存率は58/90%であった。腫瘍増大の中央期間は132週(13カ月)であった。また、18カ月の治療で70%近くの症例がSD以上であり、維持療法の意義が示唆された2)。
1996~2004年に、ドイツを中心に17歳未満のLGG 1,031例を包括的に追跡するHIT-LGG 1996研究が行われた。化学療法群は216例(NF1 55例)で、カルボプラチン 550mg/m2を3週毎計4回とビンクリスチン週1回計10回による導入療法の後、カルボプラチンとビンクリスチン併用による4週毎計11サイクルの維持療法が行われ、CR+PRが35%、腫瘍安定率は92%で、画像上の最大反応は中央値3.5カ月で認められた。本試験により大規模研究でのmonthly カルボプラチン+ビンクリスチン療法の効果が示された。また1歳未満、間脳症候群、診断時播種がprogression free survival(PFS)の予後不良因子で、これらのリスク因子を伴わない非NF1例では10年PFS 41%であるのに対し、何等かのリスク因子をもつ非NF1例では10年 PFS 16%にとどまっていることが報告された3)。Mirowらは、2014年にこの試験の1歳未満の症例について報告している。36例(うち32例がOPHG)に治療が行われ、24例が予定通り治療完了。最良効果までの期間、増大までの期間はそれぞれ、中央値3.6カ月、1.4年で、21例にサルベージ治療が必要だった。いずれも維持療法中に治療効果が出現する症例が多く、維持療法の有効性が示唆される4)。
HIT-LGG-1996ではOPHG 83例を含む109例のNF1が登録されたが、うち65例が要治療と判断され、55例で化学療法が、10例で放射線治療が行われた。化学療法は全例がカルボプラチン+ ビンクリスチンで、98%が初期治療に反応し、全NF1の5年 EFS 24%で、治療群では5年 PFS 72%、12年OS 96%と報告された。自然経過観察群で治療不要だったのは37%であった5)。
米国Children's Oncology Group(COG)では1997~2005年に、10歳未満のLGGを対象としたCOG A9952試験を行った。本試験では、非NF1ではOPHG 138例を含む274例が、137例ずつCV療法(カルボプラチン, ビンクリスチン)またはTPCV療法(チオグアニン, プロカルバジン, ロムスチン, ビンクリスチン)にランダマイズされたが、それぞれの治療反応率と腫瘍安定率は、CV療法が50%と67%、TPCV療法が52%と68%と両者で差がなく、初期治療はいずれも有効と考えられた。5年EFSはCV療法 39%、TPCV療法52%だがログランクテストでの有意差もなく、5年OSはCV療法86%、TPCV療法87%だった6)。またCV療法を行った非NF1 137例(OPG 71例)とNF1 127例(OPG 110例)の比較では、治療反応率は非NF1 51%、NF1 66%、腫瘍安定率は非NF1 68%、NF1 73%で、5年 EFSでは非NF1 39%、NF1 69%(p<0.001)、OPHGに限っても非NF1 38%、NF1 68%(p<0.001)と、NF1例の方が良好だった。5年 OSでは非NF1 87%(OPHG 86%)、NF1 98%(OPHG 99%)で差はなかった7)。CVレジメンは先のPackerらのレジメンに比し、維持療法の期間が短い(12回vs 8回)。患者背景、観察期間が異なるので単純比較は難しいが、維持療法が12回のほうがややPFSが良いように思われる。
フランスのBB-SFOP研究では、1990~2004年にOPHG 180例(NF1 60例)にカルボプラチン/プロカルバジン、エトポシド/カルボプラチン、ビンクリスチン/シクロホスファミドの6剤を7サイクル計16カ月投与し、126例(70%) が治療を完遂したが、長期経過観察では非 NF1, NF1いずれもOSにplateauが認められず、5年 95%、10年92%、15年 81%、18年76%と低下し続け、2/3が腫瘍進行で死亡したと報告した。診断時年齢1歳未満と頭蓋内圧亢進例が予後不良で、間脳症候群のない男児は予後が良好だった8)。
カナダの小児脳腫瘍コンソーシアムは、2007~2010年に18歳未満の化学療法の既往のないLGGにビンブラスチン 6mg/m2の週1回投与を70週まで繰り返す治療研究を行った。54例が登録され、うちOPHGは30例、NF1は13例であった。最良効果として、CR+MRは25.9%(CR1, PR9, MR4, SD34)、SD以上は47例(87%)で得られ、25例のOPHGのうち5例(20%)で視力の回復が得られた。反応の見られた症例の最良効果までの期間の中央値は52週(NF1例は25.5週、非NF1例は52週)であり、カルボプラチン+ビンクリスチンレジメンに比べ治療効果に大きな差はないが、効果発現までの時間は遅く、維持療法(長期治療)の有効性が示唆される9)。
|

|
| |
|
システマティックレビュー結果
<検索式>
|
| |
|
| ("optic glioma" OR "optic pathway glioma" OR "hypothalamic glioma" OR "low-grade glioma" OR “pilocytic astrocytoma” ) AND (“chemotherapy” OR “drug”) AND (“meta-analysis” OR “systematic review” OR “trial”)
上記の検索式でOPHGと化学療法に関する論文をPubMedを用いて検索し、105件ヒットした。その中からCQ6に該当する論文を二次スクリーニングとして選択した。
|
|

|
| |
|
| |
<二次スクリーニング文献>
|
| |
|
| 1) |
Packer RJ, Ater J, Allen J, et al. Carboplatin and vincristine chemotherapy for children with newly diagnosed progressive low-grade gliomas. J Neurosurg. 1997; 86(5):747-54.
[PMID: 9126887] |
| 2) |
Mahoney DH Jr, Cohen ME, Friedman HS, et al. Carboplatin is effective therapy for young children with progressive optic pathway tumors: a Pediatric Oncology Study Group phase II study. Neuro Oncol.2000; 2(4): 213-20.
[PMID: 11265230] |
| 3) |
Gnekow AK, Falkenstein F, von Hornstein S, et al, Long term follow up of the multicenter, multidiciplinary study HIT-LGG-1996 for low grade glioma in children and adolescents of German speaking Socienty of Pediatric Oncology and Hematology. Neuro Oncol. 2012; 14(10):1265-84.
[PMID: 22942186] |
| 4) |
Mirow C, Pietsch T, Berkefeld S, et al. Children < 1 year show an inferior outcome when treated according to the traditional HIT-LGG treatment strategy: a report from the German multicenter trial HIT-LGG 1996 for children with low grade glioma (LGG). Pediatr Blood Cancer 2014; 61(3):457-63.
[PMID: 24039013] |
| 5) |
Driever PH, von Hornstein S, Pietsch T, et al. Natural history and management of low-grade glioma in NF-1 children. J Neurooncol.2010; 100(2):199-207.
[PMID: 20352473]
|
| 6) |
Ater JL, Zhou T, Holmez E, et al. Randomized study of two chemotherapy regimens for treatment of low grade glioma in young children: a report from the Pediatric Oncology Group. J Clin Oncol. 2012; 30(21): 2641-7.
[PMID: 22665535]
|
| 7) |
Ater JL, Xia C, Mazewski CM, et al. Nonrandomized comparison of Neurofibromatosis type 1 and Non-Neurofibromatosis type 1 children who received carboplatin and vincristine for progressive low-grade glioma: report from the Children’s Oncology Group. Cancer 2016; 122(12):1928-36.
[PMID: 27061921]
|
| 8) |
Rakotonjanahary J, De Carli E, Delion M, et al. Mortality in children with optic pathway glioma treated with up-front BB-SFOP chemotherapy. PLoS One. 2015; 10(6):e0127676.
[PMID: 26098902]
|
| 9) |
Lassaletta A, Scheinemann K, Zelcer SM, et al. Phase II weekly vinblastine for chemotherapy-naïve children with progressive low-grade glioma: a Canadian Pediatric Brain Tumor Consortium Study. J Clin Oncol. 2016; 34(29):3537-43.
[PMID: 27573663]
|
| |
| |
注1)小児悪性固形腫瘍として保険適応
注2)悪性星細胞腫、乏突起膠腫成分を有する神経膠腫として保険適応
注3)悪性リンパ腫、絨毛性疾患、再発又は難治性の胚細胞腫瘍、ランゲルハンス細胞組織球症として保険適応
|
|
|

|
| 目次へ戻る!
|

|
| |
CQ7 再発時の化学療法は生命予後を改善するか
|

|
| |
推奨
再発時の化学療法は腫瘍の進行を抑制し、生命予後の改善をもたらす可能性があるため行うことを推奨する。(推奨度1C)
|
|

|
| |
解説
|

|
| |
|
1.CQの設定
OPHGに対する薬物療法も集学的治療の一部として考えられる。その適否、使用薬剤、及び有害事象について検証する。
アウトカム:QOLの維持、生存期間の延長、有害事象の発生
|

|
| |
|
2.推奨の解説
OPHGの再発時において、化学療法が他の治療に比して生存期間を有意に延長できるか否かについて、高いレベルのエビデンスを示す論文はない。しかしながら、手術による切除は視機能や視床下部障害を考慮すると困難な場合が多い。また、再発時であっても放射線照射の時期を遅らせるためにも、再度化学療法が試みられる。ビンブラスチン、ベバシズマブ注1)+イリノテカン注2)およびテモゾロミド注3)についての論文を参照する。
Bouffetらは41名(1.4~18.2歳:中央値7.2歳)の再発low-grade glioma(LGG)の患児(視路/視床下部膠腫は34名)に対してビンブラスチン療法(静注, 6 mg/m2, 週1回, 52 週間)を前向き登録研究として約1年間継続して施行した。治療を完了できたのは31名で、治療反応率(CR+PR+MR)は36%(18例)であった。その後の平均観察期間は67カ月で、23例で進行しなかった。5年生存率は93.2%(3名が死亡)、5年無増悪生存率は42.3%であった。副作用のほとんどは好中球減少症(グレード4: 18例)のみであった1)。
Gururanganらは35例(0.6~17.6歳:中央値8.4歳)の再発LGGの患児(毛様性星細胞腫が46%, 詳細な部位の記載はなし)に対してベバシズマブ+イリノテカン療法を平均12コースにわたり施行した。29名(83%)は6カ月以上治療を施行できた。6カ月と2年無増悪生存率はそれぞれ85.4%、47.8%であった2)。
一方で、Nicholsonらは113名(1~23歳:中央値11歳)の小児および若年者の再発脳腫瘍(LGGが22名(詳細な部位や病理の記載はなし)に対してテモゾロミド経口投与(200mg/m2/day、5日間、毎月)を12サイクルにわたり施行した。全体でCRは1名、PRは5名のみであった。LGGについてはCR, PRはなく、SDを含めたno responseは41%であった。以上の結果から、小児LGGに対するテモゾロミドの効果は限定的と述べている3)。
|

|
| |
|
システマティックレビュー結果
<検索式>
|
| |
|
| ("optic glioma" OR "optic pathway glioma" OR "hypothalamic glioma" OR "low-grade glioma" OR “pilocytic astrocytoma” ) AND (“chemotherapy” OR “drug”) AND (“meta-analysis” OR “systematic review” OR “trial”)
上記のようにOPHGと化学療法に関する論文をカバーするようにPubMedを用いて検索し、105件ヒットした。その中からCQ7に該当する論文を二次スクリーニングとして選択した。
|
|

|
| |
|
| |
<二次スクリーニング文献>
|
| |
|
| 1) |
Gururangan S, Fangusaro J, Poussaint TY, et al. Efficacy of bevacizumab plus irinotecan in children with recurrent low-grade gliomas--a Pediatric Brain Tumor Consortium study. Neuro Oncol. 2014; 16(2): 310-7.
[PMID: 24311632] |
| 2) |
Bouffet E, Jakacki R, Goldman S, et al. Phase II study of weekly vinblastine in recurrent or refractory pediatric low-grade glioma. J Clin Oncol. 2012; 30(12):1358-63.
[PMID: 22393086] |
| 3) |
Nicholson HS, Kretschmar CS, Krailo M, et al. Phase 2 study of temozolomide in children and adolescents with recurrent central nervous system tumors: a report from the Children's Oncology Group. Cancer. 2007; 110(7): 1542-50.
[PMID: 17705175] |
| |
| |
注1)小児悪性固形腫瘍として保険適応
注2)小児悪性固形腫瘍として保険適応
注3)悪性神経膠腫として保険適応
|
|
|

|
| 目次へ戻る!
|

|
| 課題5:放射線療法
|

|
| |
CQ8 放射線治療は有効か。
|

|
| |
推奨
手術及び化学療法が優先されるが、限られた場合*に放射線療法が行われることを提案する。(推奨度2C)
*限られた場合とは、放射線療法の局所制御のメリットから、化学療法が不応であり、腫瘍の増大部位や大きさ、速度によって、手術による減圧が不能であったり、視機能温存が不能であったりする場合など、を想定している。また有害事象としての血管奇形発生の頻度が10歳以上の照射では減少するため、この年齢以上では根治的な放射線療法も提案されうる。
|
|

|
| |
解説
|

|
| |
|
1.CQの設定
OPHGに対する放射線治療も外科治療や薬物療法と同じく集学的治療の一部として考えられる。その適否、線量、照射範囲及び有害事象について検証する。
アウトカム:QOLの維持、生存期間の延長、有害事象の発生
|

|
| |
|
2.推奨の解説
OPHGは一般に低悪性度の神経膠腫である割合が高く生命予後は比較的良好である。特にNF1に合併した症例では自然退縮例も報告され、治療開始時期に関しては早期、つまり年少時に介入すべきかどうか、慎重に判断すべきである。患者は0歳から4歳の幼児が多く、放射線療法は、この年齢層においては、後述するように正常組織の発達を阻害する各種の有害事象をもたらすリスクがあり、手術、化学療法がより優先的に用いられている。一方で放射線療法は、腫瘍が化学療法に対して不応となり、症状を伴う腫瘍の増大を生じ、手術で減圧が不能な大きさ、部位である場合や、視神経に生じた腫瘍が増大し、視機能低下をきたし、化学療法、手術によっても視機能温存が困難な場合など、限られた条件のもとでは積極的に施行することが提案される1-3)。
OPHGの放射線療法に関する前向き比較試験は存在しない。Fouladiらの観察研究1)によれば、73例のOPHGに対し、その診断直後に放射線療法、化学療法単独治療、無治療経過観察を行った群を観察し、ランダム化比較ではないものの6年無増悪生存率がそれぞれ62%、12%、37%であった。放射線療法が独立した予後良好因子であった。
その一方でOPHGはウイリス動脈輪に近いため、まだ血管が発達していない幼児に対して治療を行うと、治療後の血管の発達が阻害され、モヤモヤ血管、海綿状血管腫などの血管形成障害が起こることが懸念される4,5)ほか、白質脳症6)、視床下部下垂体への照射による内分泌機能障害7)、二次発癌のリスク4,8)を生ずる。Tsangらの報告4)によれば、放射線療法を行った89例のOPHG のうち、grade2より重篤な血管形成障害が7例に生じ(10年累積発生率7.1%)、発生例と非発生例の照射時年齢の中央値はそれぞれ6.4歳と8.1歳であった。また10歳以下の症例の10年累積発生率は11.3%で、11歳以上の症例では0%であった。Merchantらの78例の小児のグリオーマ(うち58例がOPHG)の原体照射による第Ⅱ相試験の報告5)によれば、7年の血管障害の発生率は4.79±2.73%で、年齢別の6年の血管障害の発生率5歳未満の8例では12.5±12.6%、5歳以上の66例では3.8±2.6%であった(p=0.105)。
Lacazeらの27例のOPHGの小児に対し初期治療として化学療法を施行した報告6)によれば、化学療法後に放射線療法を加えなかった19例の知能指数は平均107±17であったのに対し、放射線療法を加えた8例の知能指数は平均88±24であった。彼らは可能であれば、放射線療法を避けるか、遅らせることを結論づけている。
Ganらの166例の小児のOPHGの長期観察の報告7)によれば、20年の内分泌に関する無イベント生存率は4%であり、多変量解析の結果では、腫瘍の視床下部浸潤(ハザード比 2.20倍, 95%CI:1.41-3.42, p<0.001)と並んで、放射線療法は有意な予後不良因子であった(ハザード比 1.98倍, 95%CI:1.16-3.39, p=0.013)。
二次発癌に関してはSharifらのNF1に合併したOPHG 58例を、放射線療法を行なった18例と行わなかった40例に分けて解析した報告8)によれば、二次癌が生じる確率は前者が50%、で後者が20%であり、放射線療法による二次性の中枢神経腫瘍の発生のハザード比が3.04倍(95%CI:1.29-7.15)と有意に、特にNF1合併例において高率であった。またTsangらの報告によれば、NF1に合併した症例では14例中4例(29%)に、合併していない症例では75例中4例(5.3%)にそれぞれ放射線療法が原因と考えられる二次発癌が発生した。そのためNF1に合併した症例では他の治療不応例の救済の目的以外では極力放射線療法を避けるべきであるとしている4)。
放射線療法の線量は他の低悪性度神経膠腫に準じて45~54 Gy/25~30分割3-4,9)で、腫瘍局所に適切なマージンを付加したターゲットに対して可及的に線量集中性を改善した通常分割の定位的照射法を用いて行うことが推奨される10,11)。また患者が小児であることを考慮して、一回線量は1.8 Gy程度に下げて投与することが推奨される8)。最近では陽子線治療もその線量集中性と、周囲の高線量域の体積が低く抑えられるために用いられるようになってきている12)。
OPHGの放射線療法は耐容線量の低い視神経・下垂体を含んだ領域へ精密に照射するという技術的な困難さと対象患児の晩期有害事象という問題を孕んでいるため、集学的がん治療グループでの適応判断のもと、患児、そのご家族と治療方針について細やかな相談の後、高精度な放射線治療の手法を用いて行われることが必要である。
|

|
| |
|
システマティックレビュー結果
<検索式>
|
| |
|
| (("optic nerve glioma"[MeSH Terms] OR ("optic"[All Fields] AND "nerve"[All Fields] AND "glioma"[All Fields]) OR "optic nerve glioma"[All Fields] OR ("optic"[All Fields] AND "glioma"[All Fields]) OR "optic glioma"[All Fields]) AND ("radiotherapy"[Subheading] OR "radiotherapy"[All Fields] OR "radiation therapy, radio"[MeSH Terms] OR ("radiation"[All Fields] AND "procedures"[All Fields] AND "radiotherapeutic"[All Fields]) OR "radiotherapy procedures"[All Fields] OR "radiotherapy"[All Fields] OR "general radiotherapy"[MeSH Terms] OR ("general"[All Fields] AND "radiotherapy"[All Fields]) OR "general radiotherapy "[All Fields]) AND irradiation[All Fields]) OR (("hypothalamus"[MeSH Terms] OR "hypothalamus"[All Fields] OR "hypothalamic"[All Fields]) AND ("glioma"[MeSH Terms] OR "glioma"[All Fields]) AND ("radiotherapy"[Subheading] OR "radiotherapy"[All Fields] OR "radiotherapy procedures, irradiation"[MeSH Terms] OR ("radiotherapeutical"[All Fields] AND "procedures"[All Fields] AND "irradiation"[All Fields]) OR " radiotherapeutical procedures"[All Fields] OR "radiotherapy"[All Fields] OR "general radiotherapy "[MeSH Terms] OR ("general"[All Fields] AND " radiotherapy"[All Fields]) OR "general radiotherapy "[All Fields]) AND irradiation[All Fields])
上記の検索式でPubMedを用いて検索し、410件ヒットした。その中からCQ9に該当する論文を二次スクリーニングとして選択した。
|
|

|
| |
|
| |
<二次スクリーニング文献>
|
| |
|
| 1) |
Fouladi M, Wallace D, Langston JW, et al. Survival and functional outcome of children with hypothalamic/chiasmatic tumors. Cancer. 2003; 97(4):1084-92.
[PMID: 12569610] |
| 2) |
Khafaga Y, Hassounah M, Kandil A, et al. Optic gliomas: A retrospective analysis of 50 cases. Int J Radiat Oncol Biol Phys. 2003; 56(3) 807-12.
[PMID: 12788189] |
| 3) |
Terashima K, Chow K, Jones J, et al. Long-term outcome of centrally located low-grade glioma in children. Cancer. 2013;119(14);2630-8.
[PMID: 23625612] |
| 4) |
Tsang DS, Murphy ES, Merchant TE. Radiation therapy for optic gliomas in children. Int J Radiat Oncol Biol Phys. 2017; 99(3): 642-51.
[PMID: 29280458] |
| 5) |
Merchant TE, Kun LE, Wu S, et al. Phase II trial of conformal radiation therapy for pediatric low-grade glioma. J Clin Oncol. 2009; 27(22):3598-604.
[PMID: 19581536]
|
| 6) |
Lacaze E, Kieffer V, Streri A, et al. Neuropsychological outcome in children with optic pathway tumours when first-line treatment is chemotherapy. Br J Cancer. 2003; 89(11):2038-44.
[PMID: 14647135]
|
| 7) |
Gan HW, Phipps K, Aquilina K, et al. Neuroendocrine Morbidity After Pediatric Optic Gliomas: A Longitudinal Analysis of 166 Children Over 30 Years. J Clin Endocrinol Metab. 2015; 100(10): 3787-99.
[PMID: 26218754]
|
| 8) |
Sharif S, Ferner R, Birch JM, et al. Second primary tumors in neurofibromatosis 1 patients treated for optic glioma: substantial risks after radiotherapy. J Clin Oncol. 2006; 24(16):2570-5.
[PMID: 16735710]
|
| 9) |
Stieber VW, Radiation therapy for visual pathway tumors. J Neuroophthalmol. 2008; 28(3): 222-30.
[PMID: 18769290]
|
| 10) |
Walker D. Recent advances in optic nerve glioma with a focus on the young patient. Curr Opin Neurol. 2003; 16(6): 657-64.
[PMID: 14624073]
|
| 11) |
Combs SE, Schulz-Ertner D, Moschos D, et al. Fractionated stereotactic radiotherapy of optic gliomas: Tolerance and long-term outcome. Int J Radiat Oncol Biol Phys. 2005; 62(3):814-9.
[PMID: 15936565]
|
| 12) |
Indelicato DJ, Rotondo RL, Uezono H, et al. Outcomes Following Proton Therapy for Pediatric Low-Grade Glioma. Int J Radiat Oncol Biol Phys. 2019; 104(1): 149-56.
[PMID: 30684665]
|
|
|

|
| 目次へ戻る!
|

|
|

|
| |

|
|

|
|
|

|
|

