 |

|

|
| 髄芽腫 診療ガイドライン
|

|
| 目 次:各メニューをクリックすると該当項目にリンクします。
|

|
| |
|
| |
|

|
| (Ⅰ)ガイドラインサマリー
|

|
| |
| |
課題1:手術摘出
|
| |
CQ1 |
: |
肉眼的全摘出は生命予後を改善するか?
|
| |
推奨 |
: |
髄芽腫患者に対して全摘出を行うことを提案する。(推奨度2C)
|

|
| |
課題2:神経認知機能を含む機能的予後と生命予後の向上
|
| |
CQ2 |
: |
手術後の予後因子は何か?
|
| |
推奨 |
: |
予後因子として、組織型(予後良好な順でdesmoplastic nodular/ extensive nodularity、classic、large cell/anaplastic)、転移の有無(転移有が予後不良)、遺伝子プロファイルで分類される亜型(WNT型が予後良好)を用いることを推奨する。(推奨度1B)
|

|
| |
課題3:放射線治療
|
| |
CQ3 |
: |
全脳脊髄照射において、各リスク群における標準線量からの線量低減または線量増加は有用か?
|
| |
推奨1 |
: |
全脳脊髄照射において、標準リスク群に対して標準線量(24Gy程度)からの線量低減を行わないことを推奨する。(推奨度 1D)
|
| |
推奨2 |
: |
全脳脊髄照射において、高リスク群に対して標準線量(36Gy程度)からの線量増加を行わないことを推奨する。(推奨度 1D)
|

|
| |
課題4:陽子線治療
|
| |
CQ4 |
: |
放射線治療として陽子線治療は推奨されるか?
|
| |
推奨 |
: |
放射線治療として陽子線治療を行うことを条件付きで提案する。(推奨度2D)
|

|
| |
課題5:化学療法
|
| |
CQ5 |
: |
3歳以上の標準リスク群にはどのような術後治療が推奨されるか?
|
| |
推奨 |
: |
シスプラチン、シクロホスファミド、ビンクリスチンを中心とした多剤併用化学療法と、24Gy程度の全脳脊髄照射と総線量54Gy程度の局所照射を組み合わせた通常分割放射線治療による、術後化学放射線治療を推奨する。(推奨度1B)
|
| |
CQ6 |
: |
3歳以上の高リスク群にはどのような術後治療が推奨されるか?
|
| |
推奨 |
: |
36Gy程度の全脳脊髄照射と総線量54Gy程度の局所照射を術後に行い、その後にシスプラチン、シクロホスファミド、ビンクリスチンを中心とした多剤併用化学療法を複数コース行うことを提案する。(推奨度2C)
|
| |
CQ7 |
: |
3歳未満の群にはどのような術後治療が推奨されるか?
|
| |
推奨1 |
: |
乳幼児の髄芽腫において、転移がなくdesmoplastic nodular/ extensive nodularityサブタイプの患者群では、放射線治療を行わず、メトトレキサート(脳室内または髄腔内投与を含む)、プラチナ剤、アルキル化剤、ビンクリスチン、エトポシドを中心とした多剤併用化学療法による術後治療を提案する。(推奨度2D)
|
| |
推奨2 |
: |
Desmoplastic nodularまたはmedulloblastoma with extensive nodularity以外の組織学的サブタイプおよび転移がある場合は、標準的な後治療は確立されておらず、上記の治療に大量化学療法や局所放射線療法を組み合わせた強化治療を行うことを提案する。(推奨度2C)
|

|
| |
課題6:再発時の治療
|
| |
CQ8 |
: |
局所再発時の適切な治療法は何か?
|
| |
推奨1 |
: |
髄芽腫の局所再発に対し、腫瘍の進行の抑制と生命予後の改善を期待し、化学療法を実施することを提案する。(推奨度2D)
|
| |
推奨2 |
: |
髄芽腫の局所再発に対し、摘出が安全に行いうる場合や摘出により症状の改善が期待できる場合等に、外科治療を提案する。(推奨度2D)
|
| |
推奨3 |
: |
放射線治療は初期治療で放射線を使用しなかったか減量されている場合等に、個々の状況に応じて緩和的にまたは根治的に実施することを提案する。(推奨度2D)
|
| |
CQ9 |
: |
播種再発に対する適切な治療法は何か?
|
| |
推奨 |
: |
寛解を目的とした治療を目指すが、治療反応性が不良の場合は、緩和的治療も提案される。(推奨度2D)
|

|
| |
課題7: 治療による晩期障害
|
| |
CQ10 |
: |
髄芽腫に特徴的な晩期障害とそれをきたしやすい背景因子は何か?
|
| |
推奨1 |
: |
無言症/後頭蓋窩症候群では学習機能が低下するので特に注意して経過を見ることを推奨する。(推奨度1B)
|
| |
推奨2 |
: |
髄芽腫治療後に経時的に認知機能障害は進行し、特に高リスク群と低年齢(7歳以下)でその傾向が強いので特に注意して経過を見ることを推奨する。(推奨度1C)
|
|

|
| 目次へ戻る!
|

|
| (Ⅱ)髄芽腫の診療アルゴリズム
|

|
| |
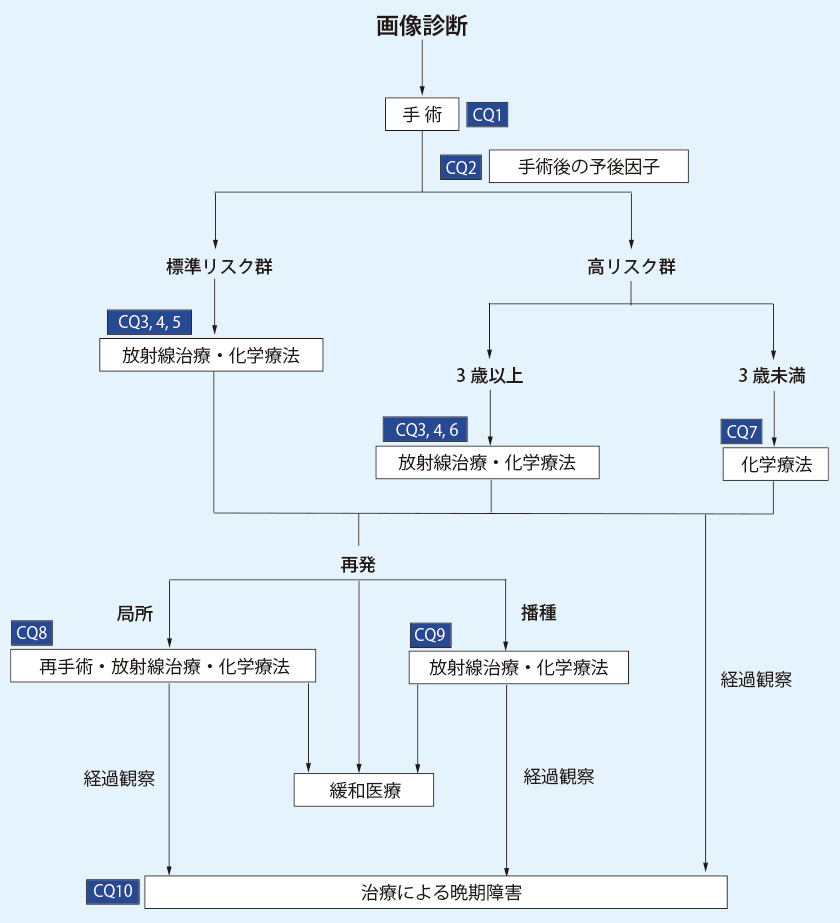
|
| 目次へ戻る!
|

|
| (Ⅲ)略語一覧
|

|
| |
| ACNU |
Nimustine |
ニムスチン |
| BCNU |
carmustine |
カルムスチン |
| CBDCA |
Carboplatin |
カルボプラチン |
| CCNU |
Lomustine |
ロムスチン |
| CDDP |
Cisplatin |
シスプラチン |
| COG |
Children’s Oncology Group |
|
| CPM |
cyclophosphamide |
シクロホスファミド |
| CPT-11 |
Irinotecan |
イリノテカン |
| CR |
complete response |
完全奏効(完全寛解) |
| CSI |
craniospinal irradiation |
全脳脊髄照射 |
| CT |
computed tomography |
コンピュータ断層撮影法 |
| DFS |
disease free survival |
無病生存期間 |
| DN |
desmoplastic nodular |
線維形成結節性 |
| EFS |
event free survival |
無イベント生存期間 |
| GyE |
gray equivalent |
|
| HFRT |
hyper-fractionated radiotherapy |
過分割照射放射線治療 |
| HR |
hazard ratio |
ハザード比 |
| IFO |
Ifosfamide |
イホスファミド |
| IMRT |
intensity modulated radiation therapy |
強度変調放射線治療 |
| IQ |
intelligence quotient |
知能指数 |
| JCCG |
Japan Children’s Cancer Group |
日本小児がん研究グループ |
| MBEN |
(medulloblastoma with) extensive nodularity |
高度結節性髄芽腫 |
| MRI |
magnetic resonance imaging |
磁気共鳴画像 |
| MTX |
methotrexate |
メトトレキサート |
| OS |
overall survival |
全生存期間 |
| PD |
progressive disease |
|
| PFS |
progression free survival |
無増悪生存期間 |
| PNET |
primitive neuroectodermal tumor |
原始神経外胚葉腫瘍 |
| POG |
pediatric oncology group |
米国小児腫瘍研究グループ |
| PSL |
prednisolone |
プレドニゾロン |
| PTX |
paclitaxel |
パクリタキセル |
| QOL |
quality of life |
生活の質 |
| RCT |
randomized controlled trial |
ランダム化比較試験 |
| SD |
stable disease |
|
| SHH |
sonic hedgehog |
|
| SR |
systematic review |
システマティックレビュー |
| TMZ |
temozolomide |
テモゾロミド |
| TT |
thiotepa |
チオテパ |
| VCR |
vincristine |
ビンクリスチン |
| VP16 |
etoposide |
エトポシド |
|

|
| 目次へ戻る!
|

|
| (Ⅳ)作成組織・作成方針
|

|
| 1. 作成組織
|

|
| |
1.1. 作成主体
|

|
| |
|
共通目次と共通項目参照
|

|
| |
1.2. 診療ガイドライン作成グループ
|

|
| |
|
髄芽腫診療ガイドライン作成グループ
|
| |
|
| |
氏 名 |
所属機関 |
作成上の役割 |
| 委員長 |
橋本直哉 |
京都府立医科大学 脳神経外科 |
髄芽腫ガイドライン作成
ワーキンググループ委員長・統括 |
| 委員 |
白土博樹 |
北海道大学医学部病態情報学講座 放射線医学分野 |
放射線治療に関するCQ |
| 協力委員 |
溝脇尚志 |
京都大学大学院医学研究科 放射線腫瘍学・画像応用治療学 |
放射線治療に関するCQ |
| 委員 |
若林俊彦 |
名古屋共立病院 集束超音波治療センター |
外科的治療に関するCQ |
| 協力委員 |
坂本博昭 |
大阪市立総合医療センター 小児脳神経外科 |
外科的治療に関するCQ |
| 協力委員 |
高橋義信 |
京都府立医科大学 脳神経外科 |
外科的治療に関するCQ |
| 協力委員 |
原 純一 |
大阪市立総合医療センター 小児医療センター小児血液腫瘍科 |
予後予測因子・化学療法に関するCQ |
| 委員 |
寺島慶太 |
国立成育医療研究センター 小児がんセンター脳神経腫瘍科 |
化学療法に関するCQ |
| 協力委員 |
山本哲哉 |
横浜市立大学医学研究科 脳神経外科 |
再発治療に関するCQ |
| 委員 |
中村英夫 |
久留米大学医学部 脳神経外科 |
再発治療に関するCQ |
| 協力委員 |
五味 玲 |
自治医科大学 とちぎ子ども医療センター小児脳神経外科 |
晩期障害に関するCQ |
| 委員 |
隈部俊宏 |
北里大学医学部 脳神経外科 |
他のガイドラインとの整合性 |
| 委員 |
杉山一彦 |
広島大学病院 がん化学療法科 |
他のガイドラインとの整合性 |
|

|
| |
1.3. システマティックレビューチーム(SR チーム)
|

|
| |
|
| 課題担当者 |
SR |
所属 |
作成上の役割 |
橋本直哉
高橋義信 |
小川隆弘 |
京都府立医科大学脳神経外科 |
外科的治療に関するCQ |
| 寺川雄三 |
北海道大野記念病院 脳神経外科 |
外科的治療に関するCQ |
原 純一
寺島慶太 |
山崎夏維 |
大阪市立総合医療センター 小児血液腫瘍科 |
予後予測因子・化学療法に関するCQ |
| 奥廣有喜 |
名古屋大学大学院医学系研究科分子細胞免疫学分野 |
予後予測因子・化学療法に関するCQ |
溝脇尚志
白土博樹 |
宇藤 恵 |
京都大学医学部附属病院 放射線治療科 |
放射線治療に関するCQ |
| 森 崇 |
北海道大学病院 放射線治療科 |
放射線治療に関するCQ |
| 出水祐介 |
兵庫県立粒子線医療センター 附属神戸陽子線センター 放射線治療科 |
放射線治療に関するCQ |
| 河村淳史 |
兵庫県立こども病院 脳神経外科 |
放射線治療に関するCQ |
寺島慶太
原 純一 |
木村由衣 |
国立成育医療研究センター 小児がんセンター 脳神経腫瘍科 |
化学療法に関するCQ |
| 吉村 聡 |
国立成育医療研究センター 小児がんセンター 脳神経腫瘍科 |
化学療法に関するCQ |
| 津村悠介 |
名古屋大学医学部附属病院 小児科 |
化学療法に関するCQ |
| 山本哲哉 |
井原 哲 |
東京都立小児総合医療センター脳神経外科 |
再発治療に関するCQ |
| 広川大輔 |
神奈川県立こども医療センター脳神経外科 |
再発治療に関するCQ |
| 三宅勇平 |
横浜市立大学附属病院 脳神経外科 |
再発治療に関するCQ |
| 中村英夫 |
牧野敬史 |
熊本市立熊本市民病院 脳神経外科 |
再発治療に関するCQ |
| 黒田順一郎 |
熊本大学脳神経外科 |
再発治療に関するCQ |
| 五味 玲 |
五味 玲 |
自治医科大学とちぎ子ども医療センター 小児脳神経外科 |
晩期障害に関するCQ |
| 室井 愛 |
筑波大学 脳神経外科 |
晩期障害に関するCQ |
|

|
| 目次へ戻る!
|

|
| 2. 作成過程
|

|
| |
2.1. 作成方針
|

|
| |
|
髄芽腫に対するエビデンスを整理し、診療アルゴリズムと診療ガイドラインを示すことによって、髄芽腫患者の生命予後と機能予後の改善を目的とする。
|

|
| |
2.2. 使用上の注意
|

|
| |
|
共通目次と共通項目参照
|

|
| |
2.3. 利益相反
|

|
| |
|
共通目次と共通項目参照
|

|
| |
2.4. 作成資金
|

|
| |
|
共通目次と共通項目参照
|

|
| |
2.5. 組織編成
|

|
| |
|
ガイドライン統括委員会:
ガイドライン作成を統括する脳腫瘍診療拡大ガイドライン委員会は、2009年11月に日本脳腫瘍学会の内部組織として設置され、当時の理事と協力委員2名で構成された。その後、日本脳腫瘍学会の新理事が委員として加わった。また、対象疾患ごとに関連学会から協力委員の参加を得ている。
ガイドライン作成グループ:
脳腫瘍診療拡大ガイドライン委員会から選出された13名にて構成されている。
システマティックレビューチーム:
重要臨床課題ごとに作成グループがシステマティックレビュー(SR)チームのリーダーとなり、リーダーよりSR委員を選出してもらい、各課題2~4名で編成した。髄芽腫が希少疾患であることを踏まえて、各チームひとりずつガイドライン委員が兼任することとした。
|

|
| |
2.6. 作成過程
|

|
| |
|
準備:
2016年2月髄芽腫ガイドラインWG第1回会議を開催し、ガイドライン作成グループが発足。課題をどのようにするか討議し各課題のリーダーを決定した。
スコープ:
ドラフトを作成し、メール回覧のうえ、メール討議を行い、改変を繰り返して完成し、委員全体にメールで回覧し意見を募った。
システマティックレビュー:
2017年10月に開始。Minds2014に準拠した方法により行なったが希少疾患であるためエビデンスが少なく、Mindsに準拠した方法の適用が困難な場面に遭遇したが、論議しながら完成に向かった。
WG会議:
脳腫瘍拡大ガイドライン委員会の開催に合わせて、WG会議を行った。その後、2020年5月からは月1回のWG(オンライン)会議を計15回行った。2021年5月11日のWG会議で各CQにおける推奨グレードの決定を行った。
推奨作成とその決定:
重要臨床課題(CQ)ごとに担当委員が草案を作成し、メールおよぎオンライン会議で討議した。推奨グレードに関しては髄芽腫ガイドラインWGの委員及びSRチームの24人にて投票を行い、WG内における推奨グレードをまず決定し、最終的に2022年1月15日の脳腫瘍診療ガイドライン拡大委員会にて統括委員の投票により推奨を承認した。
その他、共通目次と共通項目にも追加記載あり。
最終化:共通目次と共通項目参照
公開:2022年4月日本脳腫瘍学会のホームページ上に公開予定
公開後の取り組み:共通目次と共通項目参照
|

|
| |
2.7. 推奨の強さの提示方法・エビデンスレベル・推奨度(臨床的意義)について
|

|
| |
|
共通目次と共通項目参照
|

|
| (Ⅴ)スコープ
|

|
| |
1.髄芽腫の基本的特徴(総論)
|
| |
|
主に小児の小脳虫部ないしは脳幹背側に好発する胎児性の神経上皮性腫瘍である。病理学的に、核異型と核分裂像に富む未分化な小型円形の腫瘍細胞が高密度に配列して構成される。1) ①発生部を中心に局所に浸潤性に発育し、②全中枢神経系に髄液腔内播種を早期にきたし、③腫瘍の進行とともに血行性に遠隔転移を示す。腫瘍名の由来は、中枢神経系の発生において未分化神経管上皮細胞が神経細胞とグリア細胞へ分化する前の髄芽細胞medulloblastを概念上想定し、その腫瘍型を髄芽腫(medulloblastoma)と命名したところにある(Bailey and Cushing)。2) 現在では発生起源は胎生期の上・下髄帆にある外顆粒細胞や上衣下基質細胞とされるが結論には至っていない。小脳虫部の下半部から第4脳室に発育・浸潤することが最も多く、小脳半球に主座を置くこともある。
|

|
| |
|
(1)疫学
WHO脳腫瘍分類20161)によると、胎児性脳腫瘍のうち最も頻度が高く、小児脳腫瘍では星細胞系腫瘍に次いで多く、25%程度の頻度と記載されている。小児100万人あたりの年間発生数は6例程度である。また、髄芽腫を含む胎児性腫瘍の年齢調整罹患率は、人口10万人あたり米国0.24、日本0.14 と米国で罹患率が高い。3)
我が国の脳腫瘍全国集計調査報告 第14版(2005-2008) 4)によれば、原発性脳腫瘍の1.0%を占め、14歳以下の小児期脳腫瘍の10.1%を占める。小児期脳腫瘍のうちでは膠芽腫を含む星細胞系腫瘍(23.3%)、胚細胞性腫瘍(14.7%)についで3番目の頻度である。我が国では年間約100-120人が新規に診断されていると推定される。好発年齢は14歳以下が全体の78%程度を占めており、特に2歳から9歳に好発する。男性にやや多い。成人発生は国内では約15%で、その約80%は21−40歳に発生する。小児例と比較すると、小脳半球に発生することが多い。
|

|
| |
|
(2)臨床症状と画像所見
頭蓋内圧亢進症状が約半数と最も多く、頭痛、局所巣症状、脳神経麻痺などを呈する。4) 第4脳室を占拠し閉塞性水頭症をきたし、頭痛のほかに不機嫌、嘔気、嘔吐、意識障害を契機に診断される。体幹や四肢の失調も起こりやすい。
CTでは境界が明瞭な等〜高吸収域を示し、一様に強い造影効果を示すことが多いが、低吸収で造影効果を示さないもの、嚢胞様変化を含むもの、石灰化を含む場合などもある。MRIではT1強調画像で低〜等信号、T2強調画像では等〜高信号域を示すことが 多く、T1低信号・T2 高信号の小嚢胞が散在し、全体として不均一な様相を呈する。5-7) ガドリニウム(Gd)造影では中等度から高度に造影増強されることが多いが、軽度造影されるものからほとんど造影されないものも10%程度存在する。造影増強効果は不均一(heterogenous)なことが多い。どの断面でも境界明瞭、ほぼ円形に描出される。診断時に大脳、脊髄に播種が認められる症例もある。
|

|
| |
|
(3)病理組織分類と分子生物学的知見(WHO脳腫瘍分類2016)
2016年のWHO脳腫瘍分類1)では、古典的な髄芽腫 (classic type) のほかに、3種の亜型 ①desmoplastic nodular medulloblastoma、②medulloblastoma with extensive nodularity、③ large cell / anaplastic medulloblastomaが記述されている。(表1)
また近年では遺伝子変異に基づいた分子生物学的4型分類が提唱され、8, 9) 予後との相関性の観点から2016年のWHO分類にも取り入れられた。これは当初WNT遺伝子変異群、sonic hedgehog (SHH)遺伝子変異群、group 3, group 4とされたが、group 3と4の種別が不十分であるとの判断から、WHO分類ではまずWNT群、SHH群、non-WNT/non-SHH群の3群に分け、SHH群はTP53遺伝子変異の有無にて予後が大きく異なるため、さらに2群に分けることとしている。(表1)
乳幼児(<3歳)、小児(3〜17歳)および成人(18歳以上)という年齢区分に留意しつつ概略を述べると、WNT群は80%が小児期症例であり、90%以上がclassic typeを示す。予後が大変良好であり、10年生存率はほぼ100%に近い。
SHH群は、ほかに比較して男女差がなく全年齢層に均等に分布、病理組織ではclassic typeとdesmoplastic nodular typeが多い。予後はWNT群に次いで良好であるが、小児期症例では50%にTP53変異を認め、そのうちの半数以上でgermlineでもTP53変異があり、これらの予後は不良である。
Group 3は男性が女性のほぼ2倍であり、70%が小児期に発生する。明らかに予後不良で5年生存率は50-60%である。ほとんどがclassic typeであるが、large cell / anaplastic medulloblastomaの比率や診断時の転移/播種率が最も高い。
Group 4は最も頻度が高く(40%前後)、病理組織ではclassic typeがほとんどである。男性がほぼ3倍、小児期に85%が発生し、5年生存率は70%程度で、乳幼児期の治療成績が悪い。
今後はこれらの知見10, 11)に基づいた臨床試験が行われ、手術・放射線治療(RT)・化学療法(CHT)の有効性が分子亜型ごとに示され変化していく可能性がある。本ガイドラインで取り上げた臨床試験や症例報告の多くは、上記の分子生物学的知見は考慮されたものでないことに注意する必要がある。
|

|
| |
|
表1 WHO 2016脳腫瘍分類によるMedulloblastoma の亜型(variants)
|
| |
|
| Medulloblastomas, genetically defined(分子/遺伝子分類) |
| ・Medulloblastoma, WNT-activated(WNTシグナル伝達経路活性型) |
| ・Medulloblastoma, SHH-activated and TP53-mutant |
| (SHH シグナル伝達経路活性化, TP53遺伝子変異型) |
| ・Medulloblastoma, SHH-activated and TP53-wildtype |
| (SHH シグナル伝達経路活性化, TP53遺伝子変異なし) |
| ・Medulloblastoma, non-WNT / non-SHH(WNT および SHH 型に属さない型) |
| Medulloblastoma, group3 |
| Medulloblastoma, group4 |
| Medulloblastomas, histologically defined(病理組織分類) |
| ・Medulloblastoma, classic(クラシック型) |
| ・Desmoplastic nodular medulloblastoma(線維形成結節性) |
| ・Medulloblastoma with extensive nodularity(高度結節性) |
| ・Large cell / anaplastic medulloblastoma(大細胞性、あるいは退形成性) |
| Medulloblastoma, NOS |
|

|
| |
|
(4)治療と予後
本腫瘍の治療は集学的治療(手術摘出と化学放射線療法)が原則であり、予後は治療法の発展により改善し、5年生存率は50-70%となっている。3, 4) すでに述べたように、乳幼児(<3歳)、小児(3〜17歳)および成人(18歳以上)で各々の病態が異なり、組織型、分子生物学的分類、手術摘出度、播種などが予後に相関があると考えられているため、これらの特徴を踏まえて治療計画が立案される。臨床的には、年齢、播種の有無、摘出量からの臨床リスク分類が用いられる。12-16) すなわち、①診断時の年齢が3歳未満、②術後のMRIにおける残存腫瘍面積が1.5cm2以上、③髄腔内播種所見あり、により高リスク群(high-risk group)と標準リスク群(average-risk group)に大別する。標準リスク群は①-③のいずれにも該当しないグループ、高リスク群は①-③のいずれかに該当するグループとなる。さらに①の3歳未満の症例では当面の放射線治療(RT)を回避する治療計画が立てられる。(表2)
|

|
| |
|
表2:髄芽腫の臨床リスク分類
|
| |
|
| 臨床リスク分類 |
高リスク群
(high-risk) |
以下のいずれか
① 3歳未満
・3歳以上で、下記②③の一つでも欠けるもの |
標準リスク群
(average-risk) |
以下の条件を全て満たす
・3歳以上
②手術にてほぼ全摘出(最大断面1.5 ㎠以下)
③髄液細胞診陰性かつ転移・播種なし |
|

|
| |
|
(5)診療の全体的な流れ
術前診断では、後頭蓋窩発生の上衣腫や毛様細胞性星細胞腫、atypical teratoid/rhabdoid tumor (AT/RT)との鑑別が難しい例がある。小脳半球に発生した場合、他のグリオーマ系腫瘍との鑑別が問題となる。
術前診断後に、合併する水頭症に対する緊急の処置が必要な例がある。
摘出後の治療方針に関しては、臨床リスク分類に応じて化学療法(CHT)と放射線治療(RT)を組み合わせた治療を行う。このうち、3歳未満群では放射線治療を極力回避し、化学療法を選択する。
|

|
| |
|
| |
|
| 参考文献
|
| 1) |
Louis DN, Ohgaki H, Wiestler OD, et al. WHO Classification of Tumours of the Central Nervous System. Lyon:International Agency for Research on Cancer;2016. |
|
| 2) |
Bailey P, Cushing H. A classification of tumors of the glioma group on a histogenetic basis with a correlation study of prognosis. Philadelphia:Lippincott;1926. |
|
| 3) |
Ostrom QT, Cioffi G, Gittleman H, et al. CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2012-2016. Neuro Oncol. 2019;21(Suppl 5):v1-v100.. |
|
| 4) |
The committee of Brain Tumor Registry of Japan: Report of Brain Tumor Registry of Japan(2005-2008)14th ed. Neurol med Chir(Tokyo). 2017; 57(Suppl 1):9-102. |
|
| 5) |
Meyers SP, Kemp SS, Tarr RW. MR imaging features of medulloblastomas. AJR Am J Roentgenol. 1992;158(4):859-65. |
|
| 6) |
Bühring U, Strayle-Batra M, Küker W, et al. MRI features of primary, secondary and metastatic medulloblastoma. Eur Radiol. 2002;12(6):1342-8. |
|
| 7) |
Perreault S, Ramaswamy V, Achrol AS, et al. MRI surrogates for molecular subgroups of medulloblastoma. AJNR Am J Neuroradiol. 2014;35(7):1263-9. |
|
| 8) |
Northcott PA, Jones DT, et al. Medulloblastomics: the end of the beginning. Nat Rev Cancer. 2012;12(12):818-34. |
|
| 9) |
Taylor MD, Northcott PA, Korshunov A, et al. Molecular subgroups of medulloblastoma: the current consensus. Acta Neuropathol. 2012;123(4):465-72. |
|
| 10) |
Kool M, Korshunov A, Remke M, et al. Molecular subgroups of medulloblastoma: an international meta-analysis of transcriptome, genetic aberrations, and clinical data of WNT, SHH, Group 3, and Group 4 medulloblastomas. Acta Neuropathol. 2012;123(4):473-84.. |
|
| 11) |
Gajjar A, Bowers DC, Gottardo NG, et al. Pediatric Brain Tumors: Innovative Genomic Information Is Transforming the Diagnostic and Clinical Landscape. J Clin Oncol. 2015;33(27):2986-98. |
|
| 12) |
Chang CH, Housepian EM, Herbert C, Jr. An operative staging system and a megavoltage radiotherapeutic technic for cerebellar medulloblastomas. Radiology. 1969;93(6):1351-9. |
|
| 13) |
Albright AL, Wisoff JH, Stanley P, et al. Effects of medulloblastoma resections on outcome in children: a report from the Children's Cancer Group. Neurosurgery. 1996;38(2):265-71. |
|
| 14) |
Zeltzer PM, Boyett JM, Finlay JL, et al. Metastasis stage, adjuvant treatment, and residual tumor are prognostic factors for medulloblastoma in children: conclusions from the Children's Cancer Group 921 randomized phase III study. J Clin Oncol. 1999;17(3):832-45. |
|
| 15) |
Packer RJ, Sutton LN, Elterman R, et al. Outcome for children with medulloblastoma treated with radiation and cisplatin, CCNU, and vincristine chemotherapy. J Neurosurg. 1994;81(5):690-8. |
|
| 16) |
Packer RJ, Boyett JM, Janss AJ, et al. Growth hormone replacement therapy in children with medulloblastoma: use and effect on tumor control. J Clin Oncol. 2001;19(2):480-7. |
|
|

|
| 目次へ戻る!
|

|
| 2. 髄芽腫のスコープの作成
|

|
| |
1) 診療ガイドラインがカバーする内容に関する事項
|
| |
|
| (1) |
タイトル:髄芽腫の診療ガイドライン |
| (2) |
目的:生命予後、機能予後、QOLの改善 |
| (3) |
トピック:生命予後、機能予後、QOLの改善 |
| (4) |
想定される利用者、利用施設:小児脳腫瘍(15歳未満及び16-29歳のAdolescent and Young Adult: AYA世代を含めた年齢)を診療する医療者や施設、患者・家族 |
| (5) |
既存ガイドラインとの関係:日本では既存のガイドラインは作成されていない。 |
| (6) |
臨床的課題
課題1:手術摘出
課題2:神経認知機能を含む機能的予後と生命予後の向上
課題3:放射線治療
課題4:陽子線治療
課題5:化学療法
課題6:再発時の治療
課題7:治療による晩期障害
|
| (7) |
ガイドラインがカバーする範囲
|
| |
a) |
髄芽腫
|
| |
b) |
厚生労働省から示された小児がんとしてみなされる年齢(15歳未満及び16-29歳のAYA世代を含めた年齢)
|
| (8) |
CQリスト
|
| |
| 課題1:手術摘出 |
| |
CQ1: |
肉眼的全摘出は生命予後を改善するか?
|
| 課題2:神経認知機能を含む機能的予後と生命予後の向上 |
| |
CQ2: |
手術後の予後予測因子は何か?
|
| 課題3:放射線治療 |
| |
CQ3: |
全脳脊髄照射において、各リスク群における標準線量からの線量低減または線量増加は有用か?
|
| 課題4:陽子線治療 |
| |
CQ4: |
放射線治療として陽子線治療は推奨されるか?
|
| 課題5:化学療法 |
| |
CQ5: |
3歳以上の標準リスク群にはどのような術後治療が推奨されるか?
|
| |
CQ6: |
3歳以上の高リスク群にはどのような術後治療が推奨されるか?
|
| |
CQ7: |
3歳未満の群にはどのような術後治療が推奨されるか?
|
| 課題6:再発時の治療 |
| |
CQ8: |
局所再発時の適切な治療法は何か?
|
| |
CQ9: |
播種再発に対する適切な治療法は何か?
|
| 課題7: 治療による晩期障害 |
| |
CQ10: |
髄芽腫に特徴的な晩期障害とそれをきたしやすい背景因子は何か?
|
|
|

|
| |
2) システマティックレビューに関する事項
|
| |
|
| (1) |
実施スケジュール
文献検索:2カ月
文献の選出:3カ月
エビデンス総体の評価と統合:4カ月
|
| (2) |
エビデンスの検索
|
| |
① |
エビデンスタイプ
|
| |
|
・ |
既存のガイドライン: なし
|
| |
|
・ |
個別研究論文:ランダム化比較試験はなく、非ランダム化比較試験、観察研究のみならず症例報告も検索対象にする。
|
| |
② |
データベース
|
| |
|
・ |
個別研究論文:PubMed
|
| |
③ |
検索方法
|
| |
|
・ |
介入の検索に関してはPICOフォーマットを用いる。
|
| |
④ |
検索対象期間
|
| |
|
・ |
すべてのデータベースで2019年6月まで
|
| (3) |
文献の選択基準、除外項目
採択条件を満たす観察研究がない場合、システマティックレビューは実施しない。
|
| (4) |
エビデンスの評価と統合の方法
エビデンス総体の強さの評価は「Minds作成手引き2014」の方法に基づく。
エビデンス総体の統合は質的な統合を基本とし、適切な場合は量的統合を実施。
|
|

|
| 目次へ戻る!
|

|
| (Ⅵ)推奨
|

|
| 課題1:手術摘出
|

|
| |
CQ1 肉眼的全摘出は生命予後を改善するか?
|
| |
推奨
髄芽腫患者に対して全摘出を行うことを提案する。(推奨度2C)
|
|

|
| |
解 説
|
| |
|
髄芽腫に対する手術摘出度あるいは残存腫瘍量と予後の関係を前方視的試験によって解析した研究はない。1996年にAlbrightら1)が、術者が評価した腫瘍摘出度は予後に相関しないものの、術後残存腫瘍の最大面積が1.5cm2以上あると、髄液播種のみられない3歳以上の症例ではprogression-free survival(PFS)が短くなることを報告した。その後Zelterら2)は術後残存腫瘍の最大面積1.5cm2以上を予後因子に加えることを提唱し、髄液播種、年齢が3歳以上、術後腫瘍残存量(最大断面面積1.5cm2以上)を予後不良因子として、標準リスク群と高リスク群の臨床病期分類に従って髄芽腫の治療を行うことが現在の標準となっている。(AlbrightとZelterの論文は全生存期間(overall survival: OS)の検討がされていないことから、システマティックレビューからは除外された。)手術摘出度が真の予後因子であるのかについての検討は、症例集積あるいは後方視的コホート研究で検討する他ない。
2000年にJenkinら3)は、単一施設の連続173例の後方視的検討で、2回の手術を要した症例も含めた最終的な摘出率において、全摘出77例、亜全摘(摘出率:90-99%)50例、部分摘出(摘出率:50-89%)30例、部分摘出(摘出率:50%未満)16例の5年生存率はそれぞれ63%、50%、41%、17%と報告した。この摘出度は術者が決定しており、全摘出群は非全摘出群と比較して有意に(p = 0.002)OSを延長したが、摘出後に標準的な放射線治療が遂行可能であった場合には、全摘出は有意な予後因子とはならなかった。したがって全摘出により合併症を起こす可能性が高い場合は、術後の合併症によって放射線治療を省略するよりはむしろ摘出を制限することも考慮すべきであると結論づけた。
2005年のFrench Society of Pediatric Oncology (SFOP)4)の多施設共同研究では、術後3日以内の画像検査で確認された残存・転移のない群(R0M0)47例について検討された。この報告では手術記録で摘出度を決定しており、残存腫瘍はないと記載されていれば全摘出とし、癒着が強く切除できなかったと記載があれば術後の画像検査で残存腫瘍を認めなくても全摘出とはせずに亜全摘出と定義した。亜全摘出群34例の5年PFSは0%であったのに対して全摘出群13例では41%と有意に延長した(p = 0.0065)ものの、OSでは有意差はなかったとした。このように、摘出度を画像検査だけではなく、手術記録に基づいてのリスク階層化を導入している点で結果の解釈には注意が必要である。
2006年のUrberuagaら5)の単一施設79例の検討では、術後画像検査で残存腫瘍がないことを全摘出と定義し、単変量解析でOS、PFS共に全摘出が予後良好因子であり、多変量解析でも予後良好因子(HR = 3.17 95% CI: 1.64-6.15, p < 0.01)であったと報告した。
一方で、2008年のAkyüzら6)の単一施設の203例の後方視的検討では、手術摘出度は生存期間に影響しなかったと報告した。
このように、手術的摘出度の予後に対する影響は報告によってばらつきがみられる。しかし、これまでの報告全体としては、全摘出した場合にはOSもPFSも延長する傾向があることは確かである。ただし、手術によって神経症状を悪化させる危険性が高い場合には、無理に全摘出を行うことは控え、術後速やかに放射線治療を行うことが重要である。
2016年のThompson, Taylorら7)の787例の後方視的国際共同研究では、分子的亜型分類が組み込まれた。全摘出の予後因子としての効果は、多変量解析に分子的亜型分類を含めると大きく減衰した。全摘出は、術後腫瘍残存量が1.5cm2以上と比較してPFSは延長した(HR = 1.45 95% CI: 1.07-1.95, p = 0.02)が、全摘出と術後腫瘍残存量1.5 cm2未満ではOS、PFS共に有意差はみられなかった(OS/ HR = 1.05 95% CI: 0.71–1.53, p=0.82, PFS/ HR = 1.14 95% CI: 0.75–1.72, p=0.55)。WNT, SHH, group 3では、全摘出してもOSに影響がなかった。術後腫瘍残存量1.5 cm2未満に対する全摘出の絶対的利点はないため、神経学的悪化が予測される場合には、小さな残存腫瘍に対する手術摘出は勧められないというこれまでの方針を支持するものである。
分子的亜型分類を加味したエビデンスの構築が希求されており、分子亜型それぞれにおいて手術摘出度が生命予後にどのような影響を及ぼすかについては、現在も重要な臨床課題である。
|

|
| |
|
CQ1:検索式
|
| |
|
| ((((((("Epidemiologic Study Characteristics"[Mesh]) OR "Statistics as Topic"[Mesh])) OR "clinical study"[PT])) AND ((((((((((medulloblastoma[mh]) OR medulloblastoma*[tiab]) OR ((melanocytic[tiab] AND medulloblastoma*[tiab]))) OR ((childhood[tiab] AND medulloblastoma*[tiab]))) OR medulloblastoma*[tiab]) OR ((desmoplastic[tiab] AND medulloblastoma*[tiab]))) OR ((adult[tiab] AND medulloblastoma*[tiab])))) AND ((surgery[SH] OR surgery[TIAB] OR surgical[TIAB] OR "surgical procedures, operative"[MH] OR (surgical[TIAB] AND procedure*[TIAB] AND operative[TIAB]) OR operative[TIAB] OR operation[TIAB] OR resect*[TIAB]))) AND ((prognosis[MH] OR prognos*[TIAB] OR "disease progression"[MH] OR (disease*[TIAB] AND progress*[TIAB]) OR (disease*[TIAB] AND exacerbat*[TIAB]) OR mortality[MH] OR mortal*[TIAB] OR (case*[TIAB] AND fatality[TIAB] AND rate*[TIAB]) OR (death[TIAB] AND rate*[TIAB]) OR "survival analysis"[MH] OR (surviv*[TIAB] AND (analysis[TIAB] OR analyses[TIAB])) OR "neoplastic processes"[MH] OR (neoplastic[TIAB] AND process*[TIAB])))))) AND 1900/1/1: 2018/12/31 [DP]
|
| 以上の検索式により662の文献を抽出し、一次スクリーニングで69文献を抽出し、二次スクリーニングを行った。最終的に17文献にまで絞り込み、Minds 2014に基づいて定性的システマティックレビューを行った。システマティックレビュー後のさらなる検討から7文献を採用し、作成した評価シートからエビデンス総体を導き出して、それらに基づいて推奨と解説文を作成した。
|
|

|
| |
|
| |
|
| 参考文献
|
| 1) |
Albright AL, Wisoff JH, Stanley P, et al. Effects of medulloblastoma resections on outcome in children: a report from the Children's Cancer Group. Neurosurgery. 1996;38(2):265-71. |
|
| 2) |
Zeltzer PM, Boyett JM, Finlay JL, et al. Metastasis stage, adjuvant treatment, and residual tumor are prognostic factors for medulloblastoma in children: conclusions from the Children's Cancer Group 921 randomized phase III study. J Clin Oncol. 1999;17(3):832-45. |
|
| 3) |
Jenkin D, Shabanah MA, Shail EA, et al. Prognostic factors for medulloblastoma. Int J Radiat Oncol Biol Phys. 2000;47(3):573-84. |
|
| 4) |
Grill J, Sainte-Rose C, Jouvet A, et al. Treatment of medulloblastoma with postoperative chemotherapy alone: an SFOP prospective trial in young children. Lancet Oncol. 2005;6(8):573-80. |
|
| 5) |
Urberuaga A, Navajas A, Pijoán JI, et al. A review of clinical and histological features of Spanish paediatric medulloblastomas during the last 21 years. Childs Nerv Syst. 2006;22(5):466-74. |
|
| 6) |
Akyüz C, Varan A, Küpeli S, et al. Medulloblastoma in children: a 32-year experience from a single institution. J Neurooncol. 2008;90(1):99-103. |
|
| 7) |
Thompson EM, Hielscher T, Bouffet E, et al. Prognostic value of medulloblastoma extent of resection after accounting for molecular subgroup: a retrospective integrated clinical and molecular analysis. Lancet Oncol. 2016;17(4):484-95. |
|
|

|
| 目次へ戻る!
|

|
| 課題2:神経認知機能を含む機能的予後と生命予後の向上
|

|
| |
CQ2: 手術後の予後因子は何か?
|

|
| |
推奨
予後因子として、組織型(予後良好な順でdesmoplastic nodular/ extensive nodularity、classic、large cell/anaplastic)、転移の有無(転移有が予後不良)、遺伝子プロファイルで分類される亜型(WNT型が予後良好)を用いることを推奨する。(推奨度1B)
|
|

|
| |
解 説
|

|
| |
|
予後を予測する因子は実施する治療によって変わる。例えば、治療が摘出のみであれば、当然転移の有無と残存した腫瘍の大きさがOSに大きな影響を与える。また、放射線治療の導入、さらに有効な化学療法の採用によって予後因子は変化している。最新の治療を受けたコホートでは、後述の4型の亜群によっては転移の有無すら予後を反映しない可能性が最近示されている1-3)。このように、リスク因子は解析対象としたコホートの治療によって変化するものであるので、本CQではこれらの違いがあってもなおかつ検出される因子を採用することとした。
治療の層別化に用いる予後因子としては、治療反応性などではなく、診断後直ちに情報が得られる臨床情報(年齢、性別、転移の有無、病理組織型、術後腫瘍残存の有無など)が有用である。しかし、これらの因子は交絡が存在するため、多変量解析による結果が最も重要視される。ほぼ全ての研究で予後因子として多変量解析で抽出されているのが、転移の有無、および組織型(classic, desmoplastic nodular, large cell/anaplastic)であった2, 4-12)。一方、性別、年齢は解析されたほとんどの研究で予後因子とはならなかった1, 2, 6, 8, 11,13)。術後の腫瘍残存については、多変量解析が行われた9件の解析のうち2件で予後不良因子として抽出され7, 13)、1件では単変量解析では有意であったものの、多変量解析では有意差は消失している11)。また、乳幼児に限定した解析では、単変量解析のみが行われた3件の報告では予後不良因子として抽出されているが14-16)、多変量解析を行った4件の報告では3件で予後因子として否定されている4-6)。以上のことから、現時点では独立した強力な予後因子として組織型、転移の有無をあげることができる。組織型では、desmoplastic nodular/ extensive nodularityが最も予後がよく、classic、large cell/anaplasticと続く。転移の有無では転移無が予後良好である。
2011年に遺伝子発現プロファイルに基づき、髄芽腫は少なくともWNT型、SHH型、non-WNT/non-SHH型に分類されることが明らかとなり、2016年のWHO脳腫瘍分類でも採用されている2)。後者はさらにGroup 3とGroup 4に分類されることもある。これまでのところ、過去に集積された症例を世界中から集めた後方視的なコホートを用いた解析のデータにとどまるが、一貫してWNT型が最も予後良好である。残りの2群もしくは3群間の予後の差はさほど顕著なものではない5)。しかし、基本的にWNT型が存在しない乳幼児例に限定しての解析では、単変量解析ながら3件の全ての解析でSHH型が予後良好であることが示されている3, 16, 17)。SHH型の多くは上記に予後良好因子として記載したdesmoplastic nodular/ extensive nodularityの組織型を有するため、多変量解析での検討が必要である。上記の3型(または4型)分類とは別個に、MYC遺伝子の増幅が独立した予後不良因子であることが報告されている。しかし、その後4型分類と組み合わせた解析ではGroup 3以外では明らかではないことが示されている18)。
上述のように、髄芽腫は少なくとも3種類以上の異なった疾患(亜群)からなる集合体であることから、現在はそれぞれの亜群の中での予後因子が提唱されているものの3, 19, 20)、現時点では十分検証されたとまでは言えないため、今回各亜群別の予後因子の推奨は時期尚早と判断した。以上のことから、独立した強力な予後因子として、組織型、転移の有無、遺伝子プロファイルによる分類(WNT型とそれ以外)を推奨する。
|

|
| |
|
CQ2:検索式
|
| |
|
| (((((((Medulloblastoma[Mesh] OR Medulloblastoma*[tiab] OR Melanocytic Medulloblastoma*[tiab] OR Childhood Medulloblastoma*[tiab] OR Medullomyoblastoma*[tiab] OR Desmoplastic Medulloblastoma*[tiab]))) AND (((((("Combined Modality Therapy"[Mesh:NoExp] OR Chemoradiotherapy[mh] OR Chemotherapy, Adjuvant[mh] OR Radiotherapy, Adjuvant[mh]))) OR ((Adjuvant[tiab] AND (Chemoradiotherapy[tiab] OR Chemoradiotherapies[tiab] OR Radiochemotherapy[tiab] OR Radiochemotherapies[tiab] OR Radiochemotherapy[tiab] OR Radiochemotherapies[tiab] OR chemothrapy[tiab] OR chemotherapies[tiab] OR radiotherapy[tiab] OR radiotherapies[tiab] OR "drug therapy"[tiab] OR "drug therapies"[tiab])))) OR (((Multimodal[tiab] AND (Treatment[tiab] OR treatments[tiab] OR therapy[tiab] OR therapies[tiab])) OR ("Combined Modality"[tiab] AND (therapy[tiab] OR therapies[tiab])) OR ((Concurrent[tiab] OR Concomitant[tiab] OR Synchronous[tiab]) AND (Chemoradiotherapy[tiab] OR Chemoradiotherapies[tiab] OR Radiochemotherapy[tiab] OR Radiochemotherapies[tiab]))))) OR ((therapy planning[tiab] OR therapeutic planning[tiab] OR therapeutic design[tiab] OR treatment design[tiab] OR plan[tiab] OR planning[tiab]))))) AND (("Epidemiologic Study Characteristics"[MH] OR "Statistics as Topic"[Mesh] OR "Clinical Study"[Publication Type])))) AND 1900/01/01:2018/12/31[dp]
|
| 以上の検索式により556の文献を抽出し、一次スクリーニングで37文献を抽出し、二次スクリーニングを行った。最終的に20文献にまで絞り込み、Minds 2014に基づいて定性的システマティックレビューを行った。作成した評価シートからエビデンス総体を導き出して、それらに基づいて推奨と解説文を作成した。
|
|

|
| |
|
| |
|
| 参考文献
|
| 1) |
Fernandez-Teijeiro A, Betensky RA, Sturla LM, et al. Combining gene expression profiles and clinical parameters for risk stratification in medulloblastomas. J Clin Oncol. 2004;22(6):994-8.
|
|
| 2) |
Northcott PA, Korshunov A, Witt H, et al. Medulloblastoma comprises four distinct molecular variants. J Clin Oncol. 2011;29(11):1408-14.
|
|
| 3) |
Kool M, Korshunov A, Remke M, et al. Molecular subgroups of medulloblastoma: an international meta-analysis of transcriptome, genetic aberrations, and clinical data of WNT, SHH, Group 3, and Group 4 medulloblastomas. Acta Neuropathol. 2012;123(4):473-84.
|
|
| 4) |
Rutkowski S, Bode U, Deinlein F, et al. Treatment of early childhood medulloblastoma by postoperative chemotherapy alone. N Engl J Med. 2005;352(10):978-86.
|
|
| 5) |
Rutkowski S, Gerber NU, von Hoff K, et al. Treatment of early childhood medulloblastoma by postoperative chemotherapy and deferred radiotherapy. Neuro Oncol. 2009;11(2):201-10.
|
|
| 6) |
Ashley DM, Merchant TE, Strother D, et al. Induction chemotherapy and conformal radiation therapy for very young children with nonmetastatic medulloblastoma: Children's Oncology Group study P9934. J Clin Oncol. 2012;30(26):3181-6.
|
|
| 7) |
Rutkowski S, von Hoff K, Emser A, et al. Survival and prognostic factors of early childhood medulloblastoma: an international meta-analysis. J Clin Oncol. 2010;28(33):4961-8.
|
|
| 8) |
Lamont JM, McManamy CS, Pearson AD, et al. Combined histopathological and molecular cytogenetic stratification of medulloblastoma patients. Clin Cancer Res. 2004;10(16):5482-93.
|
|
| 9) |
Ellison DW, Kocak M, Dalton J, et al. Definition of disease-risk stratification groups in childhood medulloblastoma using combined clinical, pathologic, and molecular variables. J Clin Oncol. 2011;29(11):1400-7.
|
|
| 10) |
Hoff KV, Hinkes B, Gerber NU, et al. Long-term outcome and clinical prognostic factors in children with medulloblastoma treated in the prospective randomised multicentre trial HIT'91. Eur J Cancer. 2009;45(7):1209-17.
|
|
| 11) |
Michiels EM, Heikens J, Jansen MJ, et al. Are clinical parameters valuable prognostic factors in childhood primitive neuroectodermal tumors? A multivariate analysis of 105 cases. Radiother Oncol. 2000;54(3):229-38.
|
|
| 12) |
Ryan SL, Schwalbe EC, Cole M, et al. MYC family amplification and clinical risk-factors interact to predict an extremely poor prognosis in childhood medulloblastoma. Acta Neuropathol. 2012;123(4):501-13.
|
|
| 13) |
Lannering B, Rutkowski S, Doz F, et al. Hyperfractionated versus conventional radiotherapy followed by chemotherapy in standard-risk medulloblastoma: results from the randomized multicenter HIT-SIOP PNET 4 trial. J Clin Oncol. 2012;30(26):3187-93.
|
|
| 14) |
von Bueren AO, von Hoff K, Pietsch T, et al. Treatment of young children with localized medulloblastoma by chemotherapy alone: results of the prospective, multicenter trial HIT 2000 confirming the prognostic impact of histology. Neuro Oncol. 2011;13(6):669-79.
|
|
| 15) |
Grill J, Sainte-Rose C, Jouvet A, et al. Treatment of medulloblastoma with postoperative chemotherapy alone: an SFOP prospective trial in young children. Lancet Oncol. 2005;6(8):573-80.
|
|
| 16) |
Lafay-Cousin L, Smith A, Chi SN, et al. Clinical, Pathological, and Molecular Characterization of Infant Medulloblastomas Treated with Sequential High-Dose Chemotherapy. Pediatr Blood Cancer. 2016;63(9):1527-34.
|
|
| 17) |
Robinson GW, Rudneva VA, Buchhalter I, et al. Risk-adapted therapy for young children with medulloblastoma (SJYC07): therapeutic and molecular outcomes from a multicentre, phase 2 trial. Lancet Oncol. 2018;19(6):768-84.
|
|
| 18) |
Shih DJ, Northcott PA, Remke M, et al. Cytogenetic prognostication within medulloblastoma subgroups. J Clin Oncol. 2014;32(9):886-96.
|
|
| 19) |
Schwalbe EC, Lindsey JC, Nakjang S, et al. Novel molecular subgroups for clinical classification and outcome prediction in childhood medulloblastoma: a cohort study. Lancet Oncol. 2017;18(7):958-71.
|
|
| 20) |
Sharma T, Schwalbe EC, Williamson D, et al. Second-generation molecular subgrouping of medulloblastoma: an international meta-analysis of Group 3 and Group 4 subtypes. Acta Neuropathol. 2019;138(2):309-26.
|
|
|

|
| 目次へ戻る!
|

|
| 課題3:放射線治療
|

|
| |
CQ3:全脳脊髄照射において、各リスク群における標準線量からの線量低減または線量増加は有用か?
|

|
| |
推奨1
全脳脊髄照射において、標準リスク群に対して標準線量(24Gy程度)からの線量低減を行わないことを推奨する。(推奨度 1D)
|
推奨2
全脳脊髄照射において、高リスク群に対して標準線量(36Gy程度)からの線量増加を行わないことを推奨する。(推奨度 1D)
|
|

|
| |
解 説
|

|
| |
|
3歳以上の髄芽腫に対する集学的治療において全脳脊髄照射(craniospinal irradiation; CSI)は必要不可欠であり、標準治療の一環として、CSIと後頭蓋窩または腫瘍床へのブースト照射(総線量54 Gy程度)が通常分割照射法を用いて実施されている。現在、標準的なCSI線量として、標準リスク群では24 Gy程度(23.4 Gy/13分割が頻用されている)、高リスク群では36 Gy程度(35.2-36 Gy/20-22分割)が用いられている(詳細はCQ5、6参照) 。標準リスク群に対する晩期障害軽減を目的としたCSI線量低減、また高リスク群に対する治療成績改善を目的としたCSI線量増加が試みられているが、現時点におけるそれらの意義や位置づけは確立していない。
<推奨1:標準リスク群に対する標準線量(24Gy程度)からのCSI線量低減について>
評価対象となった22編1-22)中、標準線量未満のCSIが実施された試験は2編のみであったが、そのうち1編は18 GyのCSIを実施された症例が全88例中11例(うち陽子線治療が3例)と少なく1)、残りの1編は18 GyE(陽子線治療)のCSI実施症例が含まれていたものの、18 GyEのCSIが実施された症例数は不明であった7)。なお、急性期有害事象、成長障害に関しては標準線量未満のCSIを実施した論文は認められなかった。
一般論としてCSI線量低減により急性期および晩期障害のリスク低減が期待されるものの、上述したように標準リスク群に対するCSI線量低減の有用性を検証するランダム化比較試験もしくは傾向スコア・マッチング研究は存在せず、併用化学療法の有無や種類・タイミングに深刻なばらつきを認めたため、CSI線量低減による生存率および急性期・晩期障害に対する影響の評価は極めて困難であった。また化学療法に関しては、本邦において使用できないCCNU(ロムスチン)が含まれるレジメンが散見された。これらのバイアスリスク、非直接性を考慮した結果エビデンスの強さは非常に弱いと判断された。
上記システマティックレビューの結果から、CSI線量低減が生存率および急性期・晩期障害に及ぼす影響を評価することは困難であった。またCSI線量低減により急性期・晩期障害のリスク低減が得られる可能性は期待されるものの、生存率の維持が可能と判断する根拠に乏しく、線量低減に伴う生存率低下のリスクが危惧される。そのため、現状ではCSIにおいて、標準リスク群に対して標準線量からの線量低減を行わないことを提案することが妥当と判断した。
なお、システマティックレビュー対象外の文献ではあるが、2021年6月にACNS033123)が出版されたため、重要文献として本ガイドラインに記載する。ACNS0331は標準リスク群に対してブースト照射として後頭蓋照射を実施する群と、腫瘍床照射を実施する群にランダム化割付し検証した第3相試験である。さらに本試験では3~7歳の226例に対してCSI線量を23.4 Gy群と18 Gy群にランダム化割付し、primary endpointであるevent-free survival (EFS)を検証した。その結果、認知機能は23.4 Gy群において有意に低下したものの、5年時点でのEFSは23.4 Gy群では82.9 %、18 Gy群では71.4%であり、18 Gy群は23.4 Gy群と比較してEFSが有意に短かった(p = 0.028, hazard ratio, 1.67%; 80% upper CI, 2.10)。また5年時点でのoverall survival (OS)は23.4 Gy群では85.6 %、18 Gy群では77.5 %であり、18 Gy群は23.4 Gy群と比較してOSが有意に短く(p = 0.049)、今回の推奨を支持する結果であった。
<推奨2: 高リスク群に対する標準線量(36 Gy程度)からのCSI線量増加について>
二次スクリーニング後の35編の論文のうち、対象が高リスク群かつ設定されたアウトカムに関する記載がなされている論文は11編であった。11編中、4編(POG963124) 、HIT200025)、 POG903126)、SJMG-9612))において標準線量よりも高いCSI線量が用いられていた。生存率では9編4, 7, 12, 24-29)、急性期有害事象では7編12, 24-27, 29, 30)、2次発がんは4編4,18,26,29)、精神・認知機能障害では1編7)、聴力障害では4編7, 25, 27, 30)、内分泌機能障害では1編7)が評価対象となり、成長障害に関しては該当する論文を認めなかった。CSI線量増加により2次発がんの発生率は同等かつ生存率を改善する可能性が示唆されたが、上述したように高リスク群に対する線量増加群 vs. 標準線量群の治療成績を検証するランダム化比較試験もしくは傾向スコア・マッチング研究が存在せず、高リスクである定義や根拠、化学療法の有無・種類・タイミングに深刻なばらつきを認めたため、線量増加による生存率および急性期・晩期障害の評価は極めて困難であった。また化学療法に関しては本邦において使用できないCCNUが含まれるレジメンが散見された。そのため、すべてのアウトカムにおいて、深刻なバイアスリスク・非直接性が存在し、エビデンスの強さは非常に弱いと判断された。
上記システマティックレビューの結果から、線量増加に伴い益(生存率の改善)を得られる可能性は否定できないが、同時に害(晩期障害の増加)も危惧された。小児がんである髄芽腫患者において、治癒が得られた際に生活の質(QOL)の低下・社会生活の妨げとなる害(晩期障害の増加)を考慮する必要性は極めて高い。エビデンスレベルが非常に弱い現状においては、益よりも害を考慮し、CSIにおいて、高リスク群に対して標準線量からの線量増加を行わないことを提案することが妥当と判断した。
|

|
| |
注意:
|
| |
|
|
ロムスチン(lomustine: CCNU):国内未承認
|

|
| |
|
CQ3:検索式
|
| |
|
| (((medulloblastoma) AND radiotherapy)) AND (Comparative Study[ptyp] OR Clinical Trial [ptyp]) AND 1900/01/01:2018/12/31[dp]
|
| 以上の検索式により241の文献を抽出し、一次スクリーニングで106文献を抽出し、二次スクリーニングを行った。最終的に35文献にまで絞り込み、Minds 2014に基づいて定性的システマティックレビューを行った。作成した評価シートからエビデンス総体を導き出して、それらに基づいて推奨と解説文を作成した。
|
|

|
| |
|
| |
|
| 参考文献
|
| 1) |
Eaton BR, Esiashvili N, Kim S, et al. Clinical Outcomes Among Children With Standard-Risk Medulloblastoma Treated With Proton and Photon Radiation Therapy: A Comparison of Disease Control and Overall Survival. Int J Radiat Oncol Biol Phys. 2016;94(1):133-8.
|
|
| 2) |
Carrie C, Muracciole X, Gomez F, et al. Conformal radiotherapy, reduced boost volume, hyperfractionated radiotherapy, and online quality control in standard-risk medulloblastoma without chemotherapy: results of the French M-SFOP 98 protocol. Int J Radiat Oncol Biol Phys. 2005;63(3):711-6.
|
|
| 3) |
Lannering B, Rutkowski S, Doz F, et al. Hyperfractionated versus conventional radiotherapy followed by chemotherapy in standard-risk medulloblastoma: results from the randomized multicenter HIT-SIOP PNET 4 trial. J Clin Oncol. 2012;30(26):3187-93.
|
|
| 4) |
Hoff KV, Hinkes B, Gerber NU, et al. Long-term outcome and clinical prognostic factors in children with medulloblastoma treated in the prospective randomised multicentre trial HIT'91. Eur J Cancer. 2009;45(7):1209-17.
|
|
| 5) |
Packer RJ, Gajjar A, Vezina G, et al. Phase III study of craniospinal radiation therapy followed by adjuvant chemotherapy for newly diagnosed average-risk medulloblastoma. J Clin Oncol. 2006;24(25):4202-8.
|
|
| 6) |
Packer RJ, Zhou T, Holmes E, et al. Survival and secondary tumors in children with medulloblastoma receiving radiotherapy and adjuvant chemotherapy: results of Children's Oncology Group trial A9961. Neuro Oncol. 2013;15(1):97-103.
|
|
| 7) |
Yock TI, Yeap BY, Ebb DH, et al. Long-term toxic effects of proton radiotherapy for paediatric medulloblastoma: a phase 2 single-arm study. Lancet Oncol. 2016;17(3):287-98.
|
|
| 8) |
Thomas PR, Deutsch M, Kepner JL, et al. Low-stage medulloblastoma: final analysis of trial comparing standard-dose with reduced-dose neuraxis irradiation. J Clin Oncol. 2000;18(16):3004-11.
|
|
| 9) |
Krischer JP, Ragab AH, Kun L, et al. Nitrogen mustard, vincristine, procarbazine, and prednisone as adjuvant chemotherapy in the treatment of medulloblastoma. A Pediatric Oncology Group study. J Neurosurg. 1991;74(6):905-9.
|
|
| 10) |
Sabel M, Fleischhack G, Tippelt S, et al. Relapse patterns and outcome after relapse in standard risk medulloblastoma: a report from the HIT-SIOP-PNET4 study. J Neurooncol. 2016;129(3):515-24. Epub 2016/07/18. doi: 10.1007/s11060-016-2202-1.
|
|
| 11) |
Taylor RE, Bailey CC, Robinson K, et al. Results of a randomized study of preradiation chemotherapy versus radiotherapy alone for nonmetastatic medulloblastoma: The International Society of Paediatric Oncology/United Kingdom Children's Cancer Study Group PNET-3 Study. J Clin Oncol. 2003;21(8):1581-91.
|
|
| 12) |
Gajjar A, Chintagumpala M, Ashley D, et al. Risk-adapted craniospinal radiotherapy followed by high-dose chemotherapy and stem-cell rescue in children with newly diagnosed medulloblastoma (St Jude Medulloblastoma-96): long-term results from a prospective, multicentre trial. Lancet Oncol. 2006;7(10):813-20.
|
|
| 13) |
Packer RJ, Goldwein J, Nicholson HS, et al. Treatment of children with medulloblastomas with reduced-dose craniospinal radiation therapy and adjuvant chemotherapy: A Children's Cancer Group Study. J Clin Oncol. 1999;17(7):2127-36.
|
|
| 14) |
Evans AE, Jenkin RD, Sposto R, et al. The treatment of medulloblastoma. Results of a prospective randomized trial of radiation therapy with and without CCNU, vincristine, and prednisone. J Neurosurg. 1990;72(4):572-82.
|
|
| 15) |
Kennedy C, Bull K, Chevignard M, et al. Quality of survival and growth in children and young adults in the PNET4 European controlled trial of hyperfractionated versus conventional radiation therapy for standard-risk medulloblastoma. Int J Radiat Oncol Biol Phys. 2014;88(2):292-300.
|
|
| 16) |
Tait DM, Thornton-Jones H, Bloom HJ, et al. Adjuvant chemotherapy for medulloblastoma: the first multi-centre control trial of the International Society of Paediatric Oncology (SIOP I). Eur J Cancer. 1990;26(4):464-9.
|
|
| 17) |
King AA, Seidel K, Di C, et al. Long-term neurologic health and psychosocial function of adult survivors of childhood medulloblastoma/PNET: a report from the Childhood Cancer Survivor Study. Neuro Oncol. 2017;19(5):689-98.
|
|
| 18) |
Bailey CC, Gnekow A, Wellek S, et al. Prospective randomised trial of chemotherapy given before radiotherapy in childhood medulloblastoma. International Society of Paediatric Oncology (SIOP) and the (German) Society of Paediatric Oncology (GPO): SIOP II. Med Pediatr Oncol. 1995;25(3):166-78.
|
|
| 19) |
Ris MD, Walsh K, Wallace D, et al. Intellectual and academic outcome following two chemotherapy regimens and radiotherapy for average-risk medulloblastoma: COG A9961. Pediatr Blood Cancer. 2013;60(8):1350-7.
|
|
| 20) |
Ris MD, Packer R, Goldwein J, et al. Intellectual outcome after reduced-dose radiation therapy plus adjuvant chemotherapy for medulloblastoma: a Children's Cancer Group study. J Clin Oncol. 2001;19(15):3470-6.
|
|
| 21) |
Mulhern RK, Kepner JL, Thomas PR, et al. Neuropsychologic functioning of survivors of childhood medulloblastoma randomized to receive conventional or reduced-dose craniospinal irradiation: a Pediatric Oncology Group study. J Clin Oncol. 1998;16(5):1723-8.
|
|
| 22) |
Câmara-Costa H, Resch A, Kieffer V, et al. Neuropsychological Outcome of Children Treated for Standard Risk Medulloblastoma in the PNET4 European Randomized Controlled Trial of Hyperfractionated Versus Standard Radiation Therapy and Maintenance Chemotherapy. Int J Radiat Oncol Biol Phys. 2015;92(5):978-85.
|
|
| 23) |
Michalski JM, Janss AJ, Vezina LG, et al. Children's Oncology Group Phase III Trial of Reduced-Dose and Reduced-Volume Radiotherapy With Chemotherapy for Newly Diagnosed Average-Risk Medulloblastoma. J Clin Oncol. 2021:Jco2002730 in press.
|
|
| 24) |
Esbenshade AJ, Kocak M, Hershon L, et al. A Phase II feasibility study of oral etoposide given concurrently with radiotherapy followed by dose intensive adjuvant chemotherapy for children with newly diagnosed high-risk medulloblastoma (protocol POG 9631): A report from the Children's Oncology Group. Pediatr Blood Cancer. 2017;64(6).
|
|
| 25) |
von Bueren AO, Kortmann RD, von Hoff K, et al. Treatment of Children and Adolescents With Metastatic Medulloblastoma and Prognostic Relevance of Clinical and Biologic Parameters. J Clin Oncol. 2016;34(34):4151-60.
|
|
| 26) |
Tarbell NJ, Friedman H, Polkinghorn WR, et al. High-risk medulloblastoma: a pediatric oncology group randomized trial of chemotherapy before or after radiation therapy (POG 9031). J Clin Oncol. 2013;31(23):2936-41.
|
|
| 27) |
Zeltzer PM, Boyett JM, Finlay JL, et al. Metastasis stage, adjuvant treatment, and residual tumor are prognostic factors for medulloblastoma in children: conclusions from the Children's Cancer Group 921 randomized phase III study. J Clin Oncol. 1999;17(3):832-45.
|
|
| 28) |
Taylor RE, Bailey CC, Robinson KJ, et al. Outcome for patients with metastatic (M2-3) medulloblastoma treated with SIOP/UKCCSG PNET-3 chemotherapy. Eur J Cancer. 2005;41(5):727-34.
|
|
| 29) |
Jakacki RI, Burger PC, Zhou T, et al. Outcome of children with metastatic medulloblastoma treated with carboplatin during craniospinal radiotherapy: a Children's Oncology Group Phase I/II study. J Clin Oncol. 2012;30(21):2648-53.
|
|
| 30) |
Kortmann RD, Kühl J, Timmermann B, et al. Postoperative neoadjuvant chemotherapy before radiotherapy as compared to immediate radiotherapy followed by maintenance chemotherapy in the treatment of medulloblastoma in childhood: results of the German prospective randomized trial HIT '91. Int J Radiat Oncol Biol Phys. 2000;46(2):269-79.
|
|
|

|
| 目次へ戻る!
|

|
| 課題4:陽子線治療
|

|
| |
CQ4: 放射線治療として陽子線治療は推奨されるか?
|

|
| |
推奨
放射線治療として陽子線治療を行うことを条件付きで提案する。(推奨度2D)
|
|

|
| |
解 説
|

|
| |
|
小児がんに対する陽子線治療が保険適用となったものの、現状ではアクセスが限られることが問題である。このような中、広く普及し従来標準的に用いられてきたX線治療に比し、陽子線治療の優位性を明らかにすることは重要である。そこで本クリニカルクエスチョンが設定された。
選択された12論文には、ランダム化比較試験をはじめとするエビデンスレベルの高い報告はなく定性的システマティックレビューを実施した。
各アウトカムの評価対象となった研究は、多くても4つ、ほとんどが観察研究(前向きまたは後ろ向きコホート研究)であったが、医療費のみモデル解析であった。
評価対象となった研究に基づくエビデンス総体の評価結果は、生存率1-4)、脳・脊髄障害5)については、陽子線治療とX線治療で明らかな差はなく、急性期有害事象6)、成長障害7)、 精神・認知機能障害1,4,8)、聴力障害1,4,9)、内分泌機能障害1,4,7)、については、陽子線治療はX線治療と比べて軽減できる可能性が示されたが、ほとんどの研究が非直接性・バイアスリスク・不精確さにおいて深刻またはとても深刻と判定されたため、エビデンスの強さは生存率、内分泌機能障害が弱い、それ以外は非常に弱いと判断された。また、医療費10-12)については、陽子線治療はX線治療と比べて低減できる可能性が示されたが、いずれもモデル解析である上に、モデル計算の根拠となる有害事象軽減のエビデンスの多くが非常に弱く、深刻な非直接性・バイアスリスク・不精確さがあるため、エビデンスの強さは非常に弱いと判断された。尚、2次発がん3,4)については、陽子線治療とX線治療の優劣は判断困難と考えられた。
放射線治療として陽子線治療を用いて、線量増加等の積極的に治療成績を改善する試みはなく、現在までの報告では治療成績はX線治療とほぼ同等であり、益(生存率の改善)が得られる可能性は少ない。一方、害(有害事象)を減らせる可能性があるということが示唆されるものの、そのエビデンスの強さは非常に弱い。また、陽子線治療施設数が少ないため、希望しても適切なタイミングでの治療を受けられない可能性がある。陽子線治療装置の導入・運用コストは高額である一方で医療費全体としては減らせる可能性が示唆されるものの、試算の根拠となる有害事象軽減に関するエビデンスの強さは前述のように非常に弱い。また、患者(家族)の医療費負担は発症が20歳未満であればX線治療と同じであるが、施設が近隣にない場合は移動や宿泊のコストが発生する。以上を総合的に判断した結果、希望するタイミングで治療を受けられる、施設が近隣にあるといった条件が合致する患者には陽子線治療を提案してもよいと考えた。
よって、本クリニカルクエスチョンに対する推奨は、「放射線治療として陽子線治療を条件付きで行うことを提案する(2D)」とした。
|

|
| |
|
CQ4:検索式
|
| |
|
| (proton AND (medulloblastoma OR craniospinal irradiation)) AND 1900/01/01:2018/12/31[dp]
|
| 以上の検索式により149の文献を抽出し、一次スクリーニングで35文献を抽出し、二次スクリーニングを行った。最終的に12文献にまで絞り込み、Minds 2014に基づいて定性的システマティックレビューを行った。作成した評価シートからエビデンス総体を導き出して、それらに基づいて推奨と解説文を作成した。
|
|

|
| |
|
| |
|
| 参考文献
|
| 1) |
Jimenez RB, Sethi R, Depauw N, et al. Proton radiation therapy for pediatric medulloblastoma and supratentorial primitive neuroectodermal tumors: outcomes for very young children treated with upfront chemotherapy. Int J Radiat Oncol Biol Phys. 2013;87(1):120-6.
|
|
| 2) |
Sethi RV, Giantsoudi D, Raiford M, et al. Patterns of failure after proton therapy in medulloblastoma; linear energy transfer distributions and relative biological effectiveness associations for relapses. Int J Radiat Oncol Biol Phys. 2014;88(3):655-63.
|
|
| 3) |
Eaton BR, Esiashvili N, Kim S, et al. Clinical Outcomes Among Children With Standard-Risk Medulloblastoma Treated With Proton and Photon Radiation Therapy: A Comparison of Disease Control and Overall Survival. Int J Radiat Oncol Biol Phys. 2016;94(1):133-8.
|
|
| 4) |
Yock TI, Yeap BY, Ebb DH, et al. Long-term toxic effects of proton radiotherapy for paediatric medulloblastoma: a phase 2 single-arm study. Lancet Oncol. 2016;17(3):287-98.
|
|
| 5) |
Giantsoudi D, Sethi RV, Yeap BY, et al. Incidence of CNS Injury for a Cohort of 111 Patients Treated With Proton Therapy for Medulloblastoma: LET and RBE Associations for Areas of Injury. Int J Radiat Oncol Biol Phys. 2016;95(1):287-96. 24.
|
|
| 6) |
Song S, Park HJ, Yoon JH, et al. Proton beam therapy reduces the incidence of acute haematological and gastrointestinal toxicities associated with craniospinal irradiation in pediatric brain tumors. Acta Oncol. 2014;53(9):1158-64.
|
|
| 7) |
Eaton BR, Esiashvili N, Kim S, et al. Endocrine outcomes with proton and photon radiotherapy for standard risk medulloblastoma. Neuro Oncol. 2016;18(6):881-7.
|
|
| 8) |
Pulsifer MB, Sethi RV, Kuhlthau KA, et al. Early Cognitive Outcomes Following Proton Radiation in Pediatric Patients With Brain and Central Nervous System Tumors. Int J Radiat Oncol Biol Phys. 2015;93(2):400-7.
|
|
| 9) |
Moeller BJ, Chintagumpala M, Philip JJ, et al. Low early ototoxicity rates for pediatric medulloblastoma patients treated with proton radiotherapy. Radiat Oncol. 2011;6:58.
|
|
| 10) |
Lundkvist J, Ekman M, Ericsson SR, et al. Cost-effectiveness of proton radiation in the treatment of childhood medulloblastoma. Cancer. 2005;103(4):793-801.
|
|
| 11) |
Mailhot Vega RB, Kim J, Bussière M, et al. Cost effectiveness of proton therapy compared with photon therapy in the management of pediatric medulloblastoma. Cancer. 2013;119(24):4299-307.
|
|
| 12) |
12) Hirano E, Fuji H, Onoe T, et al. Cost-effectiveness analysis of cochlear dose reduction by proton beam therapy for medulloblastoma in childhood. J Radiat Res. 2014;55(2):320-7.
|
|
|

|
| 目次へ戻る!
|

|
| 課題5:化学療法
|

|
| |
CQ5: 3歳以上の標準リスク群にはどのような術後治療が推奨されるか?
|

|
| |
推奨
シスプラチン、シクロホスファミド、ビンクリスチンを中心とした多剤併用化学療法と、24Gy程度の全脳脊髄照射と総線量54Gy程度の局所照射を組み合わせた通常分割放射線治療による、術後化学放射線治療を推奨する。(推奨度1B)
|
|

|
| |
解 説
|

|
| |
|
本疾患は放射線治療および化学療法が有効な治療であることが既知の事実であり、現在の3歳以上標準リスク群の髄芽腫治療においては術後に両者を行うのが一般的になっている。一方、その急性期および晩期の合併症は、生命の危機を及ぼすことがあり、かつ長期生存者の生活の質(QOL)を著しく低下させることが知られている。したがって、益と害のバランスを考慮した術後治療の推奨は重要な臨床課題であると考える。
髄芽腫の治療の黎明期において、腫瘍摘出術のみでは髄芽腫は不治の病であったが、術後放射線治療、特に全脳脊髄照射(cranio-spinal irradiation: CSI)の導入後、髄芽腫は治癒を期待できる疾患となった。しかしながら、発達中の小児の脳、特に大脳に高線量の放射線治療を行った結果、生存者に重度の発達障害を起こすことが判明した。脳への照射を軽減するためにCSIの線量を低減する試みがランダム化比較試験(randomized control study: RCT)として行われたが、CSI線量36Gy群と23.4Gy群の再発率が7.9%対28.3%(p<0.01)と単純なCSI減量は再発率を有意に上昇させることが示された1)。
その後、放射線治療に化学療法を追加することで、生存率の向上を目指す比較臨床試験が複数行われた。米国と欧州で約36GyのCSIにビンクリスチン、CCNU(ロムスチン)ベースの化学療法を追加する2つのRCTが行われた。米国試験(局所50-55 Gy、CSIを35-40 Gy)では髄芽腫全体では化学療法追加による有意な生存率向上は認めず、転移のない患者群の5年event-free survival(EFS)は59%であった2)。欧州試験(局所55 Gy、全脳35-45 Gy、全脊髄30-35 Gy)でも化学療法の上乗せ効果は認めず、転移のない群の5年生存率は64.6%であった3)。
その後、米国ではPackerらによって開発が行われてきたビンクリスチンとCCNUの併用にシスプラチンを加えたレジメンの検証が行われた。この試験ではCSI線量を23.4 Gyに減量したのにも関わらず、5年EFS 79.7%という非常に良好な生存率が得られた9)。このことは、CSIの線量を多くするよりも、シスプラチンを含む有効な化学療法を併用することの方が予後の向上に重要であることを示している。引き続き行われたCOG A9961試験では、このレジメンのCCNUをシクロホスファミドに置換したレジメンの優越性がRCTで検証されたが、優越性は示すことができず、感染症などの重篤な有害事象が多いという結果であった。そのため、現在に至るまでCCNUを含むPackerレジメンと23.4Gy CSIに局所ブーストを行う方法が世界的に標準治療となっている10)。続いて米国から、23.4Gy のCSIと局所ブースト照射の後に、化学療法の間隔を開けないために自己末梢血幹細胞救援を併用したシスプラチン、大量シクロホスファミド、ビンクリスチンの3剤による化学療法を4回繰り返す方法を行い、5年EFS 83%と優れた結果が報告され、一定量以上のシクロホスファミドの有効性が示された11)。
一方、欧州ではSIOPと英国小児がん研究グループ(United Kingdom Children's Cancer Study Group; UKCCSG)の共同研究でシクロホスファミド、カルボプラチン、ビンクリスチン、エトポシドによる多剤併用化学療法を35Gy CSI とブースト照射の前後に行った(サンドイッチ療法)群と、放射線治療単独で治療した群を比較する臨床試験が行われた。OSでは有意差を認めなかったが、5年EFSでは74.2%対59.8% (P=0.04) と有意に化学療法群の生存率が高かった4)。
以上のことから、標準リスクでは効果の弱い化学療法では放射線治療への上乗せ効果は見られないが、CCNUとビンクリスチンにシスプラチンを加えて用いることでCSIの線量を36Gyから23.4Gyに軽減することが可能となった。なお、CCNU(ロムスチン)が未承認のわが国ではCOG A9961試験でシクロホスファミドに置換したレジメンでもCCNUレジメンと近似したEFSが得られたことから、シクロホスファミドに置換したレジメンが実地臨床では広く使われている。
放射線治療と化学療法の実施の順序については、欧米で術後に放射線治療前に1−2コースの化学療法を組み入れるいわゆるサンドイッチ療法の検討が行われた。欧州では、プロカルバジン, ビンクリスチン, メトトレキサート多剤併用化学療法5)あるいはシスプラチン, イホスファミド, 大量メトトレキサート, エトポシド, シタラビン (AraC)による多剤併用化学療法6, 7)を放射線治療の前に挟み込むことの有用性の検討がRCTで行われたが、ともに有用性を示すことができなかった。また、8 in 1という8種類の抗がん剤を1日で投与する多剤併用化学療法を放射線治療前に行い標準リスク群でCSI軽減(全脳27Gy全脊髄30-36Gy)を目指す単アーム試験が行われた。7年EFS 62%と従来と匹敵する結果が得られたが、放射線治療先行との比較は行われていない8)。以上の結果より、標準リスク群髄芽腫の術後治療は、放射線治療のあとに化学療法を行うことが一般的になった。サンドイッチ療法は1コースの化学療法の後に放射線治療を行うために、化学療法がビンクリスチン投与を除いて約2ヶ月中断するという問題がある。
欧州では、過分割照射 36Gy CSIと通常分割照射の23.4Gy CSIを無作為割り付けし、シスプラチン、CCNU、ビンクリスチンを投与した国際的治療グループによるランダム化比較試験(RCT)を行ったが、5年EFS 78%対77%と、過分割照射の優越性は示せなかった12)。フランスで行われたCSI 36Gy(36分割)と68Gy(68分割)の過分割照射のみで後治療を行った試験で、3年EFS 81%という生存率は興味深いが、放射線治療単独の本戦略の評価には長期成績の報告を待たなければならないであろう13)。髄芽腫の治療選択において、副作用および治療後のQOLは非常に重要な要素である。本CQを検討する際に評価した複数の論文で、急性合併症が報告されているが、放射線治療や化学療法の種類によって急性毒性の差を認めていない。また、晩期合併症を治療レジメンごとに比較した論文はないが、放射線量が少ないレジメンの方が二次がん、認知機能低下、内分泌機能などの影響が少ないと理論的に推論することは妥当である。
これらのアウトカムのエビデンスより、シスプラチン, シクロホスファミド, ビンクリスチンによる多剤併用化学療法に、24Gy程度の通常分割全脳脊髄照射と局所追加照射を組み合わせた放射線治療による術後化学放射線治療を推奨する。
|

|
| |
注意:
|
| |
|
|
ロムスチン(lomustine: CCNU):国内未承認
ビンクリスチン(vincristine):小児脳腫瘍に対して保険適応
シスプラチン(cisplatin):小児悪性脳腫瘍に対する他の抗悪性腫瘍剤との併用として保険適応
シクロホスファミド(cyclophosphamide):神経腫瘍の自覚的ならびに他覚的症状の寛解として保険適応
カルボプラチン(carbplatin):小児悪性固形腫瘍に対する他の抗悪性腫瘍剤との併用として保険適応
エトポシド点滴静注(etposide):小児悪性固形腫瘍に対する他の抗悪性腫瘍剤との併用として保険適応
エトポシドカプセル(etposide capsule):髄芽腫に対しては保険適応外
プロカルバジン(procarbazine):髄芽腫に対しては保険適応外
メトトレキセート(methotrexate):髄芽腫に対しては保険適応外
イフォスファミド(ifosphamide): 小児悪性固形腫瘍に対する他の抗悪性腫瘍剤との併用として保険適応
シタラビン(cytarabine): 髄芽腫に対しては保険適応外
8 in1 多剤併用療法:メチルプレドニゾロン、ビンクリスチン、ロムスチン、プロカルバジン、ハイドロキシウレア(髄芽腫には保険適応外)、シスプラチン、シタラビン、シクロホスファミドの8種類の薬剤を1日に投与する化学療法
|

|
| |
|
CQ5:検索式
|
| |
|
| ((((((medulloblastoma[mh]) OR (medulloblastoma*[tiab]) OR (melanocytic[tiab] AND medulloblastoma*[tiab]) OR (childhood[tiab] AND medulloblastoma*[tiab]) OR (medullomyoblastoma*[tiab]) OR (desmoplastic[tiab] AND medulloblastoma*[tiab]) OR (adult[tiab] AND medulloblastoma*[tiab]))) AND ((((((((drug therapy[MeSH Terms]) OR drug therapy) OR drug therapies) OR chemotherapy) OR chemotherapies) OR pharmacotherapy) OR pharmacotherapies) OR (((((((((radiotherapy[mesh]) OR radiotherapies) OR radiation therapy) OR radiation therapies) OR radiotherapy) OR targeted radiotherapy) OR targeted radiotherapies) OR targeted radiation therapy) OR targeted radiation therapies) OR (((((((((antineoplastic agents[mesh]) OR antineoplastic drugs) OR antineoplastics) OR chemotherapeutic anticancer drug) OR cancer chemotherapy agents) OR chemotherapeutic anticancer agents) OR anticancer agents) OR antitumor drugs) OR antitumor agents)))) AND clinical study[pt]) AND 1900/7/1:2018/12/31[dp])
|
| 以上の髄芽腫治療に関連するキーワードを用いた検索式(CQ5-7共通)にて、276論文を抽出した。系統的一次検索で205件の論文が抽出された。2次スクリーニングで40論文をCQ5-7のエビデンスとして採用した。CQ5のシステマティックレビュー後、さらなる検討を行い最終的にOSアウトカムの7論文、EFSアウトカムの13論文、有害事象・QOLアウトカムの13論文を採用した。
|
|

|
| |
|
| |
|
| 参考文献
|
| 1) |
Deutsch M, Thomas PR, Krischer J, et al. Results of a prospective randomized trial comparing standard dose neuraxis irradiation (3,600 cGy/20) with reduced neuraxis irradiation (2,340 cGy/13) in patients with low-stage medulloblastoma. A Combined Children's Cancer Group-Pediatric Oncology Group Study. Pediatr Neurosurg. 1996;24(4):167-76; discussion 76-7.
|
|
| 2) |
Evans AE, Jenkin RD, Sposto R, et al. The treatment of medulloblastoma. Results of a prospective randomized trial of radiation therapy with and without CCNU, vincristine, and prednisone. J Neurosurg. 1990;72(4):572-82.
|
|
| 3) |
Tait DM, Thornton-Jones H, Bloom HJ, et al. Adjuvant chemotherapy for medulloblastoma: the first multi-centre control trial of the International Society of Paediatric Oncology (SIOP I). Eur J Cancer. 1990;26(4):464-9.
|
|
| 4) |
Taylor RE, Bailey CC, Robinson K, et al. Results of a randomized study of preradiation chemotherapy versus radiotherapy alone for nonmetastatic medulloblastoma: The International Society of Paediatric Oncology/United Kingdom Children's Cancer Study Group PNET-3 Study. J Clin Oncol. 2003;21(8):1581-91.
|
|
| 5) |
Bailey CC, Gnekow A, Wellek S, et al. Prospective randomised trial of chemotherapy given before radiotherapy in childhood medulloblastoma. International Society of Paediatric Oncology (SIOP) and the (German) Society of Paediatric Oncology (GPO): SIOP II. Med Pediatr Oncol. 1995;25(3):166-78.
|
|
| 6) |
Hoff KV, Hinkes B, Gerber NU, et al. Long-term outcome and clinical prognostic factors in children with medulloblastoma treated in the prospective randomised multicentre trial HIT'91. Eur J Cancer. 2009;45(7):1209-17.
|
|
| 7) |
Kortmann RD, Kühl J, Timmermann B, et al. Postoperative neoadjuvant chemotherapy before radiotherapy as compared to immediate radiotherapy followed by maintenance chemotherapy in the treatment of medulloblastoma in childhood: results of the German prospective randomized trial HIT '91. Int J Radiat Oncol Biol Phys. 2000;46(2):269-79.
|
|
| 8) |
Gentet JC, Bouffet E, Doz F, et al. Preirradiation chemotherapy including "eight drugs in 1 day" regimen and high-dose methotrexate in childhood medulloblastoma: results of the M7 French Cooperative Study. J Neurosurg. 1995;82(4):608-14.
|
|
| 9) |
Packer RJ, Goldwein J, Nicholson HS, et al. Treatment of children with medulloblastomas with reduced-dose craniospinal radiation therapy and adjuvant chemotherapy: A Children's Cancer Group Study. J Clin Oncol. 1999;17(7):2127-36.
|
|
| 10) |
Packer RJ, Gajjar A, Vezina G, et al. Phase III study of craniospinal radiation therapy followed by adjuvant chemotherapy for newly diagnosed average-risk medulloblastoma. J Clin Oncol. 2006;24(25):4202-8.
|
|
| 11) |
Gajjar A, Chintagumpala M, Ashley D, et al. Risk-adapted craniospinal radiotherapy followed by high-dose chemotherapy and stem-cell rescue in children with newly diagnosed medulloblastoma (St Jude Medulloblastoma-96): long-term results from a prospective, multicentre trial. Lancet Oncol. 2006;7(10):813-20.
|
|
| 12) |
Lannering B, Rutkowski S, Doz F, et al. Hyperfractionated versus conventional radiotherapy followed by chemotherapy in standard-risk medulloblastoma: results from the randomized multicenter HIT-SIOP PNET 4 trial. J Clin Oncol. 2012;30(26):3187-93.
|
|
| 13) |
Carrie C, Muracciole X, Gomez F, et al. Conformal radiotherapy, reduced boost volume, hyperfractionated radiotherapy, and online quality control in standard-risk medulloblastoma without chemotherapy: results of the French M-SFOP 98 protocol. Int J Radiat Oncol Biol Phys. 2005;63(3):711-6.
|
|
|

|
| 目次へ戻る!
|

|
| 課題5:化学療法
|

|
| |
CQ6: 3歳以上の高リスク群にはどのような術後治療が推奨されるか?
|

|
| |
推奨
36Gy程度の全脳脊髄照射と54Gy程度の局所照射を術後に行い、その後にシスプラチン、シクロホスファミド、ビンクリスチンを中心とした治療強度を増した多剤併用化学療法を複数コース行うことを提案する。(推奨度2C)
|
|

|
| |
解 説
|

|
| |
|
髄芽腫の標準リスク群のCQ5で解説したように、全脳脊髄照射(craniospinal irradiation: CSI)の導入後、髄芽腫は治癒を期待できる疾患となった。しかしながら、残存腫瘍または播種を伴う高リスク群では、標準リスク群に比べ生存率が低く、化学療法の併用を行っても満足のいく治療成績を得るには至っていない。米国と欧州で放射線治療にビンクリスチン、CCNU(ロムスチン)ベースの化学療法を追加する2つのランダム化比較試験(randamized control study: RCT)が行われた。
米国試験(局所50-55 Gy、CSIを35-40 Gy)では腫瘍が大きく転移もあった群のサブ解析において、放射線治療単独群では5年EFS が0%であったのに対し、化学療法併用群で46%と有意に高い5年EFSを得た (p = 0.006)1)。一方、欧州試験(局所55 Gy、全脳35-45 Gy、全脊髄30-35 Gy)のRCTにおいても、中間解析で腫瘍が大きかった、あるいは亜全摘であった群において5年EFSの差が有意に高く、化学療法の追加効果が顕著であった。そのため欧州試験は途中で打ち切られ、術後残存腫瘍がある群では長期追跡後の生存率も最終的に有意に高かった2)。ただし、この試験では転移については評価されていない。欧州で、プロカルバジン, ビンクリスチン, メトトレキサート多剤併用化学療法を放射線治療の前に追加するRCTが行われたが、高リスク群において、化学療法追加群と追加しない群の5年EFSに有意な差は認めなかった(56% vs. 53%, p=0.7)3)。また8 in 1多剤併用化学療法を放射線治療前に行うCSI軽減(全脳27Gy全脊髄30-36Gy)アーム試験が行われたが、高リスク群で7年EFS 45%と改善は認めなかった4)。
その後、欧米で化学療法を強化する試みが行われ、米国のCCG921試験では、術後に放射線治療(CSI36Gy+局所線量54Gy)と照射中のビンクリスチン投与を行い、その後8 in 1とビンクリスチン/CCNU/プレドニゾロン(VCP)の二つの化学療法レジメンを比較するRCTが行われた。結果は、高リスク群では、VCP治療の方が8 in 1より5年PFSを有意に延長した(63±5% vs 45±5% P=0.006)5)。一方米国のPOG9031では高リスク群に通常分割の放射線治療を強化し(CSI 40Gy+局所線量54.4Gy)、シスプラチン/ エトポシド/ シクロホスファミド/ ビンクリスチンによる化学療法を放射線治療の前後に行うサンドイッチ療法と通常の放射線治療後に行う方法に割り付けるRCTが行われた。化学療法スケジュールによるEFS とOS差は認めなかったが、5年EFS 68.1±3%、5y-OS 74.6±3%と比較的良好な生存率を得た10)。米国から化学療法の間隔を開けないために自己末梢血幹細胞救援を併用したシスプラチン、大量シクロホスファミド、ビンクリスチンの3剤による化学療法を4回繰り返す方法を、36-39.6 GyのCSIと局所ブーストの後に行い、5年EFS 70%、5年OS 70%と高リスク群では最も良好な生存率を示した11)。
一方、ドイツのHIT2000試験においては、4歳以上の高リスク群においても、メトトレキサートの脳室内投与の効果を検証している。メトトレキサートは予定量の75%以上投与した症例で予後改善(5年EFS 61.5% vs 46.2% p=0.004)しており、年長児の高リスク群に対するメトトレキサート脳室内投与の有効性を示した12)。
米国COGでは、放射線治療中の併用抗がん剤としてビンクリスチンの他に、放射線増感薬としての効果を期待してカルボプラチンを併用する第I/II相試験が77例の転移症例を対象に実施された。少量のカルボプラチンをCSI 36Gyと局所ブースト照射中に30日間連続投与するもので照射後にビンクリスチンとシクロホスファミドによる化学療法を実施した。後半の症例では照射後化学療法にシスプラチンを追加した。全体での5年EFS71%という良好な生存率を得られたが、シスプラチンの追加は予後の向上をもたらさなかった13)。
高リスク群でも術後に放射線治療前後に化学療法を挟み込むサンドイッチ療法の有用性が検証された。ドイツで行われたHIT’91試験では、放射線治療(CSI 35.2Gy 局所 55.2Gy)後にいわゆる標準リスク群におけるPackerレジメン シスプラチン/CCNU/ビンクリスチンを投与する方法と、シスプラチン/イホスファミド/メトトレキサート/エトポシド/シタラビンによる多剤併用化学療法を放射線治療前後に行う方法とのRCTが行われ、その長期フォローアップデータによると、髄液播種を有する群10年のOS 70%/34% (p=0.02)、脊髄転移や遠隔転移を有する群の10年OS 42%/45% (p=0.99)であり、髄液播種を有する症例に限ると放射線治療後にPackerレジメンを投与した群のほうが良好な生存率であった6,7)。欧州ではさらに、SIOP/UKCCSGによるPNET-3試験が行われたが、同様に放射線治療前に化学療法行うことの有用性は認められなかった8)。
標準リスク群と同様に高リスク群においても、過分割照射の有用性を検討する臨床試験が行われた。米国CCG9931試験において、化学療法先行後に過分割照射(CSI 40Gy+局所線量 72Gy)を行ったが、5年EFS 43%±5%, 5年OS 52%±5%と生存率の改善は認めなかった9)。
以上をまとめると、高リスク群髄芽腫の術後治療において、初期の研究では放射線単独治療であったが、まったく治癒が得られず、その後、化学療法の併用や過分割照射について様々な工夫がなされてきた。しかし、いかなる化学療法を用いてもCSI 36Gyでは5年EFSは60-70%までにとどまり、CSIの線量の減量にも成功していない。今後は、さらなる分子生物学的リスク細分化によって、治療の強化が有効な群、CSI減量などの治療軽減を目指す群、新規治療薬を試す群と、層別化・個別化治療を行って、高リスク群の治療開発を続けていかなくてはならない。このように標準治療は定まっていない中で、第I/II相試験ではあるが、米国COGのカルボプラチンと放射線の併用療法が毒性も考えると有望な治療法とも考えられる。
これらのアウトカムのエビデンスより、3歳以上の高リスク群髄芽腫の標準的術後治療は、より高い生存率という益を最優先して治療を選択するという、まだ開発途上の状況ではあるが、36Gy程度の全脳脊髄照射と54Gy程度の局所照射を術後に行い、その後にシスプラチン、シクロホスファミド、ビンクリスチンを中心とした多剤併用化学療法を一定の期間での薬剤投与量を最大化するなど治療強度を増すことを提案する。
|

|
| |
注意:
|
| |
|
|
ロムスチン(lomustine: CCNU):国内未承認
ビンクリスチン(vincristine):小児脳腫瘍に対して保険適応
プロカルバジン(procarbazine):髄芽腫に対しては保険適応外
メトトレキセート(methotrexate):髄芽腫に対しては保険適応外
シスプラチン(cisplatin):小児悪性脳腫瘍に対する他の抗悪性腫瘍剤との併用として保険適応
エトポシド点滴静注(etposide):小児悪性固形腫瘍に対する他の抗悪性腫瘍剤との併用として保険適応
エトポシドカプセル(etposide capsule):髄芽腫に対しては保険適応外
シクロホスファミド(cyclophosphamide):神経腫瘍の自覚的ならびに他覚的症状の寛解として保険適応
カルボプラチン(carbplatin):小児悪性固形腫瘍に対する他の抗悪性腫瘍剤との併用として保険適応
イフォスファミド(ifosphamide): 小児悪性固形腫瘍に対する他の抗悪性腫瘍剤との併用として保険適応
シタラビン(cytarabine): 髄芽腫に対しては保険適応外
8 in1 多剤併用療法:メチルプレドニゾロン、ビンクリスチン、ロムスチン、プロカルバジン、ハイドロキシウレア(髄芽腫には保険適応外)、シスプラチン、シタラビン、シクロホスファミドの8種類の薬剤を1日に投与する化学療法
|

|
| |
|
CQ6:検索式
|
| |
|
| ((((((medulloblastoma[mh]) OR (medulloblastoma*[tiab]) OR (melanocytic[tiab] AND medulloblastoma*[tiab]) OR (childhood[tiab] AND medulloblastoma*[tiab]) OR (medullomyoblastoma*[tiab]) OR (desmoplastic[tiab] AND medulloblastoma*[tiab]) OR (adult[tiab] AND medulloblastoma*[tiab]))) AND ((((((((drug therapy[MeSH Terms]) OR drug therapy) OR drug therapies) OR chemotherapy) OR chemotherapies) OR pharmacotherapy) OR pharmacotherapies) OR (((((((((radiotherapy[mesh]) OR radiotherapies) OR radiation therapy) OR radiation therapies) OR radiotherapy) OR targeted radiotherapy) OR targeted radiotherapies) OR targeted radiation therapy) OR targeted radiation therapies) OR (((((((((antineoplastic agents[mesh]) OR antineoplastic drugs) OR antineoplastics) OR chemotherapeutic anticancer drug) OR cancer chemotherapy agents) OR chemotherapeutic anticancer agents) OR anticancer agents) OR antitumor drugs) OR antitumor agents)))) AND clinical study[pt]) AND 1900/7/1:2018/12/31[dp])
|
| 以上の髄芽腫治療に関連するキーワードを用いた検索式(CQ5-7共通)にて、276論文を抽出した。系統的一次検索で205件の論文が抽出された。2次スクリーニングで40論文をCQ5-7のエビデンスとして採用した。CQ6のシステマティックレビュー後、さらなる検討を行い最終的にOSアウトカムの9論文、EFSアウトカムの13論文、有害事象・QOLアウトカムの10論文を採用した。
|
|

|
| |
|
| |
|
| 参考文献
|
| 1) |
Evans AE, Jenkin RD, Sposto R, et al. The treatment of medulloblastoma. Results of a prospective randomized trial of radiation therapy with and without CCNU, vincristine, and prednisone. J Neurosurg. 1990;72(4):572-82.
|
|
| 2) |
Tait DM, Thornton-Jones H, Bloom HJ, et al. Adjuvant chemotherapy for medulloblastoma: the first multi-centre control trial of the International Society of Paediatric Oncology (SIOP I). Eur J Cancer. 1990;26(4):464-9.
|
|
| 3) |
Bailey CC, Gnekow A, Wellek S, et al. Prospective randomised trial of chemotherapy given before radiotherapy in childhood medulloblastoma. International Society of Paediatric Oncology (SIOP) and the (German) Society of Paediatric Oncology (GPO): SIOP II. Med Pediatr Oncol. 1995;25(3):166-78.
|
|
| 4) |
Gentet JC, Bouffet E, Doz F, et al. Preirradiation chemotherapy including "eight drugs in 1 day" regimen and high-dose methotrexate in childhood medulloblastoma: results of the M7 French Cooperative Study. J Neurosurg. 1995;82(4):608-14.
|
|
| 5) |
Zeltzer PM, Boyett JM, Finlay JL, et al. Metastasis stage, adjuvant treatment, and residual tumor are prognostic factors for medulloblastoma in children: conclusions from the Children's Cancer Group 921 randomized phase III study. J Clin Oncol. 1999;17(3):832-45.
|
|
| 6) |
Hoff KV, Hinkes B, Gerber NU, et al. Long-term outcome and clinical prognostic factors in children with medulloblastoma treated in the prospective randomised multicentre trial HIT'91. Eur J Cancer. 2009;45(7):1209-17.
|
|
| 7) |
Kortmann RD, Kühl J, Timmermann B, et al. Postoperative neoadjuvant chemotherapy before radiotherapy as compared to immediate radiotherapy followed by maintenance chemotherapy in the treatment of medulloblastoma in childhood: results of the German prospective randomized trial HIT '91. Int J Radiat Oncol Biol Phys. 2000;46(2):269-79.
|
|
| 8) |
Taylor RE, Bailey CC, Robinson KJ, et al. Outcome for patients with metastatic (M2-3) medulloblastoma treated with SIOP/UKCCSG PNET-3 chemotherapy. Eur J Cancer. 2005;41(5):727-34.
|
|
| 9) |
Allen J, Donahue B, Mehta M, et al. A phase II study of preradiotherapy chemotherapy followed by hyperfractionated radiotherapy for newly diagnosed high-risk medulloblastoma/primitive neuroectodermal tumor: a report from the Children's Oncology Group (CCG 9931). Int J Radiat Oncol Biol Phys. 2009;74(4):1006-11.
|
|
| 10) |
Tarbell NJ, Friedman H, Polkinghorn WR, et al. High-risk medulloblastoma: a pediatric oncology group randomized trial of chemotherapy before or after radiation therapy (POG 9031). J Clin Oncol. 2013;31(23):2936-41.
|
|
| 11) |
Gajjar A, Chintagumpala M, Ashley D, et al. Risk-adapted craniospinal radiotherapy followed by high-dose chemotherapy and stem-cell rescue in children with newly diagnosed medulloblastoma (St Jude Medulloblastoma-96): long-term results from a prospective, multicentre trial. Lancet Oncol. 2006;7(10):813-20.
|
|
| 12) |
von Bueren AO, Kortmann RD, von Hoff K, et al. Treatment of Children and Adolescents With Metastatic Medulloblastoma and Prognostic Relevance of Clinical and Biologic Parameters. J Clin Oncol. 2016;34(34):4151-60.
|
|
| 13) |
Jakacki RI, Burger PC, Zhou T, et al. Outcome of children with metastatic medulloblastoma treated with carboplatin during craniospinal radiotherapy: a Children's Oncology Group Phase I/II study. J Clin Oncol. 2012;30(21):2648-53.
|
|
| 14) |
Douek E, Kingston JE, Malpas JS, et al. Platinum-based chemotherapy for recurrent CNS tumours in young patients. J Neurol Neurosurg Psychiatry. 1991;54(8): 722-5.
|
|
|

|
| 目次へ戻る!
|

|
| 課題5:化学療法
|

|
| |
CQ7: 3歳未満の群にはどのような術後治療が推奨されるか?
|

|
| |
推奨1
乳幼児の髄芽腫において、転移がなくdesmoplastic nodular/ extensive nodularityサブタイプの患者群では、放射線治療を行わず、メトトレキサート(脳室内または髄腔内投与を含む)、プラチナ剤、アルキル化剤、ビンクリスチン、エトポシドを中心とした多剤併用化学療法による術後治療を提案する。 (推奨度2D)
|
推奨2
Desmoplastic nodular/ extensive nodularity以外の組織学的サブタイプおよび転移がある場合は、標準的な後治療は確立されておらず、上記の治療に大量化学療法や局所放射線療法を組み合わせた強化治療を行うことを提案する。(推奨度2C)
|
|

|
| |
解 説
|

|
| |
|
3-4歳未満の乳幼児の髄芽腫治療において、放射線治療、特に全脳脊髄照射(CSI)の、精神運動発達に及ぼす影響は甚大であり、乳幼児の治療戦略として、CSIは選択肢にはなりにくい。治療選択肢の限界と、腫瘍のもつ治療抵抗性の特性が合わさり、全体として乳幼児の髄芽腫は再発死亡リスクが高いと考えられてきた。しかしながら、病理亜分類および分子生物学的特性から、乳幼児の髄芽腫の中には、放射線治療を行わず、または局所放射線治療のみで、長期生存が可能な一群が存在することが明らかになった。したがって、乳幼児髄芽腫においてもリスク分類を行い、それぞれの群で益と害のバランスを考慮して術後治療の推奨を行う。
1990年代に米国とフランスで、放射線治療を回避し多剤併用化学療法のみで初期治療を行った臨床試験が行われた。フランスSFOPでは、カルボプラチンおよびプロカルバジン、エトポシドおよびシスプラチン、ビンクリスチン、シクロホスファミドの3種の化学療法を術後に7サイクル行う単アーム第II相試験が行われた。5歳未満の79人が登録され、全体の5年PFSは残存なし(R0) 転移なし(M0)群73%、残存あり(R1)M0群で41%、残存問わず(Rx)転移あり(M+)群で13%であった1)。また、米国CCG-9921試験は、3歳未満のあらゆる悪性脳腫瘍を対象としたランダム化第II相試験で、術後に2つの多剤併用化学療法レジメン、レジメンA:ビンクリスチン、シスプラチン、シクロホスファミド、及びエトポシドの組み合わせ、またはレジメンB:ビンクリスチン、カルボプラチン、イホスファミド及びエトポシドのいずれかに割りつけられ両群とも5コースの化学療法が行われた。治療開始前に転移がなく化学療法後に残存腫瘍がなかった患者は放射線治療を行わず治療終了、転移がなく残存があった症例はその時点で生後18カ月以上ならCSIとLRT、18カ月未満はLRTのみを行い治療終了、転移症例はCSIと局所放射線治療を行って治療終了した。髄芽腫患者92名の5年event free survival (EFS)は32%であった。レジメンA群とB群の5年EFSはそれぞれ37%と26%と有意差は認めなかった2)。
同時期にドイツでは、乳幼児髄芽腫に対して、メトトレキサート脳室内投与を含んだ多剤併用化学療法の単アーム第II相試験臨床試験がおこなわれた(HIT-SKK1992)。43人の3歳未満の髄芽腫に、術後カルボプラチン、シクロホスファミド、ビンクリスチン、エトポシドの全身投与に加え、メトトレキサート脳室内投与と大量メトトレキサート療法を加えた9週間サイクルの化学療法を3回行った。初期治療で放射線治療は行わなかった。全体の5年EFSは58%であった。R0M0、R+M0、RxM+群の5年EFSはそれぞれ、82%、50%、33%であった。既知の転移の有無に加え、乳幼児の髄芽腫の組織学的サブタイプが強力な予後因子であることが本試験で明らかになった。Desmoplastic nodular typeとclassic typeの5年EFSはそれぞれ85%と34%と有意な差を認め、組織学的サブタイプが独立したリスク因子であった3)。さらに後継レジメンHIT2000においても同様の結果が確認され、メトトレキサート脳室内投与を予定通り投与できた患者の方が、投与量が少なかった患者よりも予後が良いという結果が報告された4)。メトトレキサート脳室内投与の神経毒性は懸念されるが、HIT2000で同治療を受けた評価可能な202名の小児髄芽腫患者中、神経毒性を認めたのは9名であった4)。
米国COGは、3歳未満の転移のない乳幼児髄芽腫74人に対して、化学療法と局所放射線治療を組み合わせる臨床試験(P9934)を行った。シスプラチン、シクロホスファミド、エトポシド、ビンクリスチンによる化学療法を4コース行ったあと、残存腫瘍にはセカンドルック手術を推奨し、局所放射線治療を行い、シクロホスファミド、ビンクリスチン、経口エトポシドによる維持療法を行なった。全体の4年EFSは50%であった。ここでも、desmoplastic nodular typeとそれ以外の組織サブタイプでは、4年EFSがそれぞれ58%、23%と有意差を認めた5)。
国際的な臨床試験Head Startでは、乳幼児の悪性脳腫瘍に対して、放射線治療を行わず自己造血幹細胞救済を伴う大量化学療法を試みてきた。3歳未満の転移のない髄芽腫患者21名に対して、シスプラチン、シクロホスファミド、エトポシド、ビンクリスチンによる化学療法を5コース行った後、セカンドルック手術を推奨し、チオテパ、カルボプラチン、エトポシドによる自己造血幹細胞救済を伴う大量化学療法を行った。全体の5年EFSは52%であった。R0とdesmoplastic nodular typeは予後良好の傾向を認めた6)。また米国のCCG-99703パイロット試験では、髄芽腫を含む複数の3歳未満の乳児脳腫瘍を対象に、シスプラチン、シクロホスファミド、エトポシド、ビンクリスチンによる化学療法を3コース行った後、チオテパ、カルボプラチンによる自己造血幹細胞救済を伴う大量化学療法を地固め療法として3コース行う治療法の第I/II相試験臨床試験がおこなわれた。チオテパの投与量はさまざまであり、副次的評価項目ではあるが、36名の髄芽腫の5年EFSは60%であった。病理中央診断できた32名中、14名がdesmoplastic nodular typeであり、その5年EFSは79%であった7)。
St. Jude病院と米国と豪州合計6施設で行われた試験では、3歳未満の髄芽腫患者を、M0のdesmoplastic nodular typeを低リスク、M0のその他の組織型の髄芽腫を中間リスク、M+の患者を高リスクと分類した。寛解導入化学療法は大量メトトレキサート療法、ビンクリスチン、シクロホスファミド(高リスクのみビンブラスチン追加)を4コース行った。強化療法として、低リスク患者は放射線治療を省略し、追加のカルボプラチン、シクロホスファミド、エトポシドを2コース行った。中間リスクは54Gyの局所放射線治療を行い、高リスクはトポテカンとシクロホスファミドを2コースまたは3歳を超えてのCSIを行った。その後、シクロホスファミド、イリノテカン、エルロチニブによる内服維持療法を6サイクル(24週間)行った。低リスク群は、23人が試験治療を行ったが、中間解析結果では、1年EFSが78.3%と低く登録中止となり、5年EFSは55.3%であった。中間リスクは16人が試験治療を行い、5年EFSは24.6%であった。高リスクは26人が試験治療を行い、5年EFSは16.7%であった8)。
これらのエビデンスより、RTによる発達や認知機能への影響という害がより大きくなる乳幼児の髄芽腫において、転移がなくdesmoplastic nodular/ extensive nodularityサブタイプの患者群では、放射線治療を行わず、メトトレキサート髄腔内投与を含む、プラチナ剤、アルキル化剤、ビンクリスチン、エトポシドを中心とした多剤併用化学療法による術後治療を弱く推奨する。一方それ以外の組織学的サブタイプおよび転移がある場合は、標準的な後治療は確立されておらず、上記の治療に大量化学療法や局所放射線療法を組み合わせた強化治療を行うことを弱く推奨する。
|

|
| |
注意:
|
| |
|
|
カルボプラチン(carbplatin):小児悪性固形腫瘍に対する他の抗悪性腫瘍剤との併用として保険適応
プロカルバジン(procarbazine):髄芽腫に対しては保険適応外
エトポシド点滴静注(etposide):小児悪性固形腫瘍に対する他の抗悪性腫瘍剤との併用として保険適応
エトポシドカプセル(etposide capsule):髄芽腫に対しては保険適応外
シスプラチン(cisplatin):小児悪性脳腫瘍に対する他の抗悪性腫瘍剤との併用として保険適応
ビンクリスチン(vincristine):小児脳腫瘍に対して保険適応
シクロホスファミド(cyclophosphamide):神経腫瘍の自覚的ならびに他覚的症状の寛解として保険適応
イフォスファミド(ifosphamide): 小児悪性固形腫瘍に対する他の抗悪性腫瘍剤との併用として保険適応
メトトレキセート(methotrexate):髄芽腫に対しては保険適応外
チオテパ(thiotepa):小児悪性固形腫瘍における自家造血幹細胞移植の前治療として保険適応
カルボプラチン(carbplatin):小児悪性固形腫瘍に対する他の抗悪性腫瘍剤との併用として保険適応
イリノテカン(irinotecan):小児悪性固形腫瘍として保険適応
エルロチニブ(erlotinib):髄芽腫に対しては保険適応外
|

|
| |
|
CQ7:検索式
|
| |
|
| ((((((medulloblastoma[mh]) OR (medulloblastoma*[tiab]) OR (melanocytic[tiab] AND medulloblastoma*[tiab]) OR (childhood[tiab] AND medulloblastoma*[tiab]) OR (medullomyoblastoma*[tiab]) OR (desmoplastic[tiab] AND medulloblastoma*[tiab]) OR (adult[tiab] AND medulloblastoma*[tiab]))) AND ((((((((drug therapy[MeSH Terms]) OR drug therapy) OR drug therapies) OR chemotherapy) OR chemotherapies) OR pharmacotherapy) OR pharmacotherapies) OR (((((((((radiotherapy[mesh]) OR radiotherapies) OR radiation therapy) OR radiation therapies) OR radiotherapy) OR targeted radiotherapy) OR targeted radiotherapies) OR targeted radiation therapy) OR targeted radiation therapies) OR (((((((((antineoplastic agents[mesh]) OR antineoplastic drugs) OR antineoplastics) OR chemotherapeutic anticancer drug) OR cancer chemotherapy agents) OR chemotherapeutic anticancer agents) OR anticancer agents) OR antitumor drugs) OR antitumor agents)))) AND clinical study[pt]) AND 1900/7/1:2018/12/31[dp])
|
| 以上の髄芽腫治療に関連するキーワードを用いた検索式(CQ5-7共通)にて、276論文を抽出した。系統的一次検索で205件の論文が抽出された。2次スクリーニングで40論文をCQ5-7のエビデンスとして採用した。乳幼児髄芽腫の臨床試験は対象年齢の上限が、試験によって異なり、3歳未満から5歳未満と幅があるが、希少疾患で臨床試験報告論文の数が限られるため、CQ7のシステマティックレビューでは5歳未満までを含めた。CQ7のシステマティックレビュー後、さらなる検討を行い最終的にOSアウトカムの8論文、EFSアウトカムの8論文、有害事象・QOLアウトカムの7論文を採用した。
|
|

|
| |
|
| |
|
| 参考文献
|
| 1) |
Grill J, Sainte-Rose C, Jouvet A, et al. Treatment of medulloblastoma with postoperative chemotherapy alone: an SFOP prospective trial in young children. Lancet Oncol. 2005;6(8):573-80.
|
|
| 2) |
Geyer JR, Sposto R, Jennings M, et al. Multiagent chemotherapy and deferred radiotherapy in infants with malignant brain tumors: a report from the Children's Cancer Group. J Clin Oncol. 2005;23(30):7621-31.
|
|
| 3) |
Rutkowski S, Bode U, Deinlein F, et al. Treatment of early childhood medulloblastoma by postoperative chemotherapy alone. N Engl J Med. 2005;352(10):978-86.
|
|
| 4) |
Pompe RS, von Bueren AO, Mynarek M, et al. Intraventricular methotrexate as part of primary therapy for children with infant and/or metastatic medulloblastoma: Feasibility, acute toxicity and evidence for efficacy. Eur J Cancer. 2015;51(17):2634-42. |
|
| 5) |
Ashley DM, Merchant TE, Strother D, et al. Induction chemotherapy and conformal radiation therapy for very young children with nonmetastatic medulloblastoma: Children's Oncology Group study P9934. J Clin Oncol. 2012;30(26):3181-6.
|
|
| 6) |
Dhall G, Grodman H, Ji L, et al. Outcome of children less than three years old at diagnosis with non-metastatic medulloblastoma treated with chemotherapy on the "Head Start" I and II protocols. Pediatr Blood Cancer. 2008;50(6):1169-75.
|
|
| 7) |
Cohen BH, Geyer JR, Miller DC, et al. Pilot Study of Intensive Chemotherapy With Peripheral Hematopoietic Cell Support for Children Less Than 3 Years of Age With Malignant Brain Tumors, the CCG-99703 Phase I/II Study. A Report From the Children's Oncology Group. Pediatr Neurol. 2015;53(1):31-46.
|
|
| 8) |
Robinson GW, Rudneva VA, Buchhalter I, et al. Risk-adapted therapy for young children with medulloblastoma (SJYC07): therapeutic and molecular outcomes from a multicentre, phase 2 trial. Lancet Oncol. 2018;19(6):768-84.
|
|
|

|
| 目次へ戻る!
|

|
| 課題6:再発時の治療
|

|
| |
CQ8: 局所再発時の適切な治療法は何か?
|

|
| |
推奨1
髄芽腫の局所再発に対し,腫瘍の進行の抑制と生命予後の改善を期待し,化学療法を実施することを提案する。(推奨度2D)
|
推奨2
髄芽腫の局所再発に対し,摘出が安全に行いうる場合や摘出により症状の改善が期待できる場合等に,外科治療を提案する。(推奨度2D)
|
推奨3
放射線治療は初期治療で放射線を使用しなかったか減量されている場合等に,個々の状況に応じて緩和的にまたは根治的に実施することを提案する。(推奨度2D)
|
|

|
| |
解 説
|

|
| |
|
初発髄芽腫の治療成績は,外科治療と化学療法および放射線療法の組み合わせにより,標準リスク群で5年無イベント生存割合(EFS)70~80%程度,また高リスク群では35~70%程度,乳児症例における5年無病生存割合(DFS)30~50%程度で,治療法の改良により初回治療後の寛解期間は延長してきている1-11)。これに対し再発髄芽腫に対する標準的な治療法は確立されておらず,その長期生存率は不良であることから,再発髄芽腫に対する治療は臨床上重要な課題である。
報告されている再発治療の有効性については,10年生存率で見た場合に多剤化学療法で24% ,放射線治療で45%(標準リスク群)といったデータが参考になる1,12)。また,再発形式として後頭蓋窩局所再発はむしろ少なく,HIT-91の再発40例では播種性再発が32例(80%)となっている13)。播種性再発や高リスク群での再発,外科切除不能例,放射線治療施行後の再発症例では,再発後の治療を強く支持する研究データは得られていない。しかしながら再発後の無治療で経過観察された場合には,生命にかかわる急速な症状悪化を招きかねず,再発病変に対する治療に対する患者や家族の希望は強いため,緩和医療も含めた包括的な治療計画が望まれる。
再発治療において,過去に報告された医学データを利用するにあたり,試験の対象(髄芽腫のみか他の腫瘍型が含まれているか),リスク分類,再発形式(局所再発または播種性再発),初回化学療法や放射線治療の違い等に着目した。本ガイドラインでレビューの対象とした441文献の中で,化学療法に関する介入研究は12文献のみであった14-25)。このうち,10文献が単アーム試験,2文献がそれぞれ異なる薬剤の比較であり,プラセボを対象とした比較試験は行われていない。さらに,対象症例については,3文献が髄芽腫のみ,9文献は原始神経外胚葉腫瘍(primitive neuroectodermal tumor:PNET)をはじめとした他の小児脳腫瘍型を含み,検討の対象となる症例数は極めて限られていた。また,治療においては,多くの試験で化学療法に加えて放射線治療や外科治療が併用され,治療介入の方法は不均一であった。さらに,初回治療において放射線治療が行われている場合とそうでない場合では,再発時の治療法や予後に違いがみられることが想定される。このように,均質で十分な医学データが得られてないことを考慮したうえで,腫瘍の制御率ならびにOSの延長を重視した解析を行った。また,髄芽腫の局所再発に対する外科治療や放射線治療に関しては,前方視的臨床試験の報告がなく,特定の条件下での治療について強い推奨をもたらすものではない。そのため本CQでは,上記介入研究12文献以外にも,診療上参考になる文献について記載することとした。
髄芽腫の局所再発に対する単剤化学療法については,高用量チオテパ,テモゾロミド,パクリタキセルといった薬剤の有効性が2つの試験で報告されている14,25)。これら2試験の対象となった症例の約9割が初回治療で放射線治療を併用していた。Osorioらは,再発髄芽腫26例に対し高用量チオテパ(200 mg/m2/day)を3日間投与したのちに自家造血幹細胞移植を行い,4週間以降に再投与する治療法で,5例に45カ月以上の生存を確認,OS中央値11.7カ月であったと報告している25)。この試験は髄芽腫以外の複数の異なる腫瘍型の再発も対象として含まれており,全体の治療関連死は3.4%にみられた。Cefaloらの報告では,初回治療で大量化学療法や全脳脊髄照射(CSI)が行われているか否かによりテモゾロミド150・180・200 mg/m2/dayの3種類の投与量を設定し,28日ごとに5日間経口投与した14)。37例(脊髄播種病変あり7例,遠隔転移あり30例)のresponse rateは42.5%,6カ月PFS 30%,12カ月PFS 7.5%であり,PNET 5例を含めた解析で1年OSは41.2%,治療関連死はなく,グレード3~4の血液毒性が2割の患者に認められた。またHurwitzらの髄芽腫再発16例に対するパクリタキセルの報告によれば,350 mg/m2/dayを3週間ごとに投与する方法で,CR 1例,SD 6例,PD 9例であり,無増悪生存期間(PFS)は2.9カ月であった19)。この試験は複数の異なる腫瘍型の再発を対象とし,全体の有害事象はグレード3のアレルギー反応1例と敗血症7例のほか,治療関連死1例,脳幹圧迫ある髄芽腫で痙攣後の死亡が1例みられた。
多剤化学療法についてDunkelらは,25例の再発髄芽腫に対する自家造血幹細胞移植を併用したカルボプラチン,チオテパ,エトポシドの大量化学療法レジメンを報告した17)。カルボプラチンは造血幹細胞移植の8日前から500 mg/m2で開始し,3日間使用したのち,チオテパ300 mg/m2/dayおよびエトポシド250 mg/m2/dayが投与された。この治療での成績は10年EFS 24%,10年OS 24%,OS中央値が26.8カ月,6例は151.2カ月(中央値)増悪なく生存した。治療関連死は3例(14%)であった。またDupuis-Girodらは,CSIを回避した初回治療時3歳未満の髄芽腫再発20例に対するブスルファンとチオテパのレジメンを報告した22)。ブスルファンを150 mg/m2/dayで4日間経口投与したのちチオテパ300 mg/m2/dayを3日間使用して自家造血幹細胞移植を行った。外科治療を追加した4例を除く16例の解析で(後頭蓋窩局所再発9,脊髄再発および髄液播種3,両方を認めるもの4),CRが4例(25%)認められ,RRは75%と良好な結果が示されており,治療関連死を1例認めた。この試験では幹細胞移植後36例において放射線治療が併用されている。イリノテカンについては,髄芽腫再発9例に対するベバシズマブとの併用治療について後方視的研究で,PFS 11カ月,OS 13カ月,6カ月時点でのPR 3例,CR 1例と報告されている26)。イリノテカンはテモゾロミドとの併用療法での第Ⅱ相試験も報告されているが,66例の再発例に対しCR2,PR13,生存期間中央値16.7カ月であり,期待された結果は得られていない27)。
MüllerらはHIT-REZ試験において,初回治療として外科的摘出と化学療法のみ行い,放射線治療を回避した乳幼児17例に対して,完全寛解後初回再発時の治療としてCSIおよび局所放射線治療を行った結果を報告している28)。CSIは35.2 Gy(23.4~40.0 Gy)および後頭蓋窩ブースト55.0 Gyで行われ,カルボプラチンやエトポシドを使った化学療法が併用された。17例の治療成績はPFS 2.9±1.1年,OS 3.8±0.8年,5年PFS 40%,5年OS 39%であった。6例の局所再発,11例の遠隔再発(髄液細胞診陽性1例,脊髄病変あり3例,遠隔転移あり3例,脊髄病変と遠隔転移あり3例)の治療成績は局所再発例と遠隔転移例それぞれ3年PFS 67%±19%および36%±15%(log-rank,p=0.948),3年OS 67%±19%および55%±15%(log-rank,p=0.914)であり,有意差は認められていない。この報告では,大量化学療法やメトトレキサート髄注療法もCSIと併用または前後して行われていていることから,放射線治療単独の効果を示すものではないが,初回治療で放射線治療を回避した乳幼児髄芽腫の初回再発に対し,放射線治療の効果を示唆するデータとして重要である。
初回治療で放射線を併用した再発髄芽腫症例については,Bakstらが13例の初期治療で放射線治療を行っている髄芽腫再照射治療を報告している29)。再照射の内訳は後頭蓋窩46%,テント上・全脳31%,脊髄23%,全脳全脊髄8%であり,外科治療や化学療法が併用されている。治療は局所分割照射とIMRTがほぼ同数で行われ,CSI 18 Gyおよびブースト12 Gyが使用された。照射後の急性期障害は認めず,観察期間内(中央値30カ月)に無症候性の放射線壊死が1例認められた。治療成績は5年DFS 48%,5年OS 65%と一定の治療効果が得られた。この研究では,異なる照射部位に対し局所または拡大照射が行われており,再発形式について詳細な記載はないため再発腫瘍全般での再照射治療の効果については結論できない。しかしながら,局所再発や限局的な遠隔再発に対し再照射治療を行う場合には参考となる報告である。
Wetmoreらは,初回治療で手術および化学放射線治療を行った再発髄芽腫38例中14例に再照射を行った結果,5年OS 55%±14%(vs. 33%±16%)および10年OS 46%±14%(vs. 0%)ともに,非照射例に対し有意に生存期間が上回ったと報告した(p=0.036)12)。CSI 36 Gy(総線量18~54 Gy/1日線量1.5~2 Gy)と局所照射が併用され,総線量の中央値は91.9 Gy(73.8~109.8 Gy)であった。再照射14例の放射線壊死は9/14例(64%)であったのに対し,非照射例では7/24例(29%)と有意な増加を認めたが(p=0.0468),無症候性であったため追加の治療は行われていない。標準リスク11例および高リスク4例の生存期間はそれぞれ5.39年と4.94年であった。初回治療から10年生存した割合は標準リスク群45%,高リスク群0%であり,再治療でのリスクを考慮したうえで,特に標準リスク群では再発に対しては再照射の有効性が期待できる結果である。
髄芽腫の局所再発に対する外科治療についてOS延長を直接証明した報告はなく,評価も一定していない。Sabelらは標準リスク群の髄芽腫を対象としたHIT-SIOP PNET4試験の初回再発72例の解析を行っている30)。うち18例(25%)に外科的切除が行われ,その再発部位の内訳は後頭蓋窩単発6例,脊髄またはテント上5例,脳脊髄多発7例であった。再発72例全体の3年OSおよび5年OSはそれぞれ20±5%,6.0±4%であり,外科的切除(p<0.01)ならびに後頭蓋窩局所再発(p<0.01)はともに独立した予後因子であった。局所再発の外科治療については,侵襲性や化学療法・放射線治療の成績も考慮したうえで,摘出が安全に行える場合,摘出により症状の改善が期待できる場合など個々の症例の状況に応じた適応判定を行うべきである。
以上のことから,髄芽腫の局所再発に対して化学療法の効果が一部示されており,症例の状況に応じて放射線治療の併用を考慮できる。また,大量化学療法における治療関連死,放射線治療における晩期障害について注意する必要がある。小児患者の尊厳を含めた倫理的判断に基づき,治療によるリスクや侵襲性を十分に考慮した包括的な適応判断がなされることが望ましい。
|

|
| |
注意:
|
| |
|
|
チオテパ(thiotepa):小児悪性固形腫瘍における自家造血幹細胞移植の前治療として保険適応
テモゾロミド(temozolomide):髄芽腫に対しては保険適応外,ユーイング肉腫に対してイリノテカンとの併用で保険承認
パクリタキセル(paclitaxecel):髄芽腫,小児固形腫瘍に対しては保険適応外
カルボプラチン(carbplatin):小児悪性固形腫瘍に対する他の抗悪性腫瘍剤との併用として保険適応
ブスルファン(busulfan):髄芽腫に対しては保険適応外,ユーイング肉腫ファミリー腫瘍及び神経芽細胞腫における自家造血幹細胞
移植の前治療としては保険承認適応
イリノテカン(irrinotecan):小児悪性固形腫瘍として保険適応
ベバシズマブ(bevacizumab):髄芽腫,小児固形腫瘍に対しては保険適応外
メトトレキサート(methotrexate):髄芽腫,小児悪性腫瘍対しては保険適応外
|

|
| |
|
システマティックレビュー結果
CQ8:検索式
|
| |
|
| ((((((((Medulloblastoma[Mesh]OR Medulloblastoma*[tiab]OR Melanocytic Medulloblastoma*[tiab]OR Childhood Medulloblastoma*[tiab]OR Medullomyoblastoma*[tiab]OR Desmoplastic Medulloblastoma*[tiab]))))AND(((((((Neoplasm Recurrence, Local[mh]OR Neoplasm, Residual[mh]OR Neoplasm Seeding[mh]OR Recurrence[mh])))OR(((Local[tiab]OR Locoregional[tiab])AND(Neoplasm Recurrence[tiab]OR Neoplasm Recurrences[tiab]))))OR(((minimal[tiab]and residual[tiab]and(disease[tiab]OR diseases[tiab]))OR(residual[tiab]AND(neoplasm[tiab]OR neoplasms[tiab])))))OR((neoplasm[tiab]and seeding*[tiab])))OR((Recurrences[tiab]OR Recrudescence[tiab]OR Recrudescences[tiab]OR Relapse[tiab]OR Relapses[tiab]OR Regrowth[tiab])))))AND((“Epidemiologic Study Characteristics”[Mesh]OR “Statistics as Topic”[Mesh]OR “Clinical Study”[Publication Type]))))AND 1900/01/01:2018/12/31[dp]
|
| 以上の検索式により検索された441文献のなかから介入研究12文献を抽出して内容を確認し,Minds 2014に基づいて定性的システマティックレビューを行った。作成した評価シートからエビデンス総体を導き出して,それらに基づいて推奨と解説文を作成した。
|
|

|
| |
|
| |
|
| 参考文献
|
| 1) |
Thomas PR, Deutsch M, Kepner JL, et al. Low-stage medulloblastoma:final analysis of trial comparing standard-dose with reduced-dose neuraxis irradiation. J Clin Oncol. 2000;18(16):3004-11.[PMID:10944134]
|
|
| 2) |
Packer RJ, Goldwein J, Nicholson HS, et al. Treatment of children with medulloblastomas with reduced-dose craniospinal radiation therapy and adjuvant chemotherapy:A Children’s Cancer Group Study. J Clin Oncol. 1999;17(7):2127-36.[PMID:10561268]
|
|
| 3) |
Packer RJ, Gajjar A, Vezina G, et al. Phase Ⅲ study of craniospinal radiation therapy followed by adjuvant chemotherapy for newly diagnosed average-risk medulloblastoma. J Clin Oncol. 2006;24(25):4202-8.[PMID:16943538]
|
|
| 4) |
Gajjar A, Chintagumpala M, Ashley D, et al. Risk-adapted craniospinal radiotherapy followed by high-dose chemotherapy and stem-cell rescue in children with newly diagnosed medulloblastoma(St Jude Medulloblastoma-96):long-term results from a prospective, multicentre trial. Lancet Oncol. 2006;7(10):813-20.[PMID:17012043]
|
|
| 5) |
Bailey CC, Gnekow A, Wellek S, et al. Prospective randomised trial of chemotherapy given before radiotherapy in childhood medulloblastoma. International Society of Paediatric Oncology(SIOP)and the(German)Society of Paediatric Oncology(GPO):SIOP Ⅱ. Med Pediatr Oncol. 1995;25(3):166-78.[PMID:7623725]
|
|
| 6) |
Taylor RE, Bailey CC, Robinson KJ, et al. Outcome for patients with metastatic(M2-3)medulloblastoma treated with SIOP/UKCCSG PNET-3 chemotherapy. Eur J Cancer. 2005;41(5):727-34.[PMID:15763649]
|
|
| 7) |
Tarbell NJ, Friedman H, Polkinghorn WR, et al. High-risk medulloblastoma:a pediatric oncology group randomized trial of chemotherapy before or after radiation therapy(POG 9031). J Clin Oncol. 2013;31(23):2936-41.[PMID:23857975]
|
|
| 8) |
von Bueren AO, von Hoff K, Pietsch T, et al. Treatment of young children with localized medulloblastoma by chemotherapy alone:results of the prospective, multicenter trial HIT 2000 confirming the prognostic impact of histology. Neuro Oncol. 2011;13(6):669-79.[PMID:21636711]
|
|
| 9) |
Rutkowski S, Gerber NU, von Hoff K, et al.;German Pediatric Brain Tumor Study Group. Treatment of early childhood medulloblastoma by postoperative chemotherapy and deferred radiotherapy. Neuro Oncol. 2009;11(2):201—10.[PMID:18818397]
|
|
| 10) |
Mason WP, Grovas A, Halpern S, et al. Intensive chemotherapy and bone marrow rescue for young children with newly diagnosed malignant brain tumors. J Clin Oncol. 1998;16(1):210-21.[PMID:9440745]
|
|
| 11) |
Geyer JR, Sposto R, Jennings M, et al.;Children’s Cancer Group. Multiagent chemotherapy and deferred radiotherapy in infants with malignant brain tumors:a report from the Children’s Cancer Group. J Clin Oncol. 2005;23(30):7621-31.[PMID:16234523]
|
|
| 12) |
Wetmore C, Herington D, Lin T, et al. Reirradiation of recurrent medulloblastoma:does clinical benefit outweigh risk for toxicity? Cancer. 2014;120(23):3731-7.[PMID:25080363]
|
|
| 13) |
Warmuth-Metz M, Blashofer S, von Bueren AO, et al. Recurrence in childhood medulloblastoma. J Neurooncol. 2011;103(3):705-11.[PMID:21069427]
|
|
| 14) |
Cefalo G, Massimino M, Ruggiero A, et al. Temozolomide is an active agent in children with recurrent medulloblastoma/primitive neuroectodermal tumor:an Italian multi-institutional phase Ⅱ trial. Neuro Oncol. 2014;16(5):748-53.[PMID:24482446]
|
|
| 15) |
Geoerger B, Chisholm J, Le Deley MC, et al.;European Consortium Innovative Therapies for Children with Cancer(ITCC). Phase Ⅱ study of gemcitabine combined with oxaliplatin in relapsed or refractory paediatric solid malignancies:An innovative therapy for children with Cancer European Consortium Study. Eur J Cancer. 2011;47(2):230-8.[PMID:20943374]
|
|
| 16) |
Park JE, Kang J, Yoo KH, et al. Efficacy of high-dose chemotherapy and autologous stem cell transplantation in patients with relapsed medulloblastoma: a report on the Korean Society for Pediatric Neuro-Oncology (KSPNO)-S-053 study. J Korean Med Sci. 2010; 25(8): 1160-6. [PMID: 20676326]
|
|
| 17) |
Dunkel IJ, Gardner SL, Garvin JH, Jr., et al. High-dose carboplatin, thiotepa, and etoposide with autologous stem cell rescue for patients with previously irradiated recurrent medulloblastoma. Neuro Oncol. 2010;12(3):297-303.[PMID:20167818]
|
|
| 18) |
Zwerdling T, Krailo M, Monteleone P, et al.;Children’s Oncology Group. Phase Ⅱ investigation of docetaxel in pediatric patients with recurrent solid tumors:a report from the Children’s Oncology Group. Cancer. 2006;106(8):1821-8.[PMID:16532433]
|
|
| 19) |
Hurwitz CA, Strauss LC, Kepner J, et al. Paclitaxel for the treatment of progressive or recurrent childhood brain tumors:a pediatric oncology phase Ⅱ study. J Pediatr Hematol Oncol. 2001;23(5):277-81.[PMID:11464982]
|
|
| 20) |
Kobrinsky NL, Packer RJ, Boyett JM, et al. Etoposide with or without mannitol for the treatment of recurrent or primarily unresponsive brain tumors:a Children’s Cancer Group Study, CCG-9881. J Neurooncol. 1999;45(1):47-54.[PMID:10728909]
|
|
| 21) |
Nitschke R, Parkhurst J, Sullivan J, et al. Topotecan in pediatric patients with recurrent and progressive solid tumors:a Pediatric Oncology Group phase Ⅱ study. J Pediatr Hematol Oncol. 1998;20(4):315-8.[PMID:9703003]
|
|
| 22) |
Dupuis-Girod S, Hartmann O, Benhamou E, et al. Will high dose chemotherapy followed by autologous bone marrow transplantation supplant cranio-spinal irradiation in young children treated for medulloblastoma? J Neurooncol. 1996;27(1):87-98.[PMID:8699230]
|
|
| 23) |
Heideman RL, Packer RJ, Reaman GH, et al. A phase Ⅱ evaluation of thiotepa in pediatric central nervous system malignancies. Cancer. 1993;72(1):271-5.[PMID:8508417]
|
|
| 24) |
Friedman HS, Krischer JP, Burger P, et al. Treatment of children with progressive or recurrent brain tumors with carboplatin or iproplatin:a Pediatric Oncology Group randomized phase Ⅱ study. J Clin Oncol. 1992;10(2):249-56.[PMID:1732426]
|
|
| 25) |
Osorio DS, Dunkel IJ, Cervone KA, et al. Tandem thiotepa with autologous hematopoietic cell rescue in patients with recurrent, refractory, or poor prognosis solid tumor malignancies. Pediatr Blood Cancer. 2018;65(1):10.[PMID:28905508]
|
|
| 26) |
29Aguilera D, Mazewski C, Fangusaro J, et al. Response to bevacizumab, irinotecan, and temozolomide in children with relapsed medulloblastoma:a multi-institutional experience. Childs Nerv Syst. 2013;29(4):589-96.[PMID:23296323]
|
|
| 27) |
Grill J, Geoerger B, Gesner L, et al.;European Consortium Innovative Therapies for Children with Cancer(ITCC)and the European Society for Paediatric Oncology(SIOPE)brain tumor group. Phase Ⅱ study of irinotecan in combination with temozolomide(TEMIRI)in children with recurrent or refractory medulloblastoma:a joint ITCC and SIOPE brain tumor study. Neuro Oncol. 2013;15(9):1236-43.[PMID:23857707]
|
|
| 28) |
Müller K, Mynarek M, Zwiener I, et al. Postponed is not canceled:role of craniospinal radiation therapy in the management of recurrent infant medulloblastoma--an experience from the HIT-REZ 1997 & 2005 studies. Int J Radiat Oncol Biol Phys. 2014;88(5):1019-24.[PMID:24661654]
|
|
| 29) |
Bakst RL, Dunkel IJ, Gilheeney S, et al. Reirradiation for recurrent medulloblastoma. Cancer. 2011;117(21):4977-82.[PMID:21495027
|
|
| 30) |
Sabel M, Fleischhack G, Tippelt S, et al.;SIOP-E Brain Tumour Group. Relapse patterns and outcome after relapse in standard risk medulloblastoma:a report from the HIT-SIOP-PNET4 study. J Neurooncol. 2016;129(3):515-24.[PMID:27423645]
|
|
|

|
| 目次へ戻る!
|

|
| 課題6:再発時の治療
|

|
| |
CQ9: 播種再発に対する適切な治療法は何か?
|

|
| |
推奨
寛解を目的とした治療を目指すが、治療反応性が不良の場合は、緩和的治療も提案される。(推奨度2D)
|
|

|
| |
解 説
|

|
| |
|
髄芽腫において再発の場合は局所再発と播種再発が認められるが、MRIを撮影する時期がずれれば、必ずしも正確な鑑別ができない場合がある。原発巣近傍の再発が認められ、なおかつ播種も認められる場合は、原発巣の再発から播種したのではないかという可能性もあるが、原発巣近傍に局所再発が認められずに播種再発だけ認められた場合は、初回治療の早い時期にすでに播種しており、後療法抵抗性の腫瘍細胞が播種していた場所で残存し、再発したと予想される。Hsiehら1)は、髄芽腫12例の脊髄播種症例を術前、術後1か月以内で、放射線治療や化学療法以前に認められた播種症例をearly metastasis群(9例)、放射線治療や化学療法を含む全ての初期治療終了後に播種再発した症例をlate metastasis群(3例)に分けて解析しているが、early metastasis群が統計学的に有意に予後良好(p=0.0047, log-rank test)という結果であった。 late metastasis群が予後不良の理由としては、 late metastasisとしての播種再発は、初期治療抵抗性の腫瘍細胞の残存が再発の起源になっている可能性が高いと考えられる。髄芽腫の播種再発は局所再発に比べて予後不良かという問題に関しては、Bowersら2)が、治療後の再発形式で予後を比較している。彼らは41例の髄芽腫再発症例において、21例の原発巣の部位だけの再発群と20例の局所再発群と播種を伴う再発群の生存予後を比較している。手術、化学療法、放射線療法と再発後の治療はばらつきがあるものの、彼らの解析では、初期治療にてBaby POG protocol(POG infant brain tumor regimen / シクロホスファミド, ビンクリスチン, シスプラチン, エトポシド)を受けているかどうか(p=0.030, log-rank test)、再発時に播種なく原発巣だけの局所再発だけかどうか(p=0.008, log-rank test)、再発時には放射線治療を加えているかどうか(p=0.015, log-rank test)ということが有意に生存を延長させる因子であったが、多変量解析の結果では、原発巣の場所における局所再発(21例)という因子だけが、播種を伴う症例(20例)に比べて明らかに生存が延長しており(p=0.03)、独立した予後良好因子であった。更に、局所再発と播種再発を生物学的に異なるものとして区別すべきかという問題はあるが、近年髄芽腫の分子生物学的分類が提唱されて後、Ramaswamyら3)は3つのコホート研究を集計した。髄芽腫分子生物学的分類4型のそれぞれの再発形式では、Sonic Hedghoc(SHH)型は他の型に比べて局所再発が多く、播種再発が少ないという結果であった。局所再発と播種の両方もあるMixedな再発形式もSHH型は少ないことから、生物学的に他のグループより局所に再発しやすい、もしくは播種しにくいということは言えるかもしれない。しかしWNT型は再発が少なくてこの研究では解析されていない。
髄芽腫の再発治療においては、一般的に局所再発だけであれば手術という選択肢も可能な場合があるが、播種を伴う再発であればほとんど外科的介入はなく、他の治療に委ねられる場合が多い。初期治療として放射線治療を行っている場合、salvage therapyとしての再照射を行う可能性は存在するものの4,5)、全例に施行可能とは言いがたく、一般的ではない。Bakstら5)は初期治療にて放射線照射を行っている髄芽腫症例に対して再発時に再照射をおこなった13例を検討している。再照射の中央線量は30Gy、一回線量中央値は1.5Gyであり、54%の症例において強度変調放射線治療が使用されていた。13例の5年PFSは48%、5年OSは65%であり、放射線障害による急性期障害、急死や、二次性癌は観察期間中には認められておらず、放射線壊死が1例、38%に聴力障害、15%に下垂体機能不全、1例に認知機能障害の有害事象が認められたと報告している。しかし、この治療成績は放射線治療単独ではなく、再発時の手術や化学療法と併用しており、また、局所再発と播種再発の治療成績を区別していないために、播種再発で放射線治療の再照射の有用性を正確には評価できない。現時点では、播種再発症例において初期治療で放射線照射を施行していない場合では、積極的に再発時放射線照射ということが選択肢になるが、すでに放射線治療を行っている症例の再発時の再照射は再発腫瘍のコントロール、有害事象の面からも積極的に推奨できないと思われる。
再発時の化学療法においては一般的な化学療法に加えて、末梢血幹細胞移植を伴う大量化学療法などのintensiveな治療の報告も多数ある6-9)。しかしながら、レジメンとして統一したものではなく、主にカルボプラチン、エトポシド、チオテパ、シクロホスファミド、メルファラン、BCNU(カルムスチン)、CCNU(ロムスチン)など使用されている場合が多い。Gilmanら6)は 18例の再発髄芽腫の患者に対して連続した大量化学療法(First cycle:チオテパ600~750㎎、BCNU 300~450㎎、Second cycle :チオテパ 600 ~750㎎、カルボプラチン 1200mg)による治療を行っているが、局所再発と播種再発の治療成績の区別はない。しかし、18例中15例が播種再発であり、播種再発の割合が高い報告である。末梢血幹細胞移植を併用した大量化学療法の予後不良因子として一般的に播種再発があるといわれているが、彼らは必ずしも播種再発が予後不良因子とは結論づけておらず、播種再発例における生存率33%(18例中15例、観察期間54~135ヶ月)という治療成績であった。8例において何らかの治療関連死亡が認められており、比較的高頻度な有害事象と思われる。いくつかの報告をまとめても、現時点で有害事象も併せて考え、播種再発において必ずしも末梢血幹細胞移植を併用した大量化学療法が必須とは言い難い。更に大量化学療法の中でも最も優れたレジメンを同定しがたく、また、欧米と本邦では保険制度等の違いから使用できる薬剤が異なっており、今後本邦での臨床研究を通じた使用薬剤の適応拡大が待望されている。Kimら10)は5種類の通常量の化学療法剤を使用したsalvage therapyとして7例の脊髄播種症例を含む再発小児悪性腫瘍に対する化学療法の有効性を検討している。イリノテカン300㎎/m2,ビンクリスチン 2㎎/ m2、シスプラチン 60㎎/ m2、シクロホスファミド 1000㎎/ m2、エトポシド100㎎/ m2の薬剤を使用しているが、大量化学療法より副作用は軽微であり、3例がCR、2例がPRという比較的良好な治療反応性を認めている。しかし6例がPDであり、この結果からはいかに多くの薬剤を使用した多剤併用化学療法を行っても通常の量では、播種再発の髄芽腫をコントロールすることは困難であるとの印象である。
21例の播種再発髄芽腫に対して、Yoshimuraら11)は6-7 mg /m2のニムスチンの髄腔内灌流もしくは3-3.5mg/m2の髄腔内投与を行っている。約50%の症例において反応が認められ、21例中7例がCRとなり、比較的長期の生存を獲得している。播種確認後の5年生存率は46.4%であり、彼らは播種が存在する髄芽腫患者の治療法において化学療法剤の髄腔内投与の有効性を示している。この治療法による副作用として灌流療法による副作用はほとんどみられていない一方、髄腔内投与(Bolus injection)に関しては脊髄炎が認められた症例があり、頻回の投与と局所的に薬剤が高濃度になることは避けるべきと言及している。現在、髄芽腫の初期治療において、予防的、あるいは腫瘍縮小を目的としてメトトレキサートの髄腔内投与を行う事も多いが、播種再発に化学療法剤の髄腔内投与が有効な治療かどうかは報告が少なく、現時点ではその有効性は判断できない。播種再発の症例において治癒を目指して様々な治療を行ったとしても、現存の治療では有効性があるとは言い難いとも報告されている。Massiminoら4)は播種再発が認められた髄芽腫症例にシスプラチンとエトポシドを用いた標準的化学療法(6例)、もしくはエトポシド、シクロホスファミド、ビンクリスチン、カルボプラチン、チオテパなどを用いた大量化学療法(10例)を施行し、更に7例は全脳脊髄照射(CSI)、3例は局所照射を行うというintensiveな治療を行なった。Disease Free Survival(DFS)中央値は16ヶ月、Overall survival(OS)中央値は41ヶ月、3年DFSが19%、3年OSが56%という治療成績であり、観察期間での生存例は1例のみであった。これらの結果を鑑み、彼らは別の報告で髄芽腫の再発症例に対しできるだけ短い入院期間を目指し、生活の質(QOL)を重視した再発の治療を推奨している12)。彼らは18例の再発の髄芽腫患者の治療後、 17例に再再発が認められ、16例は播種病変を確認されている。3回目の再発10例中9例が播種再発であり、全例に化学療法が施行されているが、手術や放射線治療が行われたものはない。本報告の再発症例全例の入院期間は4日から129日(平均19日)であり、治療による有害事象がなかったと報告している。治療成績においては、8例の再発髄芽腫の症例の平均DFSは7ヶ月、平均OSも7ヶ月であり、最終的には全例死亡している。以上より播種再発は局所再発と比較してやはり予後不良であると考えるべきである。
髄芽腫の播種再発に対しては、現存の治療にて治癒できる症例は稀と言わざるを得ない。対象が小児であるがゆえに積極的な治療を行うべきと考える一方で、QOLを保ちながら緩和的な治療も重要であると考えられる。
|

|
| |
注意:
|
| |
|
|
シクロホスファミド(cyclophosphamide):神経腫瘍の自覚的ならびに他覚的症状の寛解として保険適応
ビンクリスチン(vincristine):小児脳腫瘍に対して保険適応
シスプラチン(cisplatin):小児悪性脳腫瘍に対する他の抗悪性腫瘍剤との併用として保険適応
エトポシド点滴静注(etposide):小児悪性固形腫瘍に対する他の抗悪性腫瘍剤との併用として保険適応
エトポシドカプセル(etposide capsule):髄芽腫、小児悪性固形腫瘍には保険適応外
カルボプラチン(carbplatin):小児悪性固形腫瘍に対する他の抗悪性腫瘍剤との併用として保険適応
チオテパ(thiotepa):小児悪性固形腫瘍における自家造血幹細胞移植の前治療として保険適応
メルファラン(melphalan):小児固形腫瘍の造血幹細胞移植時の前処置として保険適応
カルムスチン(carmustine: BCNU):国内未承認
ロムスチン(lomustine: CCNU):国内未承認
イリノテカン(irinotecan):小児悪性固形腫瘍として保険適応
メトトレキセート(methotrexate):髄芽腫に対しては保険適応外
ニムスチン(nimustine: ACNU):脳腫瘍に対する自覚的ならびに他覚的症状の緩和として静脈内投与は保険適応、髄腔内投与薬としては保険適応外
|

|
| |
|
CQ9:検索式
|
| |
|
| (((Medulloblastoma[Mesh] OR Medulloblastoma*[tiab] OR Melanocytic Medulloblastoma*[tiab] OR Childhood Medulloblastoma*[tiab] OR Medullomyoblastoma*[tiab] OR Desmoplastic Medulloblastoma*[tiab]) AND (Neoplasm Recurrence, Dissemination[Mesh] OR Neoplasm Seeding[Mesh] )) OR (( Medulloblastoma[Mesh] OR Medulloblastoma*[tiab] OR Melanocytic Medulloblastoma*[tiab] OR Childhood Medulloblastoma*[tiab] OR Medullomyoblastoma*[tiab] OR Desmoplastic Medulloblastoma*[tiab]) AND (Multiple Recurrence[Mesh] OR Dissemination [Mesh] )) OR ((Medulloblastoma[Mesh] OR Medulloblastoma*[tiab] OR Melanocytic Medulloblastoma*[tiab] OR Childhood Medulloblastoma*[tiab] OR Medullomyoblastoma*[tiab] OR Desmoplastic Medulloblastoma*[tiab]) OR (Neoplasm Recurrence[Mesh] OR Neoplasm Recurrences[tiab] OR Recurrences[tiab] OR Relapse[tiab] OR Relapses[tiab] OR Regrowth[tiab]))) AND 1900/01/01:2018/12/31[dp]
|
| 以上の検索式により抽出された641論文のなかから、できるだけ播種再発を多く含む症例の24論文を抽出し、システマティックレビューを行い、構造化抄録を作成した。更にその中で局所再発でも同様な治療を行うもの、また症例数が少ないものなどを排除し、最終的に12論文を取り上げて、解説文を作成した。
|
|

|
| |
|
| |
|
| 参考文献
|
| 1) |
Hsieh PC, Wu CT, Lin KL, et al. The clinical experience of medulloblastoma treatment and the significance of time sequence for development of leptomeningeal metastasis. Childs Nerv Syst. 2008;24(12):1463-7.
|
|
| 2) |
Bowers DC, Gargan L, Weprin BE, et al. Impact of site of tumor recurrence upon survival for children with recurrent or progressive medulloblastoma. J Neurosurg. 2007;107(1 Suppl):5-10.
|
|
| 3) |
Ramaswamy V, Remke M, Bouffet E, et al. Recurrence patterns across medulloblastoma subgroups: an integrated clinical and molecular analysis. Lancet Oncol. 2013;14(12):1200-7.
|
|
| 4) |
Massimino M, Gandola L, Spreafico F, et al. No salvage using high-dose chemotherapy plus/minus reirradiation for relapsing previously irradiated medulloblastoma. Int J Radiat Oncol Biol Phys. 2009;73(5):1358-63.
|
|
| 5) |
Bakst RL, Dunkel IJ, Gilheeney S, et al. Reirradiation for recurrent medulloblastoma. Cancer. 2011;117(21):4977-82.
|
|
| 6) |
Gilman AL, Jacobsen C, Bunin N, et al. Phase I study of tandem high-dose chemotherapy with autologous peripheral blood stem cell rescue for children with recurrent brain tumors: a Pediatric Blood and MarrowTransplant Consortium study. Pediatr Blood Cancer. 2011;57(3):506-13.
|
|
| 7) |
Park JE, Kang J, Yoo KH, et al. Efficacy of high-dose chemotherapy and autologous stem cell transplantation in patients with relapsed medulloblastoma: a report on the Korean Society for Pediatric Neuro-Oncology (KSPNO)-S-053 study. J Korean Med Sci. 2010;25(8):1160-6.
|
|
| 8) |
Dunkel IJ, Gardner SL, Garvin JH, Jr., et al. High-dose carboplatin, thiotepa, and etoposide with autologous stem cell rescue for patients with previously irradiated recurrent medulloblastoma. Neuro Oncol. 2010;12(3):297-303.
|
|
| 9) |
Gururangan S, Krauser J, Watral MA, et al. Efficacy of high-dose chemotherapy or standard salvage therapy in patients with recurrent medulloblastoma. Neuro Oncol. 2008;10(5):745-51.
|
|
| 10) |
Kim H, Kang HJ, Lee JW, et al. Irinotecan, vincristine, cisplatin, cyclophosphamide, and etoposide for refractory or relapsed medulloblastoma/PNET in pediatric patients. Childs Nerv Syst. 2013;29(10):1851-8.
|
|
| 11) |
Yoshimura J, Nishiyama K, Mori H, et al. Intrathecal chemotherapy for refractory disseminated medulloblastoma. Childs Nerv Syst. 2008;24(5):581-5.
|
|
| 12) |
Massimino M, Casanova M, Polastri D, et al. Relapse in medulloblastoma: what can be done after abandoning high-dose chemotherapy? A mono-institutional experience. Childs Nerv Syst. 2013;29(7):1107-12.
|
|
|

|
| 目次へ戻る!
|

|
| 課題7:治療による晩期障害
|

|
| |
CQ10: 髄芽腫に特徴的な晩期障害とそれをきたしやすい背景因子は何か?
|

|
| |
推奨1
無言症/後頭蓋窩症候群では学習機能が低下するので特に注意して経過を見ることを推奨する。(推奨度1B)
|
推奨2
髄芽腫治療後に経時的に認知機能障害は進行し、特に高リスク群と低年齢(7歳以下)でその傾向が強いので特に注意して経過を見ることを推奨する。(推奨度1C)
|
|

|
| |
解 説
|

|
| |
|
髄芽腫治療の進歩によって長期生存が得られるようになると、様々な晩期障害が認められるようになった。小児がん患者全体を対象とした長期生存者に対する長期フォローアップの指標はいくつか発表されており、例えば海外のものではCOGのガイドライン( http://www.survivorshipguidelines.org )があり、国内でもJCCG(日本小児がん研究グループ Japan Children’s Cancer Group)の小児がん長期フォローアップガイドがある。また、妊孕性に関しては、日本癌治療学会のガイドライン( http://www.jsco-cpg.jp/fertility/ )がある。髄芽腫治療後のフォローアップの指標としても参考となる。
今回はあくまで髄芽腫の治療による晩期障害に焦点をあてて推奨を作成した。晩期障害からみて、髄芽腫のフォローアップで特に注意すべき場合がどのような症例かを検討した。晩期障害に関する文献は、髄芽腫以外の小児脳腫瘍も含むものが多く、ほとんどが後方視的な検討であり、それらは参考として、本推奨は髄芽腫の治療による晩期障害の前向きコホート研究を中心にまとめた。
1990年代のPOG8631の知的予後に関する報告1)は3歳以上の髄芽腫で残存腫瘍が1.5cm2未満の22症例において、全脳脊髄の照射量36Gy/23.4Gyと8.85歳を基準としたyounger/olderで4群に分類し、IQを比較したものである。症例数も少なくそれぞれの群間で有意差は出ておらず、また縦断的研究ではなく、ワンポイントでの評価ではある。いずれの群でも単にFull scale IQが低下していることは示しているが、その原因が何であるのかには言及していない。この研究では評価方法としてはWISK IIIもしくはWAIS-RをIQの評価として用いており、学習能力評価としてWide Range Achievement Test IIIを用いている。
これ以降の論文でも、主にIQの評価はWISK III or IVとWAIS-Rが用いられるが、そもそも髄芽腫患者の場合小脳失調症状を後遺することが多く、それがFull scale IQの低下に影響している可能性も考える必要がある。したがって、純粋な認知機能低下の進行を捉えるためには、前向きに縦断的に調査しIQでもどの要素が変化していくのかを評価することが必要である。
2000年代のCCG9892の知的予後に関する結果2)は、3-15歳で播種のない(標準リスク群)43例で全脳脊髄照射(CSI) 23.4Gy + ブースト照射 32.4Gy、ビンクリスチン/CCNU(ロムスチン)/シスプラチンで治療した結果を、放射線治療後を起点に4年後まで経時的に調査した結果である。評価方法は、WISK-R/WISC-III/WPPSI-R/SB4/McCarthyと様々である。ここではFull Scale IQが経時的に低下する(4.3/年)ことを示す一方で、男女差(女子の方がVerbal IQ低下が大きい)、診断時の年齢による差(7歳未満では低下するが7歳以上では低下しない)、Baseline IQでの差(IQ>100では低下の程度が大きい)などを示している。
2000年代のもう一つの論文はSJMB96に登録された症例のうち111例での検討である3)。最大6年(平均3.14年)の経時的な認知機能評価を受けた。高リスク群(CSI:36-39.6Gy)/標準リスク群(CSI:23.4Gy)と診断時の年齢(7歳以上/7歳未満)で4群に分類された。化学療法は4サイクルの大量化学療法(シクロホスファミド/シスプラチン/ビンクリスチン)が行われた。認知機能評価の初回は手術摘出後(登録時)で、その後1、2、5年の段階で評価した。多変量解析の結果全体ではmean IQ(−1.59/y, P=.006)、読み(−2.95/y, P<.0001)、書き(−2.94/y, P<.0001)、算数(−1.87/y, P=.003)とも低下したが、群間比較ではmean IQは高リスク群では低下したが(−3.00/y, P=.004)、標準リスクでは低下していなかった(−0.99/y, P=.13)(ただし2群間に有意差はない)。また同様に mean IQは7歳未満群では低下したが(−3.05/y, P=.0005)、7歳以上群では低下しなかった(−0.61/y, P=.37)(2群間に有意差あり)。治療線量より治療時年齢の方がIQ低下の要素として強いと示された。ただし研究全体の規模からすると評価を受けた登録例は少なく、評価方法に関しても年齢によって様々であった。
2010年代になるといくつかの前向きコホート研究が発表されている。
1つめはCOG A9961の標準リスク群に対する放射線治療(CSI 23.4Gy/ブースト照射32.4Gy)と大量化学療法(CCNU/シスプラチン/ビンクリスチン または シクロホスファミド/シスプラチン/ビンクリスチン)後の知的・学業予後に関する報告4)である。登録全体379例中110例について5年以上の経過で評価した。Baselineの評価は放射線治療から9か月以内に施行された。評価方法は、IQに関してはWPPSI-R/WISC-III/WAIS-R/WAIS-III を用い、学習能力評価には Wide Range Achievement Test IIIなどが用いられた。全症例をまとめたデータでFull Scale IQは5年間にわたり年間1.9ポイント低下した。IQおよび学習能力の低下は、男女差はなく、無言症の有無でFull Scale IQとPerformance IQおよびReadingで有意差があった。Baseline IQの方が高い(IQ>100)方がFull Scale IQ低下の程度が有意に大きく、診断時7歳以上と7歳以下では7歳以下の症例のPerformance IQ低下率が有意に高く、摘出率では全摘群の方が低下率は高いが有意差はなかった。
無言症の有無での評価はSJMB03に登録された327名中、後頭蓋窩症候群(主には無言症)を呈した36例についての前向き試験報告5)がある。SJMB03治療は播種と脳幹浸潤がない例で、肉眼的全摘出された群を標準リスク群としてそれ以外を高リスク群とし、標準リスク群にはCSI 23.4Gy、高リスク群にはCSI 36-39.6Gyで局所55.8Gyの放射線治療を行っている。放射線照射治療6週後から、4サイクルの高用量のシクロホスファミド/シスプラチン/ビンクリスチンからなる化学療法を施行した。同じ試験の登録例で後頭蓋窩症候群を呈さなかった例で年齢・人種・リスク分類・手術・性別を一致させた36例を対照として、神経心理学的評価を経時的に1、3、5年後に、知的能力の他に遂行速度、注意力、ワーキングメモリー、空間認知機能など様々な視点で評価した。後頭蓋窩症候群の有無によりbaselineからこれらの能力に差があるが、対照群が5年間で不変なのに対し、後頭蓋窩症候群は不変もしくは低下しており有意差がみられた。この2つの報告をあわせて評価シートを作成すると、後頭蓋窩症候群がある群とない群ではQOLや高次機能においてbaselineでも差があり5年後さらに差が広がる、というエビデンスが示された。
遂行速度、注意力、ワーキングメモリーなどについて前向きで縦断的に検討した報告6)もある。これは上記のSJMB03の登録(この時点ではまだ318名)から後頭蓋窩症候群を除き、その他の不適格例を除いた126例の検討である。Baselineの機能の評価は手術後(登録直後)に行い、1、3、5年後と経時的に前向き試験で行われた。評価はWoodcock-Johnson Tests of Cognitive Abilities Third Edition、Woodcock-Johnson Tests of Achievement Third Editionを用いた。遂行能力はbaselineから低下しており、経時的変化は低年齢、高リスク群、baseline scoreが高い場合により低下する傾向にあった。計算式で推定すると標準リスク群では診断時年齢6歳では軽度低下がみられたが10歳では変化なく14歳では上昇・改善し、一方高リスク群では6歳、10歳では著明に低下したが14歳では低下がみられなかった。 Baselineでの遂行能力の低下は小脳失調を避けがたい疾患特異性の影響が考えられる。ワーキングメモリーや注意力はbaselineでの低下はなく、経時的変化については 高リスク群、baseline scoreが高い場合により低下する傾向にあった。
ここまで記載したものは北米からの報告だが、欧州からはHIT-SIOP PNET4 phase3 European RCTの報告がある7)。標準リスク群の髄芽腫患者を過分割照射群(過分割群:1日2回1Gy照射、CSI 36Gy、後頭蓋窩60Gy)と標準分割照射群(標準分割群:1日1.8Gy週5日照射、CSI 23.4Gy、後頭蓋窩54Gy)にランダム化を行い、照射中のビンクリスチンと8サイクルのCCNU/シスプラチン/ビンクリスチンを行った。認知機能については9か月寛解状態を得た137例(過分割群71/107名、標準分割群66/109名)で平均3年の経過で評価を行った。評価法はWISCを基本に各国によって評価法を選択した。年齢についても8歳以上と以下で比較した。結果としてこの研究では治療法や年齢による有意な差は認められず、全体的にも経時的なIQの低下はみられていない。北米の結果と異なり、IQの低下を認めなかった理由として観察期間が短いことが影響している可能性はある。
陽子線治療による生活の質(QOL)の変化を前向きに観察したマサチューセッツ総合病院からの報告8)がある。評価法としてこれまでの報告と異なりPedsQL version4.0を用いており、self-reportができる年齢層が対象となった。2002年から2015年までの登録例161例中、116例で、平均5年間の経過で評価を行った。この症例群には8歳以上も以下もいて、標準リスクと高リスクもあり、播種や後頭蓋窩症候群のある例ない例も含まれており、かなり雑多な集団である。評価はTCS(total core score)で行われるが、当初TCSが低かった児でも徐々に改善するが、最終的に健常小児と比較すると低い値であった。評価法として興味は惹かれるが、陽子線の影響を真に評価をするまでには至らない。
以上をまとめると、髄芽腫に対する治療によるIQの低下は認めないという報告もある一方、北米での前向き試験の結果からは、無言症/後頭蓋窩症候群のある場合は認知機能(特に学習)に関して低下する、ということが言える。また、髄芽腫の治療後5年の経過で経時的にIQが低下するが、高リスク群でその傾向が強い。ただしこれが、疾患によるものなのか、治療(特に放射線照射線量)の差によるものなのかはわからない。また低年齢(7歳以下)では低下の程度が強いことも示唆された。問題は、経過観察は長くても10年程度で、平均では5年に満たない場合が多い点で、晩期合併症に対する真の評価としては、より長期の結果が望まれる。そのようなデータは前向きコホート研究ではまだ存在せず、後ろ向きのデータしかなく、したがって、様々なバイアスを有しており正確な評価とならない。
代表的な後方視的検討結果報告としてChildhood Cancer Survivor Studyからの報告9,10)を参考として紹介する。2017年のものは1970-1986 年に診断され5年以上生存した380例についてその同胞と比較した研究で、聴力低下、脳卒中頻度、けいれん、平衡機能低下、白内障の頻度が高く、学習、結婚、自立した生活などでも差が見られた。2019年のものは1970-1999年に診断され5年以上生存していた髄芽腫患者の晩期のmorbidity/mortalityに関する報告である。これによると5年経過後も死亡する例はあり、再発によるものも、それ以外の原因もある。これらを除いた997例の生存者で後方視的にみた場合、年を追って重篤な合併症を持つ頻度が増している。またこれは1970年代に治療した群と1990年代に治療した群で比較すると後者で有意にその頻度が高い。特に聴力障害や心血管系のリスクが高い。治療別にみると、高リスク群で治療を行った場合に頻度が高い。ただし、内分泌障害や神経学的な障害の頻度は決して高くない。これらの報告はあくまで後方視的に長期間の治療例を評価したもので、背景因子が異なり合併症の頻度に何が影響したのかはわからない。あくまで、長期間の経過観察が必要である、とするのみである。
また、今回はシステマティックレビューの対象には認知機能障害に関するもののみが残ったが、晩期合併症としてはこのほかにも内分泌障害11)、性腺機能障害12)、聴力障害9)、海綿状血管腫の形成13)、その他血管障害9)、二次がん14)などの可能性がある。二次がんとしては悪性神経膠腫、血液がん、甲状腺癌などが報告されている。しかし、これらの報告は、髄芽腫以外の小児脳腫瘍を含んでいたり、後方視的な治療症例集積で背景因子が様々あることなどが指摘され、今回は情報として参考までに記載しておくにとどめる。
やはり今後は結果が得られるまで時間はかかるであろうが長期間の前向き研究が必要で、その結果によって治療法の選択を検討したり、どの時期にどのような介入が必要となるかなどの臨床的疑問に対する回答が抽出されることを期待する。
現時点で提言できることは、髄芽腫に関して、再発のみならず晩期合併症を考慮した長期的かつ多角的(多職種を含む)フォローアップが必要であるということに尽きる。
|

|
| |
|
CQ10:検索式
|
| |
|
| ((((((((medulloblastoma[mh]) OR (medulloblastoma*[tiab]) OR (melanocytic[tiab] AND medulloblastoma*[tiab]) OR (childhood[tiab] AND medulloblastoma*[tiab]) OR (medullomyoblastoma*[tiab]) OR (desmoplastic[tiab] AND medulloblastoma*[tiab]) OR (adult[tiab] AND medulloblastoma*[tiab])))))) AND (((((((((long term adverse effects[mh]) OR long term effect*[tiab]) OR long term outcome[tiab]) OR lete effect*[tiab])) OR ((quality of life[mh]) OR quality of life[tiab])) OR (((cognition disorders[mh]) OR cognitive funtion[tiab]) OR neurocognitive function[tiab])) OR (((((((((((((((social adjustment[mh]) OR social outcome[tiab]) OR functional outcome[tiab]) OR physical outcome[tiab]) OR developmental disorders[mh]) OR growth disorders[mh]) OR (growth and development/radiation effects[mh])) OR physiology/radiation effects[mh]) OR intelligence/radiation effects[mh]) OR intelligence/drug effects[mh]) OR learning disorders[mh]) OR intellectual outcome[tiab]) OR academic success[mh]) OR academic outcome[tiab]) OR academic achievement[tiab])) OR ((((growth hormone/radiation effects[mh]) OR GH hormone[tiab]) OR radiation injuries[mh]))))) AND 1900/7/1:2018/12/31[dp]
|
| 以上の検索式から597論文が抽出され、1次スクリーニングで75論文にしぼられた。2次スクリーニングを行って、前向きコホート研究の8論文を採択し、SRを行って評価シートの作成、エビデンス総体を導き出して、それらに基づいて推奨と解説文を作成した。
|
|

|
| |
|
| |
|
| 参考文献
|
| 1) |
Mulhern RK, Kepner JL, Thomas PR, et al. Neuropsychologic functioning of survivors of childhood medulloblastoma randomized to receive conventional or reduced-dose craniospinal irradiation: a Pediatric Oncology Group study. J Clin Oncol. 1998;16(5):1723-8.
|
|
| 2) |
Ris MD, Packer R, Goldwein J, et al. Intellectual outcome after reduced-dose radiation therapy plus adjuvant chemotherapy for medulloblastoma: a Children's Cancer Group study. J Clin Oncol. 2001;19(15):3470-6.
|
|
| 3) |
Mulhern RK, Palmer SL, Merchant TE, et al. Neurocognitive consequences of risk-adapted therapy for childhood medulloblastoma. J Clin Oncol. 2005;23(24):5511-9.
|
|
| 4) |
Ris MD, Walsh K, Wallace D, et al. Intellectual and academic outcome following two chemotherapy regimens and radiotherapy for average-risk medulloblastoma: COG A9961. Pediatr Blood Cancer. 2013;60(8):1350-7.
|
|
| 5) |
Schreiber JE, Palmer SL, Conklin HM, et al. Posterior fossa syndrome and long-term neuropsychological outcomes among children treated for medulloblastoma on a multi-institutional, prospective study. Neuro Oncol. 2017;19(12):1673-82.
|
|
| 6) |
Palmer SL, Armstrong C, Onar-Thomas A, et al. Processing speed, attention, and working memory after treatment for medulloblastoma: an international, prospective, and longitudinal study. J Clin Oncol. 2013;31(28):3494-500.
|
|
| 7) |
Câmara-Costa H, Resch A, Kieffer V, et al. Neuropsychological Outcome of Children Treated for Standard Risk Medulloblastoma in the PNET4 European Randomized Controlled Trial of Hyperfractionated Versus Standard Radiation Therapy and Maintenance Chemotherapy. Int J Radiat Oncol Biol Phys. 2015;92(5):978-85.
|
|
| 8) |
Kamran SC, Goldberg SI, Kuhlthau KA, et al. Quality of life in patients with proton-treated pediatric medulloblastoma: Results of a prospective assessment with 5-year follow-up. Cancer. 2018;124(16):3390-400.
|
|
| 9) |
King AA, Seidel K, Di C, et al. Long-term neurologic health and psychosocial function of adult survivors of childhood medulloblastoma/PNET: a report from the Childhood Cancer Survivor Study. Neuro Oncol. 2017;19(5):689-98.
|
|
| 10) |
Salloum R, Chen Y, Yasui Y, et al. Late Morbidity and Mortality Among Medulloblastoma Survivors Diagnosed Across Three Decades: A Report From the Childhood Cancer Survivor Study. J Clin Oncol. 2019;37(9):731-40.
|
|
| 11) |
Laughton SJ, Merchant TE, Sklar CA, et al. Endocrine outcomes for children with embryonal brain tumors after risk-adapted craniospinal and conformal primary-site irradiation and high-dose chemotherapy with stem-cell rescue on the SJMB-96 trial. J Clin Oncol. 2008;26(7):1112-8.
|
|
| 12) |
Balachandar S, Dunkel IJ, Khakoo Y, et al. Ovarian function in survivors of childhood medulloblastoma: Impact of reduced dose craniospinal irradiation and high-dose chemotherapy with autologous stem cell rescue. Pediatr Blood Cancer. 2015;62(2):317-21.
|
|
| 13) |
Lew SM, Morgan JN, Psaty E, et al. Cumulative incidence of radiation-induced cavernomas in long-term survivors of medulloblastoma. J Neurosurg. 2006;104(2 Suppl):103-7.
|
|
| 14) |
Packer RJ, Zhou T, Holmes E, et al. Survival and secondary tumors in children with medulloblastoma receiving radiotherapy and adjuvant chemotherapy: results of Children's Oncology Group trial A9961. Neuro Oncol. 2013;15(1):97-103.
|
|
|

|
| 目次へ戻る!
|

|
|

|
| |

|
|

|
|
|

|
|

