
|
| 成人膠芽腫 総論
|

|
| |
1 本ガイドラインの目的
|

|
| |
|
膠芽腫(glioblastoma)に罹患している個々の成人症例において,適切な治療方針を検討するうえで必要となる重要な臨床事項を臨床的疑問(clinical question:CQ)として提示し,本ガイドライン作成時点でのエビデンスに基づく推奨事項を述べる。 |
|

|
| |
2 対象患者
|

|
|
|
| |
3 利用対象者
|

|
|
|

|
| |
4 成人転移性脳腫瘍の概括
|

|
| |
| |
1. |
膠芽腫の定義
(注:本ガイドライン中の脳腫瘍病理分類の記載は前版を継承しているため、2021年に改訂が行われたWHO脳腫瘍分類第5版には準拠しておらず、次回以降の改訂にて、順次記載を更新していく予定である。)
神経膠腫は,神経細胞の支持組織であるグリア細胞から発生すると考えられている原発性脳腫瘍であり,星細胞系腫瘍が神経膠腫の約80%を占める1)。
WHO分類においては,原発性脳腫瘍はその病理組織学的な悪性度と予後の組み合わせによって良いほうから悪いほうへgradeⅠ~gradeⅣに細分類されるが,膠芽腫はgrade Ⅳの星細胞腫に相当する。膠芽腫は1931年にPenfieldによって命名された。gradeⅠおよびⅡの星細胞腫はあわせて分化型星細胞腫と呼ばれるのに対し,歴史的にはgradeⅢ(退形成性星細胞腫)およびⅣ(膠芽腫)をあわせて悪性神経膠腫(malignant glioma)と呼ばれることもある。過去の多くの臨床研究において,このgradeⅣ(膠芽腫)およびⅢ(退形成性星細胞腫),退形成性乏突起膠腫や退形成性乏突起星細胞腫が悪性神経膠腫という用語のもとに同時に扱われている2)。
膠芽腫単独では頭蓋内腫瘍の約10%を占め,多くは成人に発生する。年代別では50~60歳に多く発生し,やや男性に多い。好発部位は大脳半球で,前頭葉に最も発生しやすい。脳実質への強い浸潤性格を有し,脳梁を介して反対側の大脳白質への進展もある。組織学的には,細胞密度が高く,円形,紡錘形などさまざまな形態を示す細胞がみられる。腫瘍細胞の核には,クロマチンの増量,大小不同,多核,巨核があり,核分裂像も多数認められる。大小の壊死像があり,壊死巣周囲の核の柵状配列(palisading)は特徴的な構造である2)。その臨床経過によって,前病変なく発生する原発性膠芽腫(primary glioblastoma)とgradeⅡやⅢの神経膠腫から悪性転化するかたちで膠芽腫と診断される続発性膠芽腫(secondary glioblastoma)に区別され,前者はやや高齢者に多い傾向がある2)。病理形態学的に両者の鑑別は困難であるが,遺伝子異常のパターンをみるとかなり明確な違いがあり,特にクエン酸回路に関与する酵素であるisocitrate dehydrogenase 1/2(IDH1/2)をコードするIDH1/2遺伝子の変異は原発性膠芽腫では稀で,続発性膠芽腫の多くでみられることが近年明らかになっている3,4)。
膠芽腫は標準治療が可能な患者においてさえ,生存期間中央値が20.0カ月であり,ほぼ治癒不能な疾患である1)。長い間,術後放射線治療が生存期間を有意に延長させる唯一の治療方法であり,化学療法は生存期間延長に寄与しない,あるいはわずかに延長させるだけであるとされてきた5)。しかし,2005年に発表されたランダム化比較試験において,テモゾロミド(TMZ)の放射線治療との併用とその後の維持療法の有効性が認められ,TMZ化学療法が広く行われるようになった6)。
|

|
| |
2. |
膠芽腫の予後因子
Report of Brain Tumor Registry of Japan(2005-2008)によれば,膠芽腫の5年生存割合は16%程度である1)。Curranらは,米国Radiation Therapy Oncology Group(RTOG)の臨床試験に登録された1,578例の悪性神経膠腫の背景因子と治療因子をrecursive partitioning analysis(RPA)によって分析した。予後に影響する因子として,組織型(grade),年齢,手術摘出度(亜全摘vs部分摘出),術前の全身状態(Karnofsky performance status:KPS,mental status,symptomatic time),照射線量,術後の全身状態を挙げている7)。RTOGはさらに膠芽腫に絞って症例を追跡し,1,672例について解析した結果を2011年に発表した8)。この解析ではオリジナルのRPAクラスⅤとⅥを新しいクラスⅤにまとめて単純化した結果,① 年齢,② 術前の全身状態(KPS),③ 手術摘出度,④ 術後の全身状態,の4項目のみでの分類となっている(図1)。RPAクラスⅢ,Ⅳ,Ⅴの各群における生存期間中央値は,それぞれ17.1カ月,11.2カ月,7.5カ月であり,各群間で生存期間は統計学的有意差がある8)。
|

|
| |
|
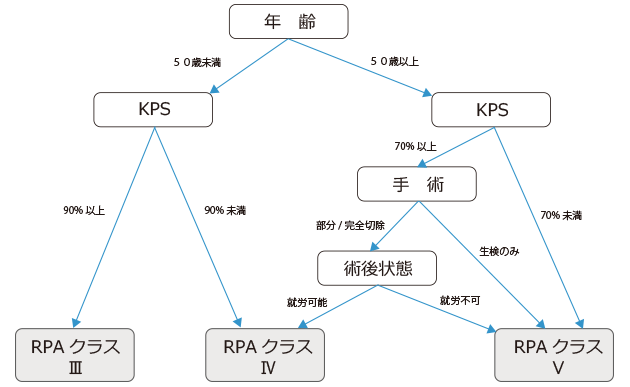
図1 膠芽腫に対するRecursive Partitioning Analysis(文献8より改変)
|

|
| |
|
近年は腫瘍の遺伝子解析による予後因子に関する報告も多く,その代表的なものとしてはDNA修復酵素であるO6-methylguanine-DNA methyltransferase(MGMT)をコードするMGMT遺伝子プロモーター領域メチル化と予後との相関が挙げられる。MGMTはDNAアルキル化薬(ニトロソウレア系薬剤,DNAメチル化薬)によるDNA修飾を修復する酵素であるが,その遺伝子のプロモーター領域にCpG-islandがあり,ここがメチル化されると蛋白発現が抑制される。Estellerらはカルムスチン(BCNU)の治療を受けた神経膠腫患者において腫瘍DNAを解析し,MGMT遺伝子プロモーター領域のメチル化が化学療法後の腫瘍の縮小と,全生存期間および無増悪生存期間の延長に相関していることを報告し,MGMT遺伝子プロモーター領域のメチル化が他の影響を受けない独立した予後因子であり,かつ年齢や全身状態(performance status:PS)よりも強い予後因子であることを報告した9)。現在,膠芽腫治療において広く使用されているTMZもアルキル化薬であることから,Hegiらは,Stuppらが行った臨床試験においてMGMT遺伝子プロモーター領域のメチル化を検索した。全登録症例573例中307例で検体が集められ,そのうち206例でメチル化の有無が検出された(全体の36%)。206例中45%の腫瘍においてMGMT遺伝子プロモーター領域のメチル化が確認された。メチル化症例のうちTMZ治療群の生存期間中央値は21.7カ月であり,放射線治療単独群の同中央値15.3カ月に比べて統計学的な有意差が証明された10)。一方,非メチル化症例群では,TMZの有無による全生存期間の差は小さく,有意差はなかった。
また,Riveraらは,後方視的なデータ解析ではあるが,初発膠芽腫225例のMGMT遺伝子プロモーター領域のメチル化を解析した。DNAアルキル化薬以外による治療を受けた症例,つまり,放射線単独治療においてもMGMT遺伝子プロモーター領域のメチル化の有無が生命予後と関係することを示した11)。その後も数多くの研究においてMGMT遺伝子プロモーター領域のメチル化の有無が予後と相関することは示されているが,その機構が本当にMGMT遺伝子発現の抑制を介するものなのかどうかなど,その詳細は今後の研究結果を待たなければならない。神経膠腫におけるMGMT遺伝子プロモーター領域のメチル化は,ニムスチン(ACNU)やTMZを含むアルキル化薬に対する腫瘍の治療効果の有用な予測因子のみならず,放射線治療も含めた予測因子もしくは予後因子の一つである可能性も議論となっている。ただしMGMT遺伝子プロモーター領域のメチル化を判定する方法はさまざまなものが提唱されており,標準化された手段はないことも記憶に留める必要がある。
成人膠芽腫22例について,2万個以上の遺伝子が網羅的に解析された結果,先に述べたIDH1遺伝子変異が膠芽腫の12%に認められることが発見された。詳細にみると,この遺伝子異常は続発性膠芽腫の大多数に認められるが,原発性膠芽腫にはこの変異はほとんど観察されないことが判明した。また,IDH1遺伝子変異のある膠芽腫は変異のない膠芽腫に比べて生存期間が有意に長く,IDH1遺伝子変異も有用な予後因子であることが判明している3,4)。
米国で行われたThe Cancer Genome Atlas(TCGA)projectの一つとしてPhillipsらは,260例の初発膠芽腫について遺伝子発現のプロファイリング解析を施行し,4つのパターンproneural,neuronal,classical,mesenchymalに分類できることを提唱している。このなかで,神経細胞の発生に関わる遺伝子の発現が亢進しているタイプ(proneural)が,より長い生存期間を示すことを報告した12)。
Noushmehrらは,やはりTCGA projectの一環として272例の膠芽腫について,全ゲノムのメチル化の状態を解析し,多数の遺伝子のプロモーター領域においてメチル化が認められる一群があることを示し,これをglioma-CpG island methylator phenotype(G-CIMP)と名付けた。G-CIMPは,遺伝子発現におけるproneuralタイプと臨床的な続発性膠芽腫にかなり重複することが見出されており,さらにIDH1遺伝子変異とも密接に相関していることが示唆されている13)。
|

|
| |
5 診療アルゴリズム
|

|
| |
|
|

|
| |
6 CQと推奨の一覧
|

|
| |
|
| Clinical Question |
推奨 |
推奨度
(投票結果) |
| 初発例への手術療法 |
| CQ1 |
成人初発膠芽腫に対する手術療法はどのような意義があるか? |
膠芽腫では,手術後の一般状態が良い場合において,手術による摘出度が高いほど,無増悪生存期間と全生存期間の改善がみられる。 |
C1(5/6) |
| 初発例への放射線治療 |
| CQ2 |
成人初発膠芽腫に対する放射線治療はどのような意義があるか? |
推奨1 70歳以下の成人初発膠芽腫に対し,放射線治療を行う。照射方法は総線量60 Gyを6週間かけて行う(1日1回2 Gy,5日間/1週間)。 |
1A(6/6) |
| 推奨2 成人初発膠芽腫に対する放射線治療として,追加および単独での定位放射線照射を行わない。 |
2C(6/6) |
| 初発例への化学療法 |
| CQ3 |
成人初発膠芽腫に対する化学療法の種類と意義はどのようなものがあるか? |
推奨1 18歳以上70歳以下の成人初発膠芽腫患者に対して,手術後,経口内服薬テモゾロミドを放射線治療期間中,ならびに放射線治療終了後に投与する(Stuppプロトコール)。 |
1A(6/6) |
| 推奨2 Stuppプロトコール治療を遂行中,放射線治療終了後に偽増悪(pseudoprogression)が示唆される場合はテモゾロミド維持化学療法を継続する。 |
2C(5/6) |
| 推奨3 初発または再発悪性神経膠腫に対するテモゾロミド治療において,適宜ニューモシスチス肺炎に対する予防処置を行う。 |
2C(5/6) |
| 推奨4 初発または再発悪性神経膠腫に対するテモゾロミド治療を行う場合,血清中のHBs抗原,HBc抗体,HBs抗体を測定し,肝臓専門医や内科医と相談して,その患者のB型肝炎状態に応じた対応を適切に行う。 |
1C(5/6) |
| 推奨5 初発成人膠芽腫に対して,ニムスチン単剤あるいはニムスチンを含む化学療法を用いる。 |
2C(6/6) |
| 推奨6 成人初発膠芽腫患者に対して,Stuppプロトコールへのインターフェロン-βの併用投与を行わない。 |
2B(5/6) |
| 推奨7 成人初発膠芽腫手術においてカルムスチン徐放性ポリマーを留置する。 |
2C(5/6) |
| 推奨8 成人初発膠芽腫患者に対して,Stuppプロトコールにベバシズマブの併用を考慮してもよい。 |
2B(5/6) |
| 光線力学的療法 |
| CQ4 |
悪性神経膠腫(初発・再発)を含めた悪性脳腫瘍に対して,開頭腫瘍摘出術の際のタラポルフィンナトリウムと半導体レーザを用いた光線力学的療法は有効か? |
悪性神経膠腫(初発・再発)を含めた悪性脳腫瘍に対して,開頭腫瘍摘出術の際のタラポルフィンナトリウムと半導体レーザを用いた光線力学的療法を考慮してもよい。 |
2C(5/6) |
| 交流電場腫瘍治療システム |
| CQ5 |
膠芽腫に対する,交流電場腫瘍治療システム(NovoTTF-100Aシステム)の使用は有効か? |
初発テント上膠芽腫に対して,手術と化学放射線療法の初期治療後,化学療法の維持療法時に交流電場腫瘍治療システム(NovoTTF-100Aシステム)の使用追加を考慮する。 |
1B(6/6) |
| 再発例への治療 |
| CQ6 |
成人再発膠芽腫に対する治療はどのように行うか? |
推奨1 症例によっては,再発膠芽腫に対して再手術を考慮してもよい。 |
2C(6/6) |
| 推奨2 成人再発膠芽腫に対して,全身・局所化学療法を考慮してもよい。 |
2C(6/6) |
| 推奨3 成人再発膠芽腫治療において局在した病変の制御を目的として,定位放射線照射を考慮してもよい。 |
2C(6/6) |
| 高齢者初発例への術後治療 |
| CQ7 |
高齢者初発膠芽腫に対して手術後どのような治療が推奨されるか? |
推奨1 高齢者においても,テモゾロミドを併用した化学放射線療法を考慮する。 |
1B(6/6) |
| 推奨2 高齢者における放射線治療では,線量の減量と照射期間の短縮を考慮する。 |
1B(6/6) |
| 推奨3 高齢者において,MGMT遺伝子プロモーター領域メチル化症例はテモゾロミド単独療法を考慮してもよい。 |
2C(4/6) |
| 推奨4 高齢者において,化学療法が困難な場合,放射線単独療法を考慮する。 |
2C(6/6) |
|
|
| |
|
(注:推奨度の投票は、膠芽腫ガイドライン委員で行った(賛成人数/全投票人数))
|

|

|
| |
7 ガイドライン統括委員会
|

|
| |
|
本ガイドラインの作成にあたり,特定非営利活動法人 日本脳腫瘍学会脳腫瘍診療ガイドライン拡大委員会はガイドライン統括委員会の役割を果たしている。日本脳腫瘍学会脳腫瘍診療ガイドライン拡大委員会の構成委員と所属は共通項目参照。
|

|
| |
8 成人膠芽腫ガイドライン改訂ワーキンググループ(改訂第3版時)
|

|
| |
|
| (五十音順)
|
| 氏 名 |
所属機関/専門分野 |
作成上の役割 |
| 青木 友和 |
京都医療センター 脳神経外科/脳神経外科 |
委員 |
| 荒川 芳輝 |
京都大学大学院医学研究科 脳神経外科/脳神経外科 |
委員 |
| 佐々木 光 |
慶應義塾大学医学部 脳神経外科/脳神経外科 |
委員 |
| 田宮 隆 |
香川大学医学部 脳神経外科/脳神経外科 |
委員 |
| 武笠 晃丈 |
熊本大学大学院生命科学研究部 脳神経外科学講座/脳神経外科 |
委員長 |
| 村垣 善浩 |
東京女子医科大学 先端生命医科学研究所/脳神経外科 |
委員 |
|
|

|
| |
9 文献検索
|

|
| |
|
2016年版での検索結果に加え,2017年時点までのMEDLINEにて,gliomaあるいはglioblastomaを含むキーワードにて文献検索を行った。これらの機械的文献検索以外に,委員によるハンドサーチでの重要文献の追加も適宜行った。そこから,各CQに対してエビデンスのある,または臨床上重要な情報を提供すると考えられた論文を抽出した。
|

|
| |
|
| 文献 |
| 1) |
The Committee of Brain Tumor Registry of Japan. Report of Brain Tumor Registry of Japan(2005-2008)14th Edition. Neurol Med Chir(Tokyo). 2017;57(Suppl 1):9-102.[PMID:28420810]
|
|
| 2) |
Kleihues P, Burger PC, Aldape KD, et al. Glioblastoma. In Louis DN, Ohgaki H, Wiestler OD, Cavenee WK(eds.):Pathology & Genetics of Tumours of the Central Nervous System. Lyon, IARC, 2007, pp33-49.
|
|
| 3) |
Parsons DW, Jones S, Zhang X, et al. An integrated genomic analysis of human glioblastoma multiforme. Science. 2008;321(5897):1807-12.[PMID:18772396]
|
|
| 4) |
Yan H, Parsons DW, Jin G, et al. IDH1 and IDH2 mutations in gliomas. N Engl J Med. 2009;360(8):765-73.[PMID:19228619]
|
|
| 5) |
Stewart LA. Chemotherapy in adult high grade glioma:a systematic review and meta-analysis of individual patient data from 12 randomised trials. Lancet. 2002;359(9311):1011-8.[PMID:11937180]
|
|
| 6) |
Stupp R, Mason WP, van den Bent MJ, et al. European Organisation for Research and Treatment of Cancer Brain Tumor and Radiotherapy Groups;National Cancer Institute of Canada Clinical Trials Group. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med. 2005;352(10):987-96.[PMID:15758009]
|
|
| 7) |
Curran WJ Jr, Scott CB, Horton J, et al. Recursive partitioning analysis of prognostic factors in three Radiation Therapy Oncology Group malignant glioma trials. J Natl Cancer Inst. 1993;85(9):704-10.[PMID:8478956]
|
|
| 8) |
Li J, Wang M, Won M, et al. Validation and simplification of the Radiation Therapy Oncology Group recursive partitioning analysis classification for glioblastoma. Int J Radiat Oncol Biol Phys. 2011;81(3):623-30.[PMID:20888136]
|
|
| 9) |
Esteller M, Garcia-Foncillas J, Andion E, et al. Inactivation of the DNA-repair gene MGMT and the clinical response of gliomas to alkylating agents. N Engl J Med. 2000;343(19):1350-4.[PMID:11070098]
|
|
| 10) |
Hegi ME, Diserens AC, Gorlia T, et al. MGMT gene silencing and benefit from temozolomide in glioblastoma. N Engl J Med. 2005;352(10):997-1003.[PMID:15758010]
|
|
| 11) |
Rivera AL, Pelloski CE, Gilbert MR, et al. MGMT promoter methylation is predictive of response to radiotherapy and prognostic in the absence of adjuvant alkylating chemotherapy for glioblastoma. Neuro Oncol. 2010;12(2):116-21.[PMID:20150378]
|
|
| 12) |
Phillips HS, Kharbanda S, Chen R, et al. Molecular subclasses of high-grade glioma predict prognosis, delineate a pattern of disease progression, and resemble stages in neurogenesis. Cancer Cell. 2006;9(3):157-73.[PMID:16530701]
|
|
| 13) |
Noushmehr H, Weisenberger DJ, Diefes K, et al. Cancer Genome Atlas Research Network. Identification of a CpG island methylator phenotype that defines a distinct subgroup of glioma. Cancer Cell. 2010;17(5):510-22.[PMID:20399149]
|
|

|
|
| |
略語一覧
|

|
| |
|
| ACNU |
nimustine |
ニムスチン |
| AraC |
cytarabine |
シタラビン |
| BCNU |
carmustine |
カルムスチン |
| BSC |
best supportive care |
|
| BWH |
Brigham and Women’s Hospital |
|
| CBCDA |
carboplatin |
カルボプラチン |
| CCNU |
lomustine |
|
| CCTG |
Canadian Cancer Trials Group |
|
| CI |
confidence interval |
信頼区間 |
| COWA |
controlled oral word association test |
|
| CR |
complete response |
完全奏効 |
| CTCAE |
Common Terminology Criteria for Adverse Events |
有害事象共通用語規準 |
| ECOG |
Eastern Cooperative Oncology Group |
|
| EORTC |
European Organization for Research and Treatment of Cancer |
|
| FDA |
Food and Drug Administration |
米国食品医薬品局 |
| G-CIMP |
glioma-CpG island methylator phenotype |
|
| HBV |
hepatitis B virus |
B型肝炎ウイルス |
| HIV |
human immunodeficiency virus |
|
| HR |
hazard ratio |
ハザード比 |
| HRQOL |
health-related quality of life |
健康関連QOL |
| HVLT-R |
Hopkins verbal learning test-revised |
|
| IDH1/2 |
isocitrate dehydrogenase 1/2 |
|
| IFM |
ifosfamide |
イホスファミド |
| IFN-β |
Interferon-β |
インターフェロン-β |
| JCOG |
Japan Clinical Oncology Group |
日本臨床腫瘍研究グループ |
| KPS |
Karnofsky Performance Status |
|
| m-CCNU |
semustine |
|
| MDASI-BT |
The MD Anderson Symptom Inventory for brain tumor |
MD Anderson症状評価表—脳腫瘍版 |
| MGMT |
O6-methylguanine-DNA methyltransferase |
|
| MRI |
magnetic resonance imaging |
|
| MSM |
motor-speech-middle cerebral artery |
|
| MST |
median survival time |
生存期間中央値 |
| NCCTG |
North Central Cancer Treatment Group |
|
| NCIC |
National Cancer Institute of Canada |
|
| NIH |
National Institutes of Health |
米国国立衛生研究所 |
| NOA |
Neuro-Oncology Working Group |
|
| OR |
odds ratio |
オッズ比 |
| PCZ |
procarbazine |
プロカルバジン |
| PD |
progressive disease |
進行 |
| PDT |
photodynamic therapy |
光線力学的療法 |
| PR |
partial response |
部分奏効 |
| PS |
performance status |
|
| QOL |
quality of life |
生活の質 |
| RPA |
Recursive partitioning analysis |
|
| RTOG |
Radiation Therapy Oncology Group |
|
| SD |
stable disease |
安定 |
| SRS |
stereotactic radiosurgery |
定位手術的照射 |
| STI |
stereotactic irradiation |
定位放射線照射 |
| TCGA |
The Cancer Genome Atlas |
|
| TMT |
trail making test |
|
| TMZ |
temozolomide |
テモゾロミド |
| TTF |
tumor treatment fields |
腫瘍治療電場 |
| VCR |
vincristine |
ビンクリスチン |
| VP-16 |
etoposide |
エトポシド |
| 5-ALA |
5-aminolevulinic acid |
5-アミノレブリン酸 |
|
|

|
| 初発例への手術療法
|

|
| |
|
CQ 1 成人初発膠芽腫に対する手術療法はどのような意義があるか?
|

|
| |
|
推奨
膠芽腫では,手術後の一般状態が良い場合において,手術による摘出度が高いほど,無増悪生存期間と全生存期間の改善がみられる。〔推奨度1C〕
|
|

|
| |
|
解説
|
| |
|
膠芽腫に対する手術摘出度あるいは残存腫瘍量と予後の関係に関しては,古くは術者の感覚によって手術摘出度が決定されていたこともあり,学問的信頼度は低いものであった。
手術摘出度あるいは残存腫瘍量と予後の関係を前方視的試験にて解析した研究は,フィンランドにおいて2003年に報告された30例の65歳以上の悪性神経膠腫症例を,生検と開頭摘出術の2群に振り分けたものしか存在しない1)(レベルⅡb)。生存期間中央値は生検群が85日(95%CI:55-157),開頭摘出群が171日(95%CI:146-278)で,有意差が確認された(HR=2.757,95%CI:1.004-7.568,p=0.049)が,無増悪生存期間の有意差は認められなかった(p=0.057)。このような手術摘出度をランダムに振り分ける前方視的試験は,倫理的問題から将来的にも行われる可能性はないと考えられている。したがって,膠芽腫に対する手術摘出度あるいは残存腫瘍量と予後の関係解析は,後方視的検討およびそのメタアナリシスか,さまざまな予後に関する要因をできるだけ均等にした非ランダム化前方視的試験のなかで検討するしかない。
2001年にLacroixら2)(レベルⅢ)が,416例の初発(233例)および再発膠芽腫を用いて,magnetic resonance imaging(MRI)を用いた術前後の腫瘍容量解析を行い,98%以上の腫瘍摘出が行われた場合に有意に予後改善が得られると報告した。この論文の与えたインパクトは大きく,MRI画像上の造影領域を全摘出することが膠芽腫を手術する脳神経外科医の目標となった。初発233例に限ると,98%以上摘出された107例の生存期間中央値は13カ月,それ未満の126例では8.8カ月であり,単変量および多変量解析でも危険率0.02をもって有意と検定されている。ただし,この報告は単一施設の後方視的検討結果であることに留意する必要がある。
Stummerらによる,5-アミノレブリン酸(5-ALA)蛍光診断を併用した膠芽腫摘出に関する前方視的臨床試験とその追跡報告3,4)(それぞれレベルⅡb,Ⅰb)は,当初の目的であった蛍光診断を用いることにより摘出度が上昇し,生命予後が改善するという結果は得られなかったものの,副次的に膠芽腫に対するMRI画像上の造影領域の全摘出の意義を明らかにした。243例の膠芽腫に対する摘出度と生命予後の検討から,全摘出した場合とそうでない場合の生存期間中央値はそれぞれ16.7カ月(95%CI:11.4-14.6)と11.8カ月(95%CI:10.4 -3.7)であり,全摘出により4.9カ月の生存期間延長が得られると報告された(HR=1.752,95%CI:1.258-2.438,p=0.0004)。しかし,年齢(p=0.0123),KPS(p=0.1714),重要な部位(p=0.0231),浸潤度(p=0.1375)と両群の背景に相違があり,結果の解釈には注意が必要である。
2011年にSanaiらによって,University of California, San Franciscoにおいて摘出術と標準的化学放射線療法が行われた連続500例の初発膠芽腫における,手術摘出度と予後との検討が報告された。手術摘出度が78%以上であれば生命予後は改善し,95~100%といった高い摘出度になっても摘出度に応じて段階的に予後は良好となるという結果であった5)(レベルⅢ)。単一施設での後方視的試験という問題は避けられないが,比較的均一な治療が行われ,慎重な統計解析により評価されたこの報告より,膠芽腫では手術摘出度が高いほど良好な治療予後が得られると考えられる。
以上より,膠芽腫に対しては可能であれば腫瘍容量をできる限り少なくすることを目的とした摘出術が推奨される。しかしながら,これは全症例に対して全摘出を目指すべきかどうかの方向性を決定するものではない。前述のLacroixらの検討では,MRI画像上の壊死の有無・年齢・KPSの各項目にポイントをつけて4群に分類し,MRI画像上で壊死がなく,より若年で,KPSの高い群において98%以上の摘出の意義が有意であったと報告されている2)(レベルⅢ)。さらに,脳のどの領域にどのような浸潤形式で腫瘍が存在するかによって手術適応は大きく異なり,この点に関する議論は未だ不十分であり,コンセンサスが得られていないことに注意すべきである。また,手術によって生じる神経脱落症状は決して無視できないことも常に留意しなくてはならない。目標とすべきことは,最小限の手術合併症と最大限の摘出度を達成することにある。
|

|
| |
|
| 文献 |
| 1) |
Vuorinen V, Hinkka S, Färkkilä M, et al. Debulking or biopsy of malignant glioma in elderly people - a randomised study. Acta Neurochir(Wien). 2003;145(1):5-10.[PMID:12545256](レベルⅡb)
|
|
| 2) |
Lacroix M, Abi-Said D, Fourney DR, et al. A multivariate analysis of 416 patients with glioblastoma multiforme:prognosis, extent of resection, and survival. J Neurosurg. 2001;95(2):190-8.[PMID:11780887](レベルⅢ)
|
|
| 3) |
Pichlmeier U, Bink A, Schackert G, et al. ALA Glioma Study Group. Resection and survival in glioblastoma multiforme:an RTOG recursive partitioning analysis of ALA study patients. Neuro Oncol. 2008;10(6):1025-34.[PMID:18667747](レベルⅡb)
|
|
| 4) |
Stummer W, Reulen HJ, Meinel T, et al. ALA-Glioma Study Group. Extent of resection and survival in glioblastoma multiforme:identification of and adjustment for bias. Neurosurgery. 2008;62(3):564-76.[PMID:18425006](レベルⅠb)
|
|
| 5) |
Sanai N, Polley MY, McDermott MW, et al. An extent of resection threshold for newly diagnosed glioblastomas. J Neurosurg. 2011;115(1):3-8.[PMID:21417701](レベルⅢ)
|
|

|
|

|

|
| 初発例への放射線治療
|

|
| |
|
CQ2 成人初発膠芽腫に対する放射線治療はどのような意義があるか?
|

|
| |
|
推奨1
70歳以下の成人初発膠芽腫に対し,放射線治療を行う。照射方法は総線量60 Gyを6週間かけて行う(1日1回2 Gy,5日間/1週間)。〔推奨度1A〕
|
|

|
| |
|
推奨2
成人初発膠芽腫に対する放射線治療として,追加および単独での定位放射線照射を行わない。〔推奨度2C〕
|
|

|
| |
|
解説
|
| |
|
Andersenは,1963~1967年に治療された膠芽腫108例に対して,術後放射線治療施行群(51例,平均照射量45 Gy)と未施行群(57例)の2群でランダム化比較試験を行った。その結果,放射線治療未施行群では1年生存割合が0%であったが,放射線治療施行群では19%であった(p<0.05)1)(レベルⅠb)。Walkerらは,悪性神経膠腫303例に対して,手術のみ(42例),カルムスチン(BCNU)化学療法のみ(68例),放射線治療のみ(93例),放射線治療とBCNU化学療法併用(100例)の4群のランダム化比較試験を施行した。照射に対するBCNUの上乗せ効果は統計学的には示されなかったものの,前述の順に生存割合が改善することを報告した(表1)2)(レベルⅠb)。
|

|
| |
|
表1 Walkerらの悪性神経膠腫303例に対する比較試験2)のp値

MST:median survival time(生存期間中央値),BSC:best supportive care,BCNU:カルムスチン
青字:有意差を認める
いずれもCoxのlog-lank modelによる
(文献2を改変)
|

|
| |
|
さらに,Walkerらは,退形成性星細胞腫または膠芽腫の計467例に対する術後補助療法として,放射線治療(全脳照射60 Gy)+BCNU群,放射線治療(全脳照射60 Gy)+semustine群,放射線治療(全脳照射60 Gy)単独群,semustine化学療法単独群の4群でのランダム化比較試験を行い,semustine化学療法単独群に対して他の放射線治療を含む3群が生存割合にて統計学的に有意差をもって上回っていることを報告した(表2)3)(レベルⅠb)。
|

|
| |
|
表2 Walkerらの悪性神経膠腫467例に対する比較試験3)のp値

median survival time(生存期間中央値),m-CCNU:semustine,BCNU:カルムスチン
青字:有意差を認める
いずれもCoxのlog-lank modelによる
(文献3を改変)
|

|
| |
|
さらに1981年には,スカンジナビアのグループから興味ある報告がなされている。118例のテント上星細胞腫(WHO分類gradeⅢ・Ⅳ)を第1群(放射線治療45 Gy+プラセボ,45例),第2群(放射線治療45 Gy+ブレオマイシン,45例),第3群(best supportive care:BSC,38例)の3群にランダム化し生存期間を比較した。ブレオマイシン投与が生存期間延長に寄与することはなかったが,第1,2群の放射線治療群(生存期間中央値10.8カ月)は第3群(生存期間中央値5.2カ月)に比較して有意に生存期間が延長した4)(レベルⅠb)。
これらの臨床研究は照射方法や統計学的デザインが古いものであるため,単純に現在の臨床の場にそのまま外挿できるものではないが,BSCに比較して放射線治療の有効性を示す証左と考えることができる。
上述のWalkerらの臨床研究やスカンジナビアでの臨床試験では全脳照射が採用されていたが,現在は全脳照射ではなく局所照射が一般的に行われている。局所照射と全脳照射の比較試験は存在しないため,局所照射が優れているとの明確なエビデンスはないが,以下の研究報告から局所照射が標準治療であると総合的に勘案されている。
Hochbergらは,膠芽腫での再発は原発巣から2 cm以内の局所再発が90%を占めると報告しており5)(レベルⅢ),他にも膠芽腫の再発は多くが局所再発であるとするいくつか同様の研究報告がある6-8)(いずれもレベルⅢ)。これらの研究報告は,全脳照射が必須ではないことを示唆すると考えられる。また,1973年には,60例の膠芽腫治療解析から,43.98~52.72 Gyの幅の照射線量において局所照射された症例の生命予後が良い可能性を示唆する後方視的研究報告9)(レベルⅢ)や,571例の悪性神経膠腫に対する臨床試験Brain Tumor Cooperative Group Trial 8001の副次的解析において,60.2 Gy(35回/7週間)の全脳照射群(406例)と,全脳照射43 Gy(25回/5週間)に17.2 Gy(10回/2週間)の局所照射を併用する群(155例)では両群間の生存割合に有意差を認めなかった(p=0.30)10)(レベルⅠb)とする報告から,全脳照射は回避される傾向にある。
照射線量に関して東京大学のグループは,初発悪性神経膠腫(gradeⅢ・Ⅳ)に対して高線量(80~90 Gy)放射線治療の観察研究の結果から,生命予後延長の可能性を示唆しているが,高線量群では通常照射群に比べて白質障害が高頻度に観察されたとも報告している11)(レベルⅢ)。一方で,1983年にChangらは,悪性神経膠腫626例を登録した第Ⅲ相ランダム化比較試験〔RTOGならびにEastern Cooperative Oncology Group(ECOG)〕において,60 Gy/6~7週から70 Gy/8~9週への総線量増加に伴い,性格変化(24% vs.31%),言語障害(10% vs.17%),高次脳機能障害(25% vs.48%)の発症頻度が上昇し,QOLが低下する傾向を示し,かつ生存割合においては,有意な改善はみられなかった12)(レベルⅠb)。2005年にStuppらの報告12,13)(いずれもレベルⅠb)において,第Ⅲ相試験としては初めて局所照射単独治療(60 Gy/6週間)が成人膠芽腫に対する標準治療群(control arm)に採用され,さらに,この標準治療群に対してテモゾロミドの上乗せ効果が示された(本章CQ3,A. テモゾロミドの項参照)。よって,現在のところ高齢者と小児を除く初発膠芽腫は,1日1回照射,1日線量2 Gy,6週間で総線量60 Gyの局所照射が世界的に行われている13)(レベルⅠb)。
膠芽腫に関する定位放射線照射(stereotactic irradiation:STI)に関してRTOGは,長径40 mm以下のテント上初発膠芽腫203例に対する定位手術的照射(stereotactic radiosurgery:SRS)の追加の有用性を検証する多施設共同ランダム化比較試験を行っている。BCNU(80 mg/m2,3日間,8週間ごと,6サイクル)に通常放射線治療(60 Gy)を施行する群と,同様の治療に加えてSRS(15~21 Gy)を追加する2群を比較検討した。生存期間中央値はそれぞれ13.6カ月(95%CI:11.0-14.8)と13.5カ月(95%CI:11.2-15.2)であり,両群間に統計学的な有意差はなく,通常放射線治療にSRSの上乗せ効果は証明できなかった(p=0.5711)。以上の結果より,初発膠芽腫の治療においては,通常放射線治療にSRSを追加することの有効性がないことが示された14)(レベルⅠb)。
現状では,成人初発膠芽腫に対する放射線治療として,追加および単独でのSTIを推奨する積極的なエビデンスは乏しい。
[注意]
カルムスチン(BCNU):注射薬は国内未承認,脳内留置用剤(徐放性ポリマー)は悪性神経膠腫に対して承認
semustine:国内未承認済み
|

|
| |
|
| 文献 |
| 1) |
Andersen AP. Postoperative irradiation of glioblastomas. Results in a randomized series. Acta Radiol Oncol Radiat Phys Biol. 1978;17(6):475-84.[PMID:216238](レベルⅠb)
|
|
| 2) |
Walker MD, Alexander E Jr, Hunt WE, et al. Evaluation of BCNU and/or radiotherapy in the treatment of anaplastic gliomas. A cooperative clinical trial. J Neurosurg. 1978;49(3):333-43.[PMID:355604](レベルⅠb)
|
|
| 3) |
Walker MD, Green SB, Byar DP, et al. Randomized comparisons of radiotherapy and nitrosoureas for the treatment of malignant glioma after surgery. N Engl J Med. 1980;303(23):1323-9.[PMID:7001230](レベルⅠb)
|
|
| 4) |
Kristiansen K, Hagen S, Kollevold T, et al. Combined modality therapy of operated astrocytomas grade III and IV. Confirmation of the value of postoperative irradiation and lack of potentiation of bleomycin on survival time:a prospective multicenter trial of the Scandinavian Glioblastoma Study Group. Cancer. 1981;47(4):649-52.[PMID:6164465](レベルⅠb)
|
|
| 5) |
Hochberg FH, Pruitt A. Assumptions in the radiotherapy of glioblastoma. Neurology. 1980;30(9):907-11.[PMID:6252514](レベルⅢ)
|
|
| 6) |
Garden AS, Maor MH, Yung WK, et al. Outcome and patterns of failure following limited-volume irradiation for malignant astrocytomas. Radiother Oncol. 1991;20(2):99-110.[PMID:1851573](レベルⅢ)
|
|
| 7) |
Liang BC, Thornton AF Jr, Sandler HM, et al. Malignant astrocytomas:focal tumor recurrence after focal external beam radiation therapy. J Neurosurg. 1991;75(4):559-63.[PMID:1653309](レベルⅢ)
|
|
| 8) |
Levin VA, Maor MH, Thall PF, et al. Phase II study of accelerated fractionation radiation therapy with carboplatin followed by vincristine chemotherapy for the treatment of glioblastoma multiforme. Int J Radiat Oncol Biol Phys. 1995;33(2):357-64.[PMID:7673023](レベルⅢ)
|
|
| 9) |
Ramsey RG, Brand WN. Radiotherapy of glioblastoma multiforme. J Neurosurg. 1973;39(2):197-202.[PMID:4352589](レベルⅢ)
|
|
| 10) |
Shapiro WR, Green SB, Burger PC, et al. Randomized trial of three chemotherapy regimens and two radiotherapy regimens and two radiotherapy regimens in postoperative treatment of malignant glioma. Brain Tumor Cooperative Group Trial 8001. J Neurosurg. 1989;71(1):1-9.[PMID:2661738](レベルⅠb)
|
|
| 11) |
Tanaka M, Ino Y, Nakagawa K, et al. High-dose conformal radiotherapy for supratentorial malignant glioma:a historical comparison. Lancet Oncol. 2005;6(12):953-60.[PMID:16321763](レベルⅢ)
|
|
| 12) |
Chang CH, Horton J, Schoenfeld D, et al. Comparison of postoperative radiotherapy and combined postoperative radiotherapy and chemotherapy in the multidisciplinary management of malignant gliomas. A joint Radiation Therapy Oncology Group and Eastern Cooperative Oncology Group study. Cancer. 1983;52(6):997-1007.[PMID:6349785](レベルⅠb)
|
|
| 13) |
Stupp R, Mason WP, van den Bent MJ, et al. European Organisation for Research and Treatment of Cancer Brain Tumor and Radiotherapy Groups;National Cancer Institute of Canada Clinical Trials Group. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med. 2005;352(10):987-96.[PMID:15758009](レベルⅠb)
|
|
| 14) |
Souhami L, Seiferheld W, Brachman D, et al. Randomized comparison of stereotactic radiosurgery followed by conventional radiotherapy with carmustine to conventional radiotherapy with carmustine for patients with glioblastoma multiforme:report of Radiation Therapy Oncology Group 93-05 protocol. Int J Radiat Oncol Biol Phys. 2004;60(3):853-60.[PMID:15465203](レベルⅠb)
|
|

|

|

|
| 初発例への化学療法
|

|
| |
|
CQ3 成人初発膠芽腫に対する化学療法の種類と意義はどのようなものがあるか?
|

|
| |
|
A テモゾロミド
|

|
| |
|
推奨1
18歳以上70歳以下の成人初発膠芽腫患者に対して,手術後,経口内服薬テモゾロミドを放射線治療期間中,ならびに放射線治療終了後に投与する(Stuppプロトコール)。〔推奨度1A〕
|
|

|
| |
|
解説
|
| |
|
テモゾロミド(TMZ)は経口薬として腸管吸収性に優れた第2世代のアルキル化薬で,さらに血液脳関門を通過しやすいという利点を持つ。2005年に発表された成人初発膠芽腫に対するランダム化比較試験の結果により,その有効性が証明され,膠芽腫に対する標準治療薬と位置づけられた1)(レベルⅠb)。
上記試験はEuropean Organization for Research and Treatment of Cancer(EORTC)とNational Cancer Institute of Canada(NCIC)両グループを中心とした多施設共同試験であり,18歳以上70歳以下の成人初発膠芽腫573例に対して手術後,放射線単独治療(60 Gy)を標準治療(control arm)とし,放射線治療(60 Gy)+TMZ併用化学療法とそれに続くTMZ補助化学療法を試験治療とするランダム化比較試験である。
|
| |
|
| |
TMZの具体的な投与方法は,
|
| |
① |
放射線治療期間中,TMZ 75 mg/m2を放射線治療終了日まで49日間を上限として連日内服(併用化学療法)。
|
| |
② |
放射線治療終了日から4週間の休薬期間を設け,以下の維持化学療法を開始する。
|
|
③ |
TMZ 150~200 mg/m2を5日間内服・23日間休薬(5-day on/23-day off)とし,28日を1サイクルとした維持化学療法を6サイクル行う。
|
|
| |
|
維持化学療法中のTMZ投与量は,1サイクル時は150 mg/m2/日とし,1サイクル中に血液毒性を認めなかった場合,2サイクル以降は200 mg/m2/日に増量を行うこととした(Stuppプロトコール)。この結果,放射線単独治療群(286例)とStuppプロトコール群(287例)の生存期間中央値はそれぞれ,12.1カ月(95%CI:11.3-13.0)と14.6カ月(95%CI:13.2-16.8)であり,有意差をもってStuppプロトコール群の全生存期間延長を認めた(HR=0.63,95%CI:0.52-0.75,p<0.001)。血液毒性は標準治療群と比べると,試験治療群においてGrade3以上の血液毒性の頻度が数%増える程度であった。非血液毒性のなかでは倦怠感が最も多く観察されたが,その出現頻度は標準治療群26%,試験治療群33%と両群で有意差はなかった。その他の非血液毒性においても大きな差を認めなかった。有害事象については両群で特記すべき差異はなく,Stuppプロトコールは安全性の高い治療方法であると考えられた。
この臨床試験に関しては,2009年に長期経過観察の結果が報告された2)(レベルⅠb)。放射線単独治療群とStuppプロトコール群の生存割合はそれぞれ,2年:10.9% vs. 27.2%,3年:4.4% vs. 16.0%,4年:3.0% vs. 12.1%,5年:1.9% vs. 9.8%であり,Stuppプロトコール群で有意差をもって生存割合が高値であった(HR=0.6,95%CI:0.5-0.7,p<0.0001)。5年という長期生存割合においても,初発膠芽腫に対してStuppプロトコール群が放射線単独治療群に比較して有効であることが示された。
その後,日本人においても,TMZの薬物動態や副作用,治療有効性に人種差がないことが証明されている3,4)(いずれもレベルⅡa)。
2005年に発表されたStuppプロトコールでは,TMZ補助化学療法は最高6サイクルまでの施行が計画された1)(レベルⅠb)。その後の膠芽腫に対する前方視的な臨床研究では,補助化学療法を何サイクル行うべきか,サイクル数を規定するような試みはなされておらず,補助化学療法施行サイクル数の標準化に関する論理的根拠は得られていない。以下に,補助化学療法施行サイクル数に参考となる臨床研究を掲げる5,6)(いずれもレベルⅢ)。
1997~2003年においてドイツの50施設で,悪性神経膠腫(grade Ⅲ・Ⅳ)患者を12サイクル以上のTMZ(5-day on/23-day off)での治療(施行サイクル数中間値:13サイクル)を行った結果を解析した。その結果,無増悪生存期間中央値は15.5カ月であり,Grade3以上の有害事象は約10%であった5)。Stuppプロトコールにおいて,補助化学療法を13サイクル前後まで延長することは毒性の観点から容認できる治療法であることが示唆された。
Urgoitiらは,後方視的研究において52例の初発膠芽腫を,TMZ(5-day on/23-day off)による補助化学療法を6サイクルで中止した23例と7サイクル以上続けた29例を比較した。両群間で年齢,KPSや手術摘出度,MGMT遺伝子プロモーター領域のメチル化などの予後因子は大きな偏りは認められなかったが,生存期間中央値はそれぞれ16.5カ月と24.6カ月(p=0.031)であり,6サイクル以上行った群において生命予後が延長することを報告した6)(レベルⅢ)。
TMZの薬理作用はDNAにメチル基を付加することに基づくが,その抗腫瘍活性はDNAのグアニン塩基のO6位をメチル化することによるものが最も大きい。MGMTはメチル化グアニン塩基からメチル基を除去しDNAのメチル化を修復し,自身はメチル化され不活性体となる。不活性体であるメチル化MGMTは細胞内で分解される。この修復過程は不可逆的であるため,メチル化DNAの部分が多ければ,MGMTにより修復反応を促進させれば,理論上,MGMT活性を著明に低下させることが可能になる7)(レベルⅡb)。すなわち,TMZを早急に腫瘍細胞に曝露させ,DNAのメチル化を促進し,MGMTによるDNA修復過程を活性化させ,MGMTを枯渇化することにより,TMZ耐性を克服できる可能性が提示されてきた8,9)(いずれもレベルⅡa)。
TMZの曝露期間を増加させる治療法の代表はTMZ用量強化療法であるが10,11)(いずれもレベルⅡa),初発膠芽腫におけるStuppプロトコールの維持化学療法部分のTMZを増量する治療法は以下の臨床試験の結果,その効果を否定された。
RTOG,EORTCとNorth Central Cancer Treatment Group(NCCTG)によって初発膠芽腫を対象に行われた第Ⅲ相試験(RTOG 0525試験)は,Stuppプロトコールを標準治療として,Stuppプロトコール維持化学療法部分を3-week on/1-week off(75-100 mg/m2/日)とする試験治療を採用した。1,173例の登録があり,833例がランダム化割り付けされた。その結果,全生存期間中央値(標準治療16.6カ月,試験治療14.9カ月,p=0.63,HR=1.03,95%CI:0.88-1.20)と無増悪生存期間中央値(それぞれ5.5カ月,6.7カ月,p=0.06,HR=0.87,95%CI:0.75-1.00)ともに2群間で有意差を示すことができなかった。MGMT遺伝子プロモーター領域のメチル化群は非メチル化群に比べ有意差をもって全生存期間(それぞれ21.2カ月,14.0カ月,p<0.01,HR=0.58,95%CI:0.48-0.69),無増悪生存期間(それぞれ8.7カ月,5.7カ月,p<0.01,HR=0.61,95%CI:0.52-0.73)の延長が示され,治療反応性(p=0.021)も良好であった。放射線併用期の代表的な有害事象はリンパ球減少症(全症例の12%),好中球減少症(全症例の3.6%),血小板減少症(全症例の6.8%)であり,好中球減少症での治療関連死1例が発生したが,日和見感染症は観察されなかった。維持化学療法期では試験治療群にGrade3以上の有害事象が有意差をもって高率に認められ(それぞれ34%,53%,p<0.001),多くはリンパ球減少症と疲労であった12)(レベルⅠb)。
[注意]
テモゾロミド(TMZ)3-week on/1-week off:添付文書に記載されていない投与方法で,国内では承認されていない(適応外使用)
|

|
| |
|
| 文献 |
| 1) |
Stupp R, Mason WP, van den Bent MJ, et al. European Organisation for Research and Treatment of Cancer Brain Tumor and Radiotherapy Groups;National Cancer Institute of Canada Clinical Trials Group. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med. 2005;352(10):987-96.[PMID:15758009](レベルⅠb)
|
|
| 2) |
Stupp R, Hegi ME, Mason WP, et al. European Organisation for Research and Treatment of Cancer Brain Tumour and Radiation Oncology Groups;National Cancer Institute of Canada Clinical Trials Group. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study:5-year analysis of the EORTC-NCIC trial. Lancet Oncol. 2009;10(5):459-66.[PMID:19269895](レベルⅠb)
|
|
| 3) |
Aoki T, Nishikawa R, Mizutani T, et al. Pharmacokinetic study of temozolomide on a daily-for-5-days schedule in Japanese patients with relapsed malignant gliomas:first study in Asians. Int J Clin Oncol. 2007;12(5):341-9.[PMID:17929115](レベルⅡa)
|
|
| 4) |
西川 亮,渋井壮一郎,丸野元彦,他.初回再発の退形成性星細胞腫患者に対するTemozolomide単剤投与の有効性および安全性の検討 多施設共同第Ⅱ相試験.癌と化療.2006;33(9):1279-85.(レベルⅡa)
|
|
| 5) |
Hau P, Koch D, Hundsberger T, et al. Safety and feasibility of long-term temozolomide treatment in patients with high-grade glioma. Neurology. 2007;68(9):688-90.[PMID:17325277](レベルⅢ)
|
|
| 6) |
Roldán Urgoiti GB, Singh AD, Easaw JC. Extended adjuvant temozolomide for treatment of newly diagnosed glioblastoma multiforme. J Neurooncol. 2012;108(1):173-7.[PMID:22382781](レベルⅢ)
|
|
| 7) |
Tolcher AW, Gerson SL, Denis L, et al. Marked inactivation of O6-alkylguanine-DNA alkyltransferase activity with protracted temozolomide schedules. Br J Cancer. 2003;88(7):1004-11.[PMID:12671695](レベルⅡb)
|
|
| 8) |
Esteller M, Garcia-Foncillas J, Andion E, et al. Inactivation of the DNA-repair gene MGMT and the clinical response of gliomas to alkylating agents. N Engl J Med. 2000;343(19):1350-4.[PMID:11070098](レベルⅡa)
|
|
| 9) |
Hegi ME, Diserens AC, Gorlia T, et al. MGMT gene silencing and benefit from temozolomide in glioblastoma. N Engl J Med. 2005;352(10):997-1003.[PMID:15758010](レベルⅡa)
|
|
| 10) |
Brandes AA, Tosoni A, Cavallo G, et al. Temozolomide 3 weeks on and 1 week off as first-line therapy for recurrent glioblastoma:phase II study from gruppo italiano cooperativo di neuro-oncologia(GICNO). Br J Cancer. 2006;95(9):1155-60.[PMID:17024124](レベルⅡa)
|
|
| 11) |
Wick A, Felsberg J, Steinbach JP, et al. Efficacy and tolerability of temozolomide in an alternating weekly regimen in patients with recurrent glioma. J Clin Oncol. 2007;25(22):3357-61.[PMID:17664483](レベルⅡa)
|
|
| 12) |
Gilbert MR, Wang M, Aldape KD, et al. Dose-dense temozolomide for newly diagnosed glioblastoma:a randomized phase III clinical trial. J Clin Oncol. 2013;31(32):4085-91.[PMID:24101040](レベルⅠb)
|
|

|
| |
|
推奨2
Stuppプロトコール治療を遂行中,放射線治療終了後に偽増悪(pseudoprogression)が示唆される場合はテモゾロミド維持化学療法を継続する。〔推奨度2C〕
|
|

|
| |
|
解説
|
| |
|
Chamberlainらは,成人初発膠芽腫に対してStuppプロトコールを施行した51例中26例(51%)で6カ月以内に臨床症状および画像上の増悪を認め,そのうち15例(29%)に腫瘍の再摘出術が行われ,7例の病理所見において壊死像が大部分であったと報告した。この事実より,初期治療早期での画像上の造影病変の増大のみで病勢進行と判断し治療法を変更してしまうと,Stuppプロトコールの治療効果を正確に判定できなくなる可能性を指摘している1)(レベルⅢ)。本論文以降,治療早期に造影病変の増大にもかかわらず,臨床症状の悪化に乏しく,摘出組織での組織所見が壊死像主体である病態を偽増悪(pseudoprogression)と呼称することが定着した。
一方,Brandesらは,成人初発膠芽腫に対してStuppプロトコールを行った症例で,MRI所見の経過から判断したpseudoprogressionの有無と,初回摘出組織のMGMT遺伝子プロモーター領域のメチル化状態との関係について前方視的に検討した。Pseudoprogressionの出現と無増悪生存期間・全生存期間の相関についても解析している。103例中,MGMT遺伝子プロモーター領域のメチル化を認めたのは36例,非メチル化症例は67例であった。維持化学療法直前に,MRI上造影病変の増大が観察されたのは103例中50例であり,この50例におけるテモゾロミド(TMZ)維持化学療法2サイクル後のMRI所見は,pseudoprogression(病変縮小または不変)状態32例,true progression(症状増悪の認められた評価病変増大)状態18例であった。この50例のなかでMGMT遺伝子プロモーター領域のメチル化23例のうちpseudoprogressionが観察されたものは21例(91%),非メチル化27例のうちpseudoprogressionが観察されたものは11例(41%)であった。以上の結果より,腫瘍のMGMT遺伝子プロモーター領域のメチル化とpseudoprogressionの発現に有意な相関が示された(p=0.0002)。また,MGMT遺伝子プロモーター領域のメチル化とpseudoprogressionの出現は,それぞれ生存期間延長と有意に相関していることが判明した(それぞれp=0.001,p=0.045)2)(レベルⅡb)。
Pseudoprogressionの場合は化学放射線治療後3カ月以降に腫瘍縮小が観察される傾向が強くなり,真の増悪との鑑別が可能になってくる。逆に3カ月以内では真の増悪例との鑑別が特に問題となってくる3)(レベルⅣ)。造影部分の増大にもかかわらず神経症状の悪化のない場合は,pseudoprogressionの可能性も考え,さらに数サイクルのTMZの維持化学療法を追加するのが望ましい。両者の鑑別が困難な場合は,積極的に手術を行い,組織診断を行うことも重要である。今後,さらなる経験の蓄積により,pseudoprogressionのより正確な頻度や病態への理解を深めていかなければならない。
|

|
| |
|
| 文献 |
| 1) |
Chamberlain MC, Glantz MJ, Chalmers L, et al. Early necrosis following concurrent Temodar and radiotherapy in patients with glioblastoma. J Neurooncol. 2007;82(1):81-3.[PMID:16944309](レベルⅢ)
|
|
| 2) |
Brandes AA, Franceschi E, Tosoni A, et al. MGMT promoter methylation status can predict the incidence and outcome of pseudoprogression after concomitant radiochemotherapy in newly diagnosed glioblastoma patients. J Clin Oncol. 2008;26(13):2192-7.[PMID:18445844](レベルⅡb)
|
|
| 3) |
Brandsma D, Stalpers L, Taal W, et al. Clinical features, mechanisms, and management of pseudoprogression in malignant gliomas. Lancet Oncol. 2008;9(5):453-61.[PMID:18452856](レベルⅣ)
|
|

|
| |
|
推奨3
初発または再発悪性神経膠腫に対するテモゾロミド治療において,適宜ニューモシスチス肺炎に対する予防処置を行う。〔推奨度2C〕
|
|

|
| |
|
解説
|
| |
|
初発膠芽腫を対象としたテモゾロミド(TMZ)治療の第Ⅱ相試験の中間解析において,15例中2例にニューモシスチス(pneumocystis jironecii)肺炎が報告され,その予防処置を講じる必要が緊急に発生した1)(レベルⅢ)。この際に参考とされたのはhuman immunodeficiency virus(HIV)感染者に対するニューモシスチス肺炎予防策であり2)(レベルⅢ),具体的にはスルファメトキサゾール・トリメトプリム合剤(ST合剤:国内承認薬の倍量力価を含有)の内服,またはペンタミジンの噴霧吸入であった3)(レベルⅡa)。この企業主導治験においては,放射線治療時とそれに続く休薬期間4週間の計10週間に,このいずれかの処置が義務づけられ,以降,第Ⅱ相試験1)(レベルⅢ),続く第Ⅲ相試験4)(レベルⅠb)において,いずれもTMZ併用群にニューモシスチス肺炎は観察されなかった。
ニューモシスチス肺炎の罹患はTMZ使用時のリンパ球減少症やCD4陽性細胞の減少と関連している可能性が示唆されており,TMZ使用にあたっては適宜その予防策を講じる必要がある5)(レベルⅤ)。
上記報告に従って,我が国でのニューモシスチス肺炎の予防対策として,
①ST合剤1錠を隔日あるいは連日内服(4週間継続を1サイクルとする)
②ペンタミジン300 mgを1回噴霧吸引(4週間を1サイクルとする)
が推奨される。
ST合剤は安価で,ニューモシスチス肺炎予防の第一選択であるが,皮膚瘙痒感,皮疹などの発現頻度が高く,これら症状発現時には速やかに②に変更する。アトバコンは,2012年4月にニューモシスチス肺炎の予防措置として我が国で保険承認されたが,TMZ使用時のニューモシスチス肺炎予防の第一選択薬ではなく,HIV感染者やニューモシスチス肺炎のリスクを有する患者(目安としてCD4陽性細胞数が200/mm3未満,ニューモシスチス肺炎の既往歴がある等)における予防薬という位置づけで使用されている。
その他に,TMZ使用時に発生し得る感染症として,サイトメガロウイルス(cytemegalovirus)感染症が挙げられる。特にサイトメガロウイルス肺炎は,ST合剤等によるニューモシスチス肺炎予防措置を行っている患者で間質性肺炎様所見が観察された場合には第一に疑う必要がある。ニューモシスチス肺炎患者では血清β-Dグルカンが高値であるが,サイトメガロウイルス肺炎・感染症では,血清β-Dグルカン正常,pp65抗原(C7-HRP)の高値が診断の補助となる。サイトメガロウイルス感染症にはガンシクロビルの投与が有効である5)(レベルⅤ)。
[注意}
ペンタミジン:ニューモシスチス肺炎の予防目的で使用する場合は適応外使用
アトバコン:ニューモシスチス肺炎の予防目的で使用する場合は,ニューモシスチス肺炎のリスク(CD4陽性細胞数が目安として200/mm3未満,ニューモシスチス肺炎の既往歴がある等)を有する患者を対象とする。
|

|
| |
|
| 文献 |
| 1) |
Stupp R, Dietrich PY, Ostermann Kraljevic S, et al. Promising survival for patients with newly diagnosed glioblastoma multiforme treated with concomitant radiation plus temozolomide followed by adjuvant temozolomide. J Clin Oncol. 2002;20(5):1375-82.[PMID:11870182](レベルⅢ)
|
|
| 2) |
Kovacs JA, Masur H. Prophylaxis against opportunistic infections in patients with human immunodeficiency virus infection. N Engl J Med. 2000;342(19):1416-29.[PMID:10805828](レベルⅢ)
|
|
| 3) |
西川 亮,渋井壮一郎,丸野元彦,他.初回再発の退形成性星細胞腫患者に対するTemozolomide単剤投与の有効性および安全性の検討 多施設共同第Ⅱ相試験.癌と化療.2006;33(9):1279-85.(レルⅡa)
|
|
| 4) |
Stupp R, Mason WP, van den Bent MJ, et al. European Organisation for Research and Treatment of Cancer Brain Tumor and Radiotherapy Groups;National Cancer Institute of Canada Clinical Trials Group. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med. 2005;352(10):987-96.[PMID:15758009](レベルⅠb)
|
|
| 5) |
大野 誠,沖田典子,成田善孝.テモゾロミドと日和見感染―ニューモシスチス肺炎とサイトメガロウイルス・B型肝炎ウイルスの活性化について―.脳外速報.2013;23(3):316-23.(レベルⅤ)
|
|

|

|
| |
|
推奨4
初発または再発悪性神経膠腫に対するテモゾロミド治療を行う場合,血清中のHBs抗原,HBc抗体,HBs抗体を測定し,肝臓専門医や内科医と相談して,その患者のB型肝炎状態に応じた対応を適切に行う。〔推奨度1C〕
|
|

|
| |
|
解説
|
| |
|
以前よりHBs抗原陽性のB型肝炎ウイルス(hepatitis B virus:HBV)キャリアに合併した造血器腫瘍や固形がんの患者において,がん薬物療法によるHBVの急激な増殖,すなわちHBVの再活性化により致死的な重症肝炎が発症することが知られていた。このようなHBV再活性化は,がん薬物療法を受けるHBVキャリアの24~53%に発症すると報告されており,劇症化する割合が高く,抗ウイルス薬を投与しても予後不良である1)(レベルⅤ)。したがって,がん薬物療法を受けるHBVキャリアでは,肝炎が発症する前から抗ウイルス薬の投与を開始することが重要である1)(レベルⅤ)。一方,HBs抗原陰性,HBc抗体ないしHBs抗体陽性のHBV既往感染例では,従来は臨床的には疾病の治癒状態と考えられてきたが,肝臓や末梢血単核球内では低レベルながらHBV-DNAの複製が長時間持続し,リツキシマブなどの免疫抑制作用のある薬剤の投与により,HBVの再活性化と重症肝炎が発生することも明らかになっている1)(レベルⅤ)。このような既往感染例からのHBV再活性化をde novo B型肝炎と呼び,その頻度は移植後やリツキシマブを含む併用化学療法などを受けた高リスク群で10~20%,通常の全身化学療法では1.0~2.7%と報告されている1)(レベルⅤ)。
HBV再活性化には不明な点も多いものの,がん化学療法薬や免疫抑制薬の投与により,HBVが免疫系のサーベイランスから逃れ肝細胞内で増殖し,主には治療終了後に生じる傷害性T細胞(cytotoxic T cell)のrebound immune responseにより,広範な感染肝細胞の破壊を伴う重症肝炎が惹起されるものと考えられている。またHBV遺伝子にはglucocorticoid enhancement elementが存在し,ステロイドにより直接的にウイルス複製が助長されることも要因の一つとされている1)(レベルⅤ)。
初発膠芽腫においてStuppプロトコールの化学放射線療法後早期に,HBVの再活性化をきたし,重症肝炎を呈した症例が4例報告されている2-5)(いずれもレベルⅣ)。4例中3例で初期治療前のHBs抗原が陽性,1例は不明であり,ステロイド使用・不使用,使用状況の詳細も記載されていない。そのためテモゾロミド(TMZ)によるリンパ球減少,特にCD4陽性細胞の細胞数低下・機能低下が直接HBV再活性化に関連しているとは断定できないが,4例中1例は重症肝炎により死亡していることや,HBV再活性化による重症肝炎は致死率が高いことは周知の事実であるため,TMZ使用に際してはHBV再活性化について十分な注意喚起が必要である。
我が国におけるHBV感染者は総人口の0.8%,約100万人程度存在すると推定されており,厚生労働省「肝硬変を含めたウイルス性肝疾患の治療の標準化に関する研究」班および「難治性の肝・胆道疾患に関する調査研究」班の合同ワーキンググループは,「免疫抑制・化学療法により発症するB型肝炎対策ガイドライン」を策定している1)(レベルⅤ)。それによれば,免疫抑制・化学療法を受ける全患者に対してHBs抗原,HBc抗体,HBs抗体のスクリーニング検査を行い,HBs抗原陽性例すなわちHBVキャリアでは肝臓専門医と十分な連携を取りながら抗ウイルス薬の投与を行うよう推奨されている。一方,HBs抗原陰性,HBc抗体ないしHBs抗体陽性のHBV既往感染例については,HBV-DNA定量の定期的なモニタリングを行うこととしている。すなわち,de novo B型肝炎ではその発症に先立ってHBV-DNA量が上昇するため,HBV-DNA量が検出感度以上になった時点で直ちに抗ウイルス薬投与を開始するとされている。また,de novo B型肝炎の多くががん薬物療法の終了後に発症しているため,HBV-DNAのモニタリングは治療期間中および終了後も少なくとも12カ月まで継続するべきとしている。これらの記載は臨床試験による知見の裏打ちには乏しいが,HBV再活性化による重症肝炎は致死率が高いことからも,上記「免疫抑制・化学療法により発症するB型肝炎対策ガイドライン」に沿った対応が望ましい1)。
|

|
| |
|
| 文献 |
| 1) |
坪内博仁,熊田博光,清澤研道,他.免疫抑制・化学療法により発症するB型肝炎対策 厚生労働省「難治性の肝・胆道疾患に関する調査研究」班劇症肝炎分科会および「肝硬変を含めたウイルス性肝疾患の治療の標準化に関する研究」班合同報告.肝臓.2009;50(1):38-42.(レベルⅤ)
|
|
| 2) |
Chheda MG, Drappatz J, Greenberger NJ, et al. Hepatitis B reactivation during glioblastoma treatment with temozolomide:a cautionary note. Neurology. 2007;68(12):955-6.[PMID:17372135](レベルⅣ)
|
|
| 3) |
Grewal J, Dellinger CA, Yung WK. Fatal reactivation of hepatitis B with temozolomide. N Engl J Med. 2007;356(15):1591-2.[PMID:17429098](レベルⅣ)
|
|
| 4) |
Fujimoto Y, Hashimoto N, Kinoshita M, et al. Hepatitis B virus reactivation associated with temozolomide for malignant glioma:a case report and recommendation for prophylaxis. Int J Clin Oncol. 2012;17(3):290-3.[PMID:21809177](レベルⅣ)
|
|
| 5) |
Ohno M, Narita Y, Miyakita Y, et al. Reactivation of hepatitis B virus after glioblastoma treatment with temozolomide--case report. Neurol Med Chir(Tokyo). 2011;51(10):728-31.[PMID:22027252](レベルⅣ)
|
|

|
| |
|
B ニトロソウレア系薬剤
|

|
| |
|
推奨5
初発成人膠芽腫に対して,ニムスチン単剤あるいはニムスチンを含む化学療法を用いる。〔推奨度2C〕
|
|

|
| |
|
解説
|
| |
|
1980年のWalkerらの報告で,悪性神経膠腫に対してニトロソウレア系薬剤と放射線治療を含む治療法の予後が良好な傾向にあったことから,米国を中心に,神経膠腫に対してはニトロソウレア系薬剤(カルムスチン,semustine,lomustine)が中心的な治療薬となった1)(レベルⅠb)。1993年,初発退形成性星細胞腫(2,362例),膠芽腫(3,004例)を対象とした大規模なメタアナリシスが行われ,放射線治療にニトロソウレア系薬剤を併用することにより,1年生存割合が10.1%上昇した(95%CI:6.8-13.3)という報告がなされた2)(レベルⅠa)。以降,ニトロソウレア系薬剤を併用する化学放射線療法が世界的に初発退形成性星細胞腫および膠芽腫に対する標準治療であると考えられるようになった。我が国では,2006年にテモゾロミド(TMZ)が保険適用となるまで,放射線治療と国内承認薬であるニムスチン(ACNU)の併用療法が膠芽腫において,第Ⅲ相試験はなされていないものの,いわばみなし標準治療として広く行われていた3-5)(いずれもレベルⅢ)。
ACNUを含む化学療法は膠芽腫に対して一定の効果は示しているものの,TMZとの抗腫瘍効果を比較する第Ⅲ相試験や放射線治療への上乗せ効果を検証する第Ⅲ相試験は行われていない。また,ACNUを含む化学療法はTMZに比べ有害事象が強い傾向があるという側面もある。以下に,成人初発膠芽腫に対して放射線治療とACNU単独,あるいはACNUを含む化学療法の効果を評価した臨床研究を紹介する。
京都脳腫瘍グループは,97例の初発膠芽腫に対して,放射線治療(60 Gy)とACNU(60 mg/m2,第1治療日),カルボプラチン(110 mg/m2,第1治療日),ビンクリスチン(VCR)(0.6 mg/m2,第1・8・15治療日),インターフェロン-β(10μg/日,週3回,第1週~第7週の併用化学療法の効果と安全性を第Ⅱ相試験で検討した。Grade3以上の毒性は10~20%を示した。無増悪生存期間中央値は10カ月(95%CI:8-12)であり,全生存期間中央値は16カ月(95%CI:13-20)であった6)(レベルⅡa)。
ドイツのNeuro-Oncology Workingグループ(NOA)は,初発悪性神経膠腫に対して標準的放射線療法に併用する化学療法を,ACNU+シタラビン(AraC)群とACNU+teniposide群の2群にランダム化割り付けする第Ⅲ相試験を計画した(NOA-01試験)。1994~2000年に,375例が登録され,初発膠芽腫における生存期間中央値はそれぞれ15.7カ月と17.3カ月,2年生存割合はそれぞれ29%と25%であり,両群間に有意差を認めなかった(HR=1.02,p=0.889)7)(レベルⅠb)。
また,英国では1988~1997年に15施設で悪性神経膠腫674例を対象にランダム化比較試験が行われた。放射線治療単独群と放射線治療に併用してPCV療法〔プロカルバジン(PCZ):100 mg/m2,第1~10治療日,lomustine:100 mg/m2,第1治療日,VCR:1.5 mg/m2(最大2 mg),第1・8・15治療日]を6週間ごとに施行する2群を設定し,PCV療法の上乗せ効果を検証した。放射線治療単独群310例,PCV療法併用群307例が登録され,生存期間中央値は放射線治療単独群9.5カ月に対してPCV療法併用群10カ月であり,両者の間に有意差はなかった(HR=0.95,95%CI:0.81-1.11,p=0.50)。よって,悪性神経膠腫に対してPCV療法は有意な上乗せ効果を示すことはできなかった8)(レベルⅠb)。
Japan Clinical Oncology Group(JCOG)は,悪性神経膠腫(星細胞腫grade Ⅲ・Ⅳ)に対して放射線治療に加えてACNU 80 mg/m2を第1および第36治療日に投与する対象治療群(A群)とPCZ 80 mg/m2(第1~10治療日および第36~45治療日,連日投与)+ACNU 80 mg/m2(第8および第43治療日)を投与する試験治療群(B群)の2群を比較検討した(JCOG 0305試験)。維持療法として,それぞれの化学療法を56日ごとに12サイクル繰り返す予定とした。19施設より111例が登録された。膠芽腫に限れば全生存期間中央値はA群(40例)16.2カ月,B群(41例)18.7カ月,無増悪生存期間中央値はA群6.0カ月,B群6.3カ月であった。全生存期間では両群間に有意差は認められなかった。有害事象として,Grade3以上の白血球減少は,A群38.9%,B群73.2%,血小板減少はA群5.6%,B群50.0%に観察された9)(レベルⅡa)。
[注意]
カルムスチン(BCNU):注射薬は国内未承認,脳内留置用剤(徐放性ポリマー)は悪性神経膠腫に対して承認済み
semustine:国内未承認
lomustine:国内未承認
カルボプラチン:膠芽腫に対しては適応外使用
シタラビン(AraC):膠芽腫に対しては適応外使用
teniposide:国内未承認
|

|
| |
|
| 文献 |
| 1) |
Walker MD, Green SB, Byar DP, et al. Randomized comparisons of radiotherapy and nitrosoureas for the treatment of malignant glioma after surgery. N Engl J Med. 1980;303(23):1323-9.[PMID:7001230](レベルⅠb)
|
|
| 2) |
Fine HA, Dear KB, Loeffler JS, et al. Meta-analysis of radiation therapy with and without adjuvant chemotherapy for malignant gliomas in adults. Cancer. 1993;71(8):2585-97.[PMID:8453582](レベルⅠa)
|
|
| 3) |
Takakura K, Abe H, Tanaka R, et al. Effects of ACNU and radiotherapy on malignant glioma. J Neurosurg. 1986;64(1):53-7.[PMID:3455717](レベルⅢ)
|
|
| 4) |
Matsutani M, Nakamura O, Nakamura M, et al. Radiation therapy combined with radiosensitizing agents for cerebral glioblastoma in adults. J Neurooncol. 1994;19(3):227-37. [PMID:7807173](レベルⅢ)
|
|
| 5) |
Yoshida J, Kajita Y, Wakabayashi T, et al. Long-term follow-up results of 175 patients with malignant glioma:importance of radical tumour resection and postoperative adjuvant therapy with interferon, ACNU and radiation. Acta Neurochir(Wien). 1994;127(1—2):55-9.[PMID:7942182](レベルⅢ)
|
|
| 6) |
Aoki T, Takahashi JA, Ueba T, et al. Phase II study of nimustine, carboplatin, vincristine, and interferon-beta with radiotherapy for glioblastoma multiforme:experience of the Kyoto Neuro-Oncology Group. J Neurosurg. 2006;105(3):385-91.[PMID:16961130](レベルⅡa)
|
|
| 7) |
Weller M, Müller B, Koch R, et al. Neuro-Oncology Working Group 01 trial of nimustine plus teniposide versus nimustine plus cytarabine chemotherapy in addition to involved-field radiotherapy in the first-line treatment of malignant glioma. J Clin Oncol. 2003;21(17):3276-84.[PMID:12947063](レベルⅠb)
|
|
| 8) |
Medical Research Council Brain Tumor Working Party. Randomized trial of procarbazine, lomustine, and vincristine in the adjuvant treatment of high-grade astrocytoma:a Medical Research Council trial. J Clin Oncol. 2001;19(2):509-18.[PMID:11208845](レベルⅠb)
|
|
| 9) |
Shibui S, Narita Y, Mizusawa J, et al. Randomized trial of chemoradiotherapy and adjuvant chemotherapy with nimustine(ACNU)versus nimustine plus procarbazine for newly diagnosed anaplastic astrocytoma and glioblastoma(JCOG0305). Cancer Chemother Pharmacol. 2013;71(2):511-21.[PMID:23228988](レベルⅡa)
|
|

|
| |
|
C インターフェロン-β
|

|
| |
|
推奨6
成人初発膠芽腫患者に対して,Stuppプロトコールへのインターフェロン-βの併用投与を行わない。〔推奨度2B〕
|
|

|
| |
|
解説
|
| |
|
強い抗ウイルス作用を有する生理活性物質として同定されたⅠ型インターフェロン(IFN-α/β)は,抗腫瘍作用を含めたさまざまな作用を示し,1980年頃より,国内外で膠芽腫・悪性神経膠腫治療に使用されてきた1)(レベルⅡa)。1994年,Yoshidaらは過去20年間において放射線とニムスチンとインターフェロン-β(IFN-β)の併用で治療を行った悪性神経膠腫175例(膠芽腫110例と退形成性星細胞腫65例)の長期成績を後方視的に解析し報告した。完全奏効(complete response:CR)例(全摘出例と治療による完全反応例を含む)は23%であり,CR例の3年および5年生存割合はそれぞれ42%と24%であった。問題となる有害事象は観察されなかった2)(レベルⅢ)。2006年にはColmanらが,初発膠芽腫109例に対するIFN-βの補助療法の第Ⅱ相試験の結果を報告した。初発膠芽腫に対して手術後放射線治療を行い,その後IFN-β(600万単位/body,筋肉内投与)を週3回投与した。生存期間中央値は13.4カ月であり,同施設でのhistorical controlに比較して有意差はないものの生存期間が延長する傾向を認めた(HR=1.27,95%CI:0.94-1.63,p=0.19)3)(レベルⅡa)。
一方,Natsumeらは,ヒトグリオーマ細胞株において,IFN-βがp53の誘導を介してMGMTの発現を抑制し,グリオーマ細胞のテモゾロミド(TMZ)感受性を高めることを示した4)。また,in vivoモデルにおいてもIFN-βはTMZの治療効果を高めることを示した5)。
これらの臨床研究結果や基礎実験のデータから,現在の標準治療であるStuppプロトコールにIFN-βを併用することで,さらなる治療効果が得られる可能性が仮説として提唱され,我が国でIFN-βとTMZ併用療法の第Ⅰ相試験(INTEGRA試験)が行われた6)。初発および再発悪性神経膠腫(膠芽腫,退形成性星細胞腫,または,退形成性乏突起膠細胞系腫瘍)を対象とし,Stuppプロトコールの放射線・TMZ併用療法期にIFN-β(300万単位/回,隔日週3回点滴静注)を併用,維持療法期にはTMZ(5日間投与,28日間隔)にIFN-β(300万単位/回/日,28日間隔)を併用し,6サイクル以上施行することとした。初発例には導入・維持療法の両方が,再発例には維持療法が行われた。その結果,有害事象は,初回再発退形成性星細胞腫に対するTMZ単独療法の国内第Ⅱ相試験と比べて大きな違いはなく,同治療の安全性は認容できると考えられた6)(レベルⅡb)。さらに,Motomuraらによる,成人初発成人膠芽腫連続68症例の後方視的解析では,対照群(Stuppプロトコール)の生存期間中央値12.7カ月に対し,IFN-β併用群は19.9カ月であった7)(レベルⅢ)。特に予後不良と考えられるMGMT遺伝子プロモーター非メチル化症例に限定した解析でも,生存期間中央値は対照群12.5カ月に対し,IFN-β併用群は17.2カ月で生存期間延長効果を認めた。多変量解析では,IFN-βの併用は,独立した予後予測因子であった。
これらの結果を踏まえ,2010年4月より,成人初発膠芽腫(20~75歳)に対して,IFN-β+TMZ併用化学放射線療法のStuppプロトコールに対する優越性を探索する多施設共同ランダム化第Ⅱ相試験(JCOG 0911試験)が行われた8)(レベルⅠb)。122例が登録され,試験治療群には導入治療部分のStuppプロトコールにIFN-β(300万単位/回,隔日週3回点滴静注)を併用,維持治療はStuppプロトコールの維持化学療法部分にIFN-β(300万単位/回/日,28日間隔)を併用し,2年間継続することとした。対照群はStuppプロトコールを2年間継続することとした。全生存期間中央値は対照群20.3カ月に対してIFN-β群24.0カ月で,試験治療の優越性は示されなかった(HR=1.00,95%CI:0.65-1.55,one-sided log rank p=0.51)。無増悪生存期間中央値は,対照群10.1カ月に対してIFN-β群8.5カ月であった(HR=1.25,95%CI:0.85-1.84,two-sided p=0.25)。サブグループ解析にて,男性,若年(49歳以下),PS 0の患者において,試験治療群で生存期間が延長されたが有意差は認めなかった。好中球減少やリンパ球減少などの有害事象が試験治療群で多く観察された8)(レベルⅠb)。
|

|
| |
|
| 文献 |
| 1) |
永井政勝.悪性脳腫瘍に対するBRM療法の進歩.癌と化療.1991;18(2):188-94.(レベルⅡa)
|
|
| 2) |
Yoshida J, Kajita Y, Wakabayashi T, et al. Long-term follow-up results of 175 patients with malignant glioma:importance of radical tumour resection and postoperative adjuvant therapy with interferon, ACNU and radiation. Acta Neurochir(Wien). 1994;127(1—2):55-9.[PMID:7942182](レベルⅢ)
|
|
| 3) |
Colman H, Berkey BA, Maor MH, et al. Phase II Radiation Therapy Oncology Group trial of conventional radiation therapy followed by treatment with recombinant interferon-beta for supratentorial glioblastoma:results of RTOG 9710. Int J Radiat Oncol Biol Phys. 2006;66(3):818-24.[PMID:16887285](レベルⅡa)
|
|
| 4) |
Natsume A, Ishii D, Wakabayashi T, et al. IFN-beta down-regulates the expression of DNA repair gene MGMT and sensitizes resistant glioma cells to temozolomide. Cancer Res. 2005;65(17):7573-9.[PMID:16140920]
|
|
| 5) |
Natsume A, Wakabayashi T, Ishii D, et al. A combination of IFN-beta and temozolomide in human glioma xenograft models:implication of p53-mediated MGMT downregulation. Cancer Chemother Pharmacol. 2008;61(4):653-9.[PMID:17564708]
|
|
| 6) |
Wakabayashi T, Kayama T, Nishikawa R, et al. A multicenter phase I trial of combination therapy with interferon-beta and temozolomide for high-grade gliomas(INTEGRA study):the final report. J Neurooncol. 2011;104(2):573-7.[PMID:21327711](レベルⅡb)
|
|
| 7) |
Motomura K, Natsume A, Kishida Y, et al. Benefits of interferon-β and temozolomide combination therapy for newly diagnosed primary glioblastoma with the unmethylated MGMT promoter:A multicenter study. Cancer. 2011;117(8):1721-30.[PMID:21472719](レベルⅢ)
|
|
| 8) |
Wakabayashi T, Natsume A, Mizusawa J, et al;Members of Japan Clinical Oncology Group Brain Tumor Study Group(JCOG-BTSG). JCOG0911 INTEGRA study:a randomized screening phase II trial of interferonβ plus temozolomide in comparison with temozolomide alone for newly diagnosed glioblastoma. J Neurooncol. 2018;138(3):627-36.[PMID:29557060](レベルⅠb)
|
|

|
| |
|
D カルムスチン徐放性ポリマー
|

|
| |
|
推奨7
成人初発膠芽腫手術においてカルムスチン徐放性ポリマーを留置する。〔推奨度2C〕
|
|

|
| |
|
解説
|
| |
|
悪性神経膠腫の化学療法は,全身毒性などの限界より高濃度薬剤を腫瘍へ十分に到達させることが困難である。Siposらのグループは,生物分解性ポリマーにがん化学療法薬を包み込んで局所的に徐放する方法を開発した1)(レベルⅡb)。
続いて同薬が初発悪性神経膠腫(grade Ⅲ・Ⅳ)患者においても有効なことを検証するためのランダム化比較試験が施行された。同意取得後,手術前にカルムスチン徐放性ポリマー処置群とプラセボ群にランダム化割り付けされた患者において,摘出術中の迅速病理診断で悪性神経膠腫の疑いと診断された場合,カルムスチン徐放性ポリマーまたはプラセボが腫瘍摘出腔に留置された。両群で244例が登録され,全例に手術後60 Gyの放射線治療が行われた。生存期間中央値はカルムスチン徐放性ポリマー群で13.9カ月,プラセボ群11.6カ月であり,有意差をもってカルムスチン徐放性ポリマー群が優れていた(HR=0.71,95%CI:0.52-0.96,p=0.03)。また,有害事象に大きな差は観察されなかった2)(レベルⅠb)。ただし,膠芽腫に限った解析(カルムスチン徐放性ポリマー群101例,プラセボ群106例)では生存期間中央値に有意差は認められなかった(HR=0.76,95%CI:0.55-1.05,p=0.10)。
上記以外の成人初発膠芽腫に対するカルムスチン徐放性ポリマー留置を含めた治療成績の検討は後方視的なものである。Johns Hopkins Hospitalからの報告では,初発膠芽腫に対しカルムスチン徐放性ポリマー留置後放射線治療を行った78例の生存期間中央値は12.4カ月,カルムスチン徐放性ポリマー留置後Stuppプロトコールを施行した30例の生存期間中央値は21.3カ月であった3)(レベルⅢ)。Göttingen Universityからの報告では44例の成人初発膠芽腫に対し,カルムスチン徐放性ポリマー留置後Stuppプロトコールを施行した場合,無増悪生存期間中央値7.0カ月,全生存期間中央値12.7カ月であった4)(レベルⅢ)。
さらに,これらを含めた臨床研究を総括した報告によれば,成人膠芽腫新規診断例に対してカルムスチン徐放性ポリマー留置を含む化学放射線治療成績は概ね良好であるが,予後因子にばらつきがあり,Stuppプロトコールと前方視的な比較検証はなされておらず,あくまで後方視的研究という制限をもって評価するべき結果となっている5)(レベルⅢ)。
一方で,カルムスチン徐放性ポリマー製剤留置後の本剤のCT/MRI上の特徴的な経時的変化やair形成6,7)(いずれもレベルⅢ),摘出腔の進行性増大8)(レベルⅢ)といった諸現象,本剤留置後,周囲脳実質の浮腫増強,手術創治癒遷延,髄液漏,頭蓋内感染,BCNU成分の脳室系への拡散等も留意すべき項目である5,8,9)(いずれもレベルⅢ)。
|

|
| |
|
| 文献 |
| 1) |
Sipos EP, Tyler B, Piantadosi S, et al. Optimizing interstitial delivery of BCNU from controlled release polymers for the treatment of brain tumors. Cancer Chemother Pharmacol. 1997;39(5):383-9.[PMID:9054951](レベルⅡb)
|
|
| 2) |
Westphal M, Hilt DC, Bortey E, et al. A phase 3 trial of local chemotherapy with biodegradable carmustine(BCNU)wafers(Gliadel wafers)in patients with primary malignant glioma. Neuro Oncol. 2003;5(2):79-88.[PMID:12672279](レベルⅠb)
|
|
| 3) |
McGirt MJ, Than KD, Weingart JD, et al. Gliadel(BCNU)wafer plus concomitant temozolomide therapy after primary resection of glioblastoma multiforme. J Neurosurg. 2009;110(3):583-8.[PMID:19046047](レベルⅢ)
|
|
| 4) |
Bock HC, Puchner MJ, Lohmann F, et al. First-line treatment of malignant glioma with carmustine implants followed by concomitant radiochemotherapy:a multicenter experience. Neurosurg Rev. 2010;33(4):441-9.[PMID:20706757](レベルⅢ)
|
|
| 5) |
Gutenberg A, Lumenta CB, Braunsdorf WE, et al. The combination of carmustine wafers and temozolomide for the treatment of malignant gliomas. A comprehensive review of the rationale and clinical experience. J Neurooncol. 2013;113(2):163-74.[PMID:23535992](レベルⅢ)
|
|
| 6) |
Hammoud DA, Belden CJ, Ho AC, et al. The surgical bed after BCNU polymer wafer placement for recurrent glioma:serial assessment on CT and MR imaging. AJR Am J Roentgenol. 2003;180(5):1469-75.[PMID:12704070](レベルⅢ)
|
|
| 7) |
Prager JM, Grenier Y, Cozzens JW, et al. Serial CT and MR imaging of carmustine wafers. AJNR Am J Neuroradiol. 2000;21(1):119-23.[PMID:10669235](レベルⅢ)
|
|
| 8) |
Della Puppa A, Rossetto M, Ciccarino P, et al. The first 3 months after BCNU wafers implantation in high-grade glioma patients:clinical and radiological considerations on a clinical series. Acta Neurochir(Wien). 2010;152(11):1923-31.[PMID:20703889](レベルⅢ)
|
|
| 9) |
De Bonis P, Anile C, Pompucci A, et al. Safety and efficacy of Gliadel wafers for newly diagnosed and recurrent glioblastoma. Acta Neurochir(Wien). 2012;154(8):1371-8.[PMID:22718138](レベルⅢ)
|
|

|
| |
|
E 血管新生阻害薬
|

|
| |
|
推奨8
成人初発膠芽腫患者に対して,Stuppプロトコールにベバシズマブの併用を考慮してもよい。〔推奨度2B〕
|
|

|
| |
|
解説
|
| |
|
ベバシズマブは血管内皮増殖因子に対するヒト化モノクローナル抗体薬であり,我が国では初発および再発の悪性神経膠腫の他,大腸がん,肺がん,乳がん,卵巣がん,子宮頸がんに対する治療薬として承認を得ている薬剤である。成人初発膠芽腫に対するベバシズマブのStuppプロトコールへの上乗せ効果を二重盲検法で検証したランダム化第Ⅲ相試験はAVAglio試験とRTOG 0825試験の2つであり,いずれもその結果が2014年に発表された1,2)。
AVAglio試験では,主要評価項目の1つである無増悪生存期間は,中央値でプラセボ群6.2カ月,ベバシズマブ群10.6カ月であり,HR=0.64(95%CI:0.55-0.74,p<0.0001)とベバシズマブ群において有意な延長を認めた1)(レベルⅠb)。もう1つの主要評価項目である全生存期間は,中央値でプラセボ群16.7カ月,ベバシズマブ群16.8カ月,HR=0.88(95%CI:0.76-1.02,p=0.010)と両群に有意差を認めなかった。
RTOG 0825試験では,主要評価項目の1つである無増悪生存期間は,中央値でプラセボ群7.3カ月,ベバシズマブ群10.7カ月であり,HR=0.79(95%CI:0.66-0.94,p=0.007)というAVAglio試験と同様の結果であった2)(レベルⅠb)。しかし,RTOG 0825試験では無増悪生存期間に関してあらかじめ有意水準を両側検定でp<0.004と設定しているため,この結果は統計学的に有意水準には達していないと判定された。もう1つの主要評価項目である全生存期間は,中央値でプラセボ群16.1カ月,ベバシズマブ群15.7カ月,HR=1.13(95%CI:0.97-1.37,p=0.21)と有意差を認めなかった。
このように2つの試験において,無増悪生存期間と全生存期間は数値としてはほぼ一致した結果が得られ,主要評価項目のうち無増悪生存期間はベバシズマブ群で一定の延長を認めた。しかしながら,両試験の画像上の無増悪生存期間が,特に血管新生阻害療法の画像評価による病変の真の増悪の判定での弱点が指摘されているMacdonald基準により測定されていることからも,結果の解釈には注意が必要である。実際,より厳密な評価項目とされる全生存期間は,いずれの試験でも上乗せ効果を確認できなかった。なお,クロスオーバーの比率,すなわちプラセボ群において再発時にベバシズマブを使用している症例の割合は,AVAglio試験では約30%,RTOG 0825試験では約50%でしかないため,これらの試験から再発時にベバシズマブを初めて投与することの全生存期間への影響を判断することは難しい。
QOLの検討においては,2つの試験での評価結果が一致しなかった。AVAglio試験では,副次評価項目の1つとしてQOL解析を掲げ,健康関連QOL(health-related quality of life:HRQOL) に関するEORTC QLQ-C30と,脳腫瘍特異的な指標であるBN20を評価の指標とした。主な解析項目としてQLQ-C30では全般的健康状態,身体機能,社会生活機能を,BN20では運動機能,コミュニケーション能力の5項目を事前に設定し経時的に測定したのに加え,その他の21項目についても評価を行った3)(レベルⅢ)。質問票のスコア(100点満点換算)が試験前のベースラインから,10点以上低下した場合を悪化と定めた。悪化までの期間をプラセボ群とベバシズマブ群で比較したところ,上記5つの項目すべてにおいてベバシズマブ群で悪化までの期間が延長しており(p<0.001),その他21項目についても,ベバシズマブで有意に悪化までの期間が延長していた(p<0.05)。ただし,ほとんどの項目でベースラインからの低下は10点未満で,両群ともに臨床的に意味のあるほどの変化を認めなかった。健康関連QOLの低下は再発進行時に認めており,無増悪の間はベバシズマブ上乗せが健康関連QOLに与える影響は特になかった。屋内生活の自立が可能の目安とされるKPS 70%以上の状態が,中央値でプラセボ群6カ月に対してベバシズマブ群9カ月と3カ月延長した。ベバシズマブ群のほうが,ステロイドを必要とする患者が少なかった。
一方,RTOG 0825試験では,附随研究として臨床症状評価にMD Anderson症状評価表—脳腫瘍版(MDASI-BT)を,認知機能評価にHVLT-R(Hopkins verbal learning test-revised),TMT(trail making test),COWA(controlled oral word association test)を,QOLの評価にEORTC QLQ-C30/BN20を用い,これらの指標を同一症例で経時的に追跡評価した。事前に定めたプロトコールに従い進行(progressive disease:PD)となった症例は,その時点からこの解析から除外されている。その結果,ベバシズマブ群において経時的に,これらいずれのスコアも悪化する傾向が認められた。
このように両試験とも無増悪生存期間はベバシズマブ投与によって延長しているにもかかわらず,健康関連QOL評価,認知機能評価の結果は,2つの試験で一致しなかった。その原因には,QOL解析方法の違いが挙げられているが,その他に調査票回収率など調査のコンプライアンスの関与も考えられる。AVAglio試験ではQOLが副次評価項目であったため,試験開始後1年の時点でほぼ8割の患者で施行されているが,RTOG 0825試験ではQOL解析は附随研究に位置づけられており,試験開始から34~46週の時点での検査結果回収率が約5割に留まっている。ただし,健康関連QOLに関しては,再発進行に伴い増悪した患者を除けば,両試験ともベバシズマブ上乗せによる改善は認めないという点で,共通した結果であった。
有害事象についてAVAglio試験では,重篤な有害事象はプラセボ群(25.6%)よりベバシズマブ群(38.8%)で有意に多く認め(p<0.001),同様に,Grade3以上の有害事象はプラセボ群(51.3%)よりベバシズマブ群(66.8%)で有意に多く認めた(p<0.001)。ベバシズマブ群において高血圧(Grade3以上11.3%)や蛋白尿(同5.4%)がプラセボ群に比べて多く観察された。また,動脈塞栓血栓症もGrade3以上の症例が5.0%とプラセボ群の1.3%より多かった(p=0.003)。その他のベバシズマブ群でより多く観察された重篤な有害事象は,出血,創傷治癒合併症,消化管穿孔,うっ血性心不全であった。RTOG 0825試験では,ベバシズマブ群で多くみられた化学放射線療法時の重篤な有害事象は,好中球減少(7.3% vs. 3.7%)と血栓塞栓症(10.2% vs. 7.7%)であり,維持療法中の重篤な有害事象もベバシズマブ群で多く,高血圧(4.2% vs. 0.9%),血栓塞栓症(7.7% vs. 4.7%),創傷治癒障害(1.5% vs. 0.9%),疲労(13.1% vs. 9.0%),消化管穿孔(1.2% vs. 0.4%),出血(1.5% vs. 0.9%),好中球減少(10.0% vs. 5.1%)であった。このように,両試験の有害事象プロファイルは類似した結果であり,ベバシズマブ群では重篤な有害事象が多く観察された。ただし,AVAglio試験データの有害事象を中心とした解析では,これら有害事象は,標準治療や再手術の施行の障害になるほどのものではないとの結果も報告されている4)(レベルⅢ)。
このように,両試験ともに全生存期間の延長が認められないため,ベバシズマブ投与により効果を認めるサブグループを同定することが重要と考えられる。AVAglio試験で増悪時に治療が行われなかった症例を解析すると,ベバシズマブ投与群での全生存期間の延長を認めるため,増悪時に治療ができそうもない初発膠芽腫患者に対しては,Stuppプロトコールへの上乗せ効果が期待できる可能性があると考えられた5)(レベルⅢ)。また,AVAglio試験にて収集した腫瘍検体の遺伝子発現解析からproneural, mesenchymal, proliferative, unclassified群に分けて予後との関連を検証したところ,IDH1 wild-typeのproneural群でベバシズマブ上乗せ効果が認められた(全生存期間12.8カ月vs.17.1カ月,p=0.002)6)(レベルⅢ)。これにより,初発膠芽腫ではIDH1 wild-typeのproneural群がベバシズマブの治療効果予測因子であることが示唆されたが,この結果が実臨床に反映されるためには,proneural群を同定し得る比較的容易な検査法の開発が必要であり,また他のコホートにおける検証も望ましく,現時点での臨床的な有用性は限定的である。
|

|
| |
|
| 文献 |
| 1) |
Chinot OL, Wick W, Mason W, et al. Bevacizumab plus radiotherapy-temozolomide for newly diagnosed glioblastoma. N Engl J Med. 2014;370(8):709-22.[PMID:24552318](レベルⅠb)
|
|
| 2) |
Gilbert MR, Dignam JJ, Armstrong TS, et al. A randomized trial of bevacizumab for newly diagnosed glioblastoma. N Engl J Med. 2014;370(8):699-708.[PMID:24552317](レベルⅠb)
|
|
| 3) |
Taphoorn MJ, Henriksson R, Bottomley A, et al. Health-related quality of life in a randomized phase III study of bevacizumab, temozolomide, and radiotherapy in newly diagnosed glioblastoma. J Clin Oncol. 2015;33(19):2166-75.[PMID:26014298](レベルⅢ)
|
|
| 4) |
Saran F, Chinot OL, Henriksson R, et al. Bevacizumab, temozolomide, and radiotherapy for newly diagnosed glioblastoma:comprehensive safety results during and after first-line therapy. Neuro Oncol. 2016;18(7):991-1001.[PMID:26809751](レベルⅢ)
|
|
| 5) |
Chinot OL, Nishikawa R, Mason W, et al. Upfront bevacizumab may extend survival for glioblastoma patients who do not receive second-line therapy:an exploratory analysis of AVAglio. Neuro Oncol. 2016;18(9):1313-8.[PMID:27006178](レベルⅢ)
|
|
| 6) |
Sandmann T, Bourgon R, Garcia J, et al. Patients with proneural glioblastoma may derive overall survival benefit from the addition of bevacizumab to first-line radiotherapy and temozolomide:Retrospective analysis of the AVAglio trial. J Clin Oncol. 2015;33(25):2735-44.[PMID:26124478](レベルⅢ)
|
|

|
|
|

|

|

|
| 光線力学的療法
|

|
| |
|
CQ4 悪性神経膠腫(初発・再発)を含めた悪性脳腫瘍に対して,開頭腫瘍摘出術の際のタラポルフィンナトリウムと半導体レーザを用いた光線力学的療法は有効か?
|

|
| |
|
推奨
悪性神経膠腫(初発・再発)を含めた悪性脳腫瘍に対して,開頭腫瘍摘出術の際のタラポルフィンナトリウムと半導体レーザを用いた光線力学的療法を考慮してもよい。〔推奨度2C〕
|
|

|
| |
|
解説
|
| |
|
光線力学的療法(photodynamic therapy:PDT)は,光感受性物質(photosensitizer)と低出力レーザの光線力学的反応で発生する一重項酸素の細胞障害を用いる治療である。光線力学的療法は,我が国では,肺がん,食道がん,胃がん,子宮頸がん/異形成,加齢黄斑変性症,悪性脳腫瘍に対する治療として承認を得ている。悪性神経膠腫(初発・再発)を含めた悪性脳腫瘍に対するタラポルフィンナトリウムと半導体レーザを用いた光線力学的療法の効果を検証した臨床試験は以下に記載する2報1,2)のみであり,ランダム化第Ⅲ相試験による有効性の検討は実施されていない。
Akimotoらは,2006~2008年に単施設で腫瘍摘出術と腫瘍浸潤脳領域に対するタラポルフィンナトリウムと半導体レーザを用いた光線力学的療法の安全性と有効性を検討した1)(レベルⅡb)。Eloquent area(機能領域)への浸潤を認め,全摘出不能である初発悪性神経膠腫6例,再発悪性神経膠腫8例を対象とした。初発悪性神経膠腫においては奏効割合80%であり,無増悪生存期間中央値23カ月であった。初発膠芽腫4例では無増悪生存期間中央値18カ月,全生存期間中央値31カ月であった。再発悪性神経膠腫では奏効割合25%,無増悪生存期間中央値3カ月,全生存期間中央値9カ月であった。光線力学的療法に伴う有害事象を認めなかった。
Muragakiらは,2施設において初発悪性神経膠腫21例,再発悪性神経膠腫1例を対象にタラポルフィンナトリウムと半導体レーザを用いた光線力学的療法の安全性と有効性を治験にて検討した2)(レベルⅡa)。全症例においては全生存期間中央値27.9カ月,無増悪生存期間中央値20カ月,局所無増悪生存期間中央値22.5カ月であった。初発膠芽腫13例においては,全生存期間中央値24.8カ月,無増悪生存期間中央値12カ月,局所無増悪生存期間中央値20カ月であった。タラポルフィンナトリウムを投与された27例で関連の可能性が低い有害事象が22.2%に認められた。皮膚の有害事象は7.4%で認められた。これらの臨床試験結果から,タラポルフィンナトリウムと半導体レーザを用いた光線力学的療法に大きな有害事象は生じることなく安全性が認められた。特に初発膠芽腫に対する有効性が示唆される。本試験結果に基づいて,2013年に悪性脳腫瘍に対するタラポルフィンナトリウムを用いた光線力学的療法が我が国で承認された。
|

|
| |
|
| 文献 |
| 1) |
Akimoto J, Haraoka J, Aizawa K. Preliminary clinical report on safety and efficacy of photodynamic therapy using talaporfin sodium for malignant gliomas. Photodiagnosis Photodyn Ther. 2012;9(2):91-9.[PMID:22594978](レベルⅡb)
|
|
| 2) |
Muragaki Y, Akimoto J, Maruyama T, et al. Phase II clinical study on intraoperative photodynamic therapy with talaporfin sodium and semiconductor laser in patients with malignant brain tumors. J Neurosurg. 2013;119(4):845-52.[PMID:23952800](レベルⅡa)
|
|

|

|

|
| 交流電場腫瘍治療システム
|

|
| |
|
CQ5 膠芽腫に対する,交流電場腫瘍治療システム(NovoTTF-100Aシステム)の使用は有効か?
|

|
| |
|
推奨
初発テント上膠芽腫に対して,手術と化学放射線療法の初期治療後,化学療法の維持療法時に交流電場腫瘍治療システム(NovoTTF-100Aシステム)の使用追加を考慮する。〔推奨度1B〕
|
|

|
| |
|
解説
|
| |
|
交流電場療法は,有糸分裂中の細胞を標的とした2方向の腫瘍治療電場(tumor treatment fields:TTFields)を順次印加する治療法である。この交流電場が有糸分裂中期の核分裂停止を誘発し,有糸分裂後期から終期に,高分子/細胞小器官を細胞分裂溝に押しやり,構造的破壊を誘発するという。交流電場療法の効果は方向性や強度および周波数に依存し,基礎実験では膠芽腫の適正周波数は200 kHzで強度は≧1 V/cmであった1)。臨床的に最低4週間効果的な治療を継続する必要があると考えられている。
初発テント上膠芽腫患者において,NovoTTF-100Aシステム+テモゾロミド(TMZ)治療をTMZ単独治療と比較する第Ⅲ相試験(EF-14)が実施された。標準治療であるTMZ併用化学放射線療法の初期治療の4~7週間後に2対1にランダム化割り付けされ,NovoTTF-100Aシステム+TMZ維持治療6サイクル群(試験群)と,TMZ維持治療6サイクル群(対照群)の治療を行った。初回再発後,試験群はNovoTTF-100Aシステム+セカンドライン治療(化学療法±手術±定位放射線治療),対照群はセカンドライン治療を24カ月後あるいは2度目の増悪まで施行した2)。試験は315例(210例 vs.105例)を対象とした中間解析の結果,米国FDAから早期の有効中止を勧告された。最終的に695例(466例 vs.229例)が解析対象となり,主要評価項目であるランダム化からの無増悪生存期間中央値が,試験群7.2カ月が対照群4.0カ月と比較し有意に長かった(HR=0.621,p=0.0013)。また副次評価項目である全生存期間中央値も試験群が20.5カ月で,対照群の15.6カ月と比較し有意に長く(HR=0.666,p=0.0042),2年生存割合も有意に高かった(48% vs.32%,p=0.0058)。また,試験群は対照群と比較し重篤な有害事象発生の有意な増加はなく,最も一般的(≧10%)な有害事象は,血小板減少症,貧血,便秘,嘔吐,疲労,医療機器装着部位の反応,頭痛,痙攣,鬱状態であり,NovoTTF-100Aシステムに関連した最も一般的な有害事象は,軽度から中等度の皮膚有害事象だった2)(レベルⅠb)。
これらの結果より,オープン試験という批判はあるものの前方視的ランダム化比較試験によって無増悪生存期間中央値,全生存期間中央値ともに有意な延長を示した治療法であり,米国のNCCNガイドラインで初発膠芽腫の標準治療の選択肢として推奨されている(カテゴリー2A)。我が国での臨床経験は少ないものの,物理力を使用した治療法であるため,薬剤のような人種特有の有害事象は考えにくい。医療経済の議論はあるが,初発膠芽腫患者での使用が推奨される。
EF-14試験に先立ち,237例の再発膠芽腫に対してランダム化第Ⅲ相試験(EF-11試験)が施行された。NovoTTF-100Aシステム単独群(120例)と医師選択の化学療法群(117例)を多施設でランダム化比較したところ,生存期間中央値が試験群6.6カ月,対照群が6.0カ月と有意差を認めなかった(p=0.27)3)(レベルⅠb)。NovoTTF-100Aシステムの優越性は証明できなかったものの,効果が同等であった化学療法と比較して有害事象が軽度であり,日米両国で再発膠芽腫を適応に薬事承認された。
この米国での承認後にNovoTTF-100Aシステムを使用した457例の再発膠芽腫に関する市販後調査(PRiDe試験)報告がある。NovoTTF-100Aシステムによる生存の明確な予後予測因子はコンプライアンスであり,1日あたり18時間以上の使用群が18時間未満群と比較し生存期間が長かった。また,初回再発群が2回目や3回目以上再発群と比較し成績が良好であった4)(レベルⅢ)。
以上から,再発膠芽腫については,交流電場腫瘍治療システムが治療選択肢の一つと考えられる。
[注意]
交流電場腫瘍治療システム(NovoTTF-100Aシステム):薬事承認されているが,再発膠芽腫に対しては保険適用外(自費)
|

|
| |
|
| 文献 |
| 1) |
Kirson ED, Dbalý V, Tovarys F, et al. Alternating electric fields arrest cell proliferation in animal tumor models and human brain tumors. Proc Natl Acad Sci USA. 2007;104(24):10152-7.[PMID:17551011]
|
|
| 2) |
Stupp R, Taillibert S, Kanner AA, et al. Maintenance therapy with tumor-treating fields plus temozolomide vs temozololmide alone for glioblastoma:a randomized clinical trial. JAMA. 2015;314(23):2535-43.[PMID:26670971](レベルⅠb)
|
|
| 3) |
Stupp R, Wong ET, Kanner AA, et al. NovoTTF-100A versus physician’s choice chemotherapy in recurrent glioblastoma:a randomised phase III trial of a novel treatment modality. Eur J Cancer. 2012;48(14):2192-202.[PMID:22608262](レベルⅠb)
|
|
| 4) |
Mrugala MM, Engelhard HH, Dinh Tran D, et al. Clinical practice experience with NovoTTF-100ATM system for glioblastoma:The Patient Registry Dataset(PRiDe). Semin Oncol. 2014;41(5)(suppl 6):S4-S13.[PMID:25213869](レベルⅢ)
|
|

|

|

|
| 再発例への治療
|

|
| |
|
CQ6 成人再発膠芽腫に対する治療はどのように行うか?
|

|
| |
|
A 手術
|

|
| |
|
推奨1
症例によっては,再発膠芽腫に対して再手術を考慮してもよい。〔推奨度2C〕
|
|

|
| |
|
解説
|
| |
|
再発膠芽腫に対する再摘出術は,腫瘍塊によって生じている症状の軽減のみならず,ステロイド投与量の減量や併用する追加療法の効果を高める意義が指摘されている。高い術前PS(KPS 70%以上)・全摘出・若年者(50歳未満)・初発から再発までの期間が長いこと(6カ月以上)などを満たす症例が,再手術により生存期間が延長されると報告されてきた1,2)(いずれもレベルⅢ)。しかし,いずれも初発膠芽腫に比較してさらに不均一な症例群を対象とした後方視的検討であり,再発膠芽腫に対する再手術の意義は確立していない。
Parkらは,National Institutes of Health (NIH) recurrent GBM scaleを用いて,再発膠芽腫に対する手術適応を検討した。NIH recurrent GBM scaleとは,KPS 80%以下・腫瘍容積50 cm3以上・motor-speech-middle cerebral artery(MSM)スコア(推定される運動・言語領域およびM1-M2 segmentを含むかどうか)2以上という3項目について,それぞれ1点を与え,0~3点まで4段階に分類する方法である。まずNIHにおける34例の連続再発膠芽腫症例に関して,このNIH recurrent GBM scaleでの分類と再発後の生存期間を検討後,Brigham and Women’s Hospital(BWH)における109例の連続再発膠芽腫症例を用いて検証した3)(レベルⅢ)。その結果,予後良好群(0点),予後中間群(1~2点),予後不良群(3点)の間で有意に生命予後が異なり(生存期間中央値はそれぞれ10.8,4.5,1.0カ月),これはBWHにおける検証結果でも証明された(生存期間中央値はそれぞれ9.2,6.3,1.9カ月)。
このように,予後良好群と中間群では再摘出後に比較的長期間生存可能であったという結果から,これらの群に対しては再手術を考慮すべきであると結論づけている3)(レベルⅢ)。しかし,この解析結果に関しては,予後不良群がNIH,BWHともに3例ずつでしかないこと,術後に化学療法を含めた追加治療を行っていないことが問題点として指摘されている。すなわち,化学療法の併用により,再発膠芽腫に対する手術療法はより有意義になり得る可能性が示唆されている。実際に,再発膠芽腫に可及的再摘出術と併用してカルムスチン徐放性ポリマー留置やIL13-PE38QQRのconvection-enhanced deliveryが用いられた第Ⅱ/Ⅲ相試験では,生存期間中央値は35.3~50.3週と比較的良好な結果が得られており,再発膠芽腫に対する手術療法の意義を高めるうえで総合的な治療の有用性が示唆される4,5)(それぞれレベルⅡb,Ⅰb)。
North American Brain Tumor Consortiumにて行われた再発膠芽腫に対するさまざまな薬剤を用いた19の第Ⅱ相試験に対してメタアナリシスが行われ,再発時に再摘出を行った181例と行わなかった412例の6カ月無増悪生存割合と全生存割合が検討された6)(レベルⅠa)。その結果,両群間には有意差は認められず,再発膠芽腫に対する新規治療方法を模索するうえで,再摘出の有無により層別化する必要はないと結論づけている。しかし,今回の結果は再摘出術の必要性をすべて否定するものではなく,再発時の頭蓋内圧亢進症状や局所症状を緩和し,追加治療に十分耐えられるようにするために再摘出術は重要である,と考察に記載されている点は注目すべきである。彼らは,再摘出術の意義を,再発時に手術を必要とせず治療可能な症例と,塊として存在する腫瘍により状態が悪化している症例を,手術により均衡化(“balance the scales”)することにあると表現している。
再発膠芽腫に対する再摘出術の適応を個々の症例において明確に決定することは困難であるが,再摘出がその予後改善に重要な意義を有する症例は存在し,さらに追加治療を行うことにより膠芽腫全体の予後改善の可能性が示唆されている。
|

|
| |
|
| 文献 |
| 1) |
Barbagallo GM, Jenkinson MD, Brodbelt AR.‘Recurrent’glioblastoma multiforme, when should we reoperate? Br J Neurosurg. 2008;22(3):452—5.[PMID:18568742](レベルⅢ)
|
|
| 2) |
Helseth R, Helseth E, Johannesen TB, et al. Overall survival, prognostic factors, and repeated surgery in a consecutive series of 516 patients with glioblastoma multiforme. Acta Neurol Scand. 2010;122(3):159—67.[PMID:20298491](レベルⅢ)
|
|
| 3) |
Helseth R, Helseth E, Johannesen TB, et al. Overall survival, prognostic factors, and repeated surgery in a consecutive series of 516 patients with glioblastoma multiforme. Acta Neurol Scand. 2010;122(3):159—67.[PMID:20298491](レベルⅢ)
|
|
| 4) |
Quinn JA, Jiang SX, Carter J, et al. Phase II trial of Gliadel plus O6-benzylguanine in adults with recurrent glioblastoma multiforme. Clin Cancer Res. 2009;15(3):1064—8.[PMID:19188181](レベルⅡb)
|
|
| 5) |
Kunwar S, Chang S, Westphal M, et al. Phase III randomized trial of CED of IL13-PE38QQR vs Gliadel wafers for recurrent glioblastoma. Neuro Oncol. 2010;12(8):871—81.[PMID:20511192](レベルⅠb)
|
|
| 6) |
Clarke JL, Ennis MM, Yung WK, et al. Is surgery at progression a prognostic marker for improved 6-month progression-free survival or overall survival for patients with recurrent glioblastoma? Neuro Oncol. 2011;13(10):1118—24.[PMID:21813511](レベルⅠa)
|
|

|
| |
|
B 化学療法
|

|
| |
|
推奨2
成人再発膠芽腫に対して,全身・局所化学療法を考慮してもよい。〔推奨度2C〕
|
|

|
| |
|
解説
|
| |
|
1.通常量テモゾロミド
欧米での多施設共同臨床試験として,テモゾロミド(TMZ)未治療の再発膠芽腫に対するTMZの有効性を検討する比較化第Ⅱ相試験が施行された。1995~1997年に,225例の初回再発(前治療としてTMZは未使用)膠芽腫に対して,TMZ投与群とプロカルバジン(PCZ)投与群を比較した。TMZは1日150~200 mg/m2を5日間連続投与し,28日を1サイクルとして繰り返し施行した(5-day on/23-day off)。PCZは1日あたり125~150 mg/m2の同薬を28日間連続内服し,28日休薬する(56日を1サイクル)投与法を繰り返し行った。6カ月無増悪生存割合は,TMZは21%(95%CI:13-29)であり,PCZは8%(95%CI:3-14)であり(HR=1.54,p=0.008),無増悪生存期間中央値はそれぞれ12.4週と8.32週であった(HR=1.47,95%CI:1.11-1.95,p=0.0063)。毒性は許容範囲であった。この結果をもって欧米では再発悪性神経膠腫に対してTMZの保険適用が認められた1)(レベルⅠb)。
続いて我が国において,同薬の有効性を検討するためTMZ未治療の成人退形成性星細胞腫(星細胞腫gradeⅢ)初回再発患者32例に対して,上記投与法による国内第Ⅱ相試験が行われた。6カ月での無増悪生存割合は40.6%,無増悪生存期間中央値は4.1カ月であった。TMZ未治療の再発悪性神経膠腫に対して5-day on/23-day off投与法は我が国においても安全に遂行可能であり,優れた忍容性を持つことが判明した2)(レベルⅡa)。
2.ニトロソウレア系薬剤
ドイツの研究グループが2003~2008年における前治療としてTMZを使用した再発膠芽腫32例に対して,ニムスチン(ACNU)を含むプロトコールで治療した結果を報告している。ACNU単独投与は14例で,teniposideとの併用は17例であった。6カ月無増悪生存期間は20%であった。Grade3以上の有害事象を50%に認めた。再発膠芽腫に対してのTMZの成績と比較して副作用は強いが,6カ月無増悪生存期間は同等であった3)(レベルⅢ)。
海外においては,再発膠芽腫に対してlomustineが第Ⅲ相試験のコントロール群として投与され,やはり20%程度の6カ月無増悪生存割合が報告されている4)(レベルⅠb)。
[注意]
teniposide:国内未承認
lomustine:国内未承認
3.インターフェロン-β
再発膠芽腫・退形成性星細胞腫患者に対するインターフェロン-β(IFN-β)の多施設共同第Ⅰ/Ⅱ試験が,1986~1988年に米国の6つの施設で行われた。IFN-β(90~540万単位)が1週間に3回点滴静注された。すべての患者は初期治療として放射線治療がなされており,多くの患者は1種類以上の化学療法を受けていた。登録72例のうち,65例(膠芽腫41例,退形成性星細胞腫24例)が評価可能であり,15例(23%)は病変が縮小,18例(28%)は変化を認めず,無増悪期間中央値は23週であった5)(レベルⅡa)。
我が国では再発膠芽腫・退形成性星細胞腫に対するTMZ(5-day on/23-day off投与)とIFN-β 300万単位(28日ごと投与)の併用化学療法の安全性を検討する第Ⅰ相試験が行われ,有害事象は忍容できるものであることが確認された6)(レベルⅡb)。
4.カルムスチン徐放性ポリマー
再発悪性神経膠腫に対するカルムスチン(BCNU)徐放性ポリマーの効果を評価するために,ランダム化比較試験を施行した。主要評価項目は試験薬留置後の全生存期間とされた。27施設において222例の再発悪性脳腫瘍患者が登録され,カルムスチン徐放性ポリマー留置群110例,プラセボ留置群112例にランダム化割り付けされた。カルムスチン徐放性ポリマー留置群の生存期間中央値は31週,プラセボ留置群のそれは23週であり,主要評価項目の全生存期間は単変量解析では有意差を認めなかった(HR=0.83,95%CI:0.63-1.10,p=0.19)。しかし,post-hocに多変量解析を用いて年齢,人種,摘出量,照射法,化学療法の有無,組織診断の因子で調整すると,カルムスチン徐放性ポリマー留置群はプラセボ留置群に比べて生存期間中央値は有意に延長した(HR=0.67,95%CL:0.51-0.90,p=0.006)7)(レベルⅠb)。同試験において,膠芽腫のみを選択し,同様にpost-hocに多変量解析を用いて因子調整すると,カルムスチン徐放性ポリマー留置群(72例)はプラセボ留置群(73例)に比べて有意にHRが低下した(HR=0.67,95%Cl:0.48-0.95,p=0.02)7)(レベルⅠb)。
再発膠芽腫に対する本剤の有効性・安全性については,成人初発膠芽腫と同様に今後の厳密な検討が必要である8)(レベルⅢ)(本章CQ3,推奨7参照)。
5.ベバシズマブ
膠芽腫は大部分が血管内皮増殖因子を発現しているため,血管内皮増殖因子に対するヒト化モノクローナル抗体薬であるベバシズマブは腫瘍血管増殖を選択的に阻害し,膠芽腫の治療薬となる可能性が示されていた9,10)(いずれもレベルⅡa)。引き続き計画された臨床試験では,再発膠芽腫(初回再発89%,第2回再発11%)を対象としてベバシズマブの単独投与群と,ベバシズマブ+イリノテカン併用群の2群に分け,6カ月無増悪生存割合を主要評価項目として比較,検討している。ベバシズマブ単独群では36%(85例中31例),併用群では51%(82例中42例)が6カ月間,腫瘍の増大を認めなかった。Historical controlにおいて6カ月無増悪生存割合は15%程度と考えられるため,ベバシズマブは,再発膠芽腫の有効な治療薬となる可能性が示された11)(レベルⅡa)。米国では,これらの結果を受けて再発膠芽腫に対するベバシズマブの使用がFDAにより暫定的に認可された。
我が国では再発悪性神経膠腫に対するベバシズマブ単独療法の有効性・安全性を検討することを目的として,多施設共同第Ⅱ相試験が行われた。Stuppプロトコールでの治療後の初回再発を中心とした悪性神経膠腫を対象として,ベバシズマブ10 mg/kgを2週間隔で病勢進行まで投与した。主要評価項目は再発膠芽腫での6カ月無増悪生存割合,副次評価項目は再発膠芽腫および全症例に対する6カ月無増悪生存割合,奏効割合,全生存期間,安全性とした。病変評価はMacdonald基準を用いた。2009年8月~2010年7月に31例(初回病理診断膠芽腫29例,GradeⅢ神経膠腫2例)が登録された。膠芽腫患者中,初回再発17例,再々発12例であった。再発膠芽腫29例の6カ月無増悪生存割合は33.9%(90%CI:19.2-48.5),無増悪生存期間中央値3.3カ月(95%CI:2.8-6.0),奏効割合27.6%,1年生存割合34.5%(90%CI:20.0-49.0),全生存期間中央値10.5カ月(95%CI:8.2-12.4)であった。全31例中7例(22.6%)で6カ月以上の奏効が確認された。ベバシズマブ投与回数中央値は6回であった。主な有害事象は,尿蛋白(41.9%),高血圧(32.3%),下痢(25.8%)であり,Grade3以上のものは41.9%に発現した。治療を要した高血圧は6例(19.4%)に観察され,ベバシズマブとの因果関係が否定できない重篤な有害事象は4例〔12.9%(虫垂炎,深部静脈血栓症,心不全,痙攣)〕に認められた。投与中止に至った有害事象は,脳出血(Grade1)と好中球減少(Grade2)の2例(6.5%)であった。これらの結果より,ベバシズマブ単独療法は,我が国においても忍容性が高く,膠芽腫再発例を含めた再発悪性神経膠腫に対する有望な治療法の一つであると思われる12)(レベルⅡa)。
ただし,ベバシズマブ投与時には画像検査上の造影剤増強域の縮小,脳浮腫の縮小といった効果,およびこれらに対応する臨床症状の改善は比較的早期に現れるが,画像上の病巣の縮小と病勢の制御が相関しない症例が存在すること,投与後の再発・再増大の際には腫瘍の浸潤域(T2高信号域)の拡大が著明な傾向があること,造影剤増強域の増大を示さずに臨床症状の悪化がみられること等の問題点が指摘されている13,14)(いずれもレベルⅢ)。
[注意]
イリノテカン:適応外使用
6.テテモゾロミド用量強化療法
悪性神経膠腫のTMZ耐性に関係するDNA修復酵素MGMTは修復反応に伴って不活化された後,再び活性型に戻ることなく分解される。DNAがメチル化されている箇所が多ければ多いほどMGMTがDNAの修復に費やされ,分解・枯渇化することが想定されていた15)(レベルⅡb)。すなわち,腫瘍に対するTMZ露出を増加させることによりMGMTが発現している腫瘍に対してもTMZの抗腫瘍効果を上げることが理論上可能であり,この仮説に基づいて,いくつかのTMZ用量強化プロトコールが試されている。代表的なプロトコールは,1-week on/1-week off投与,3-week on/1-week off投与,連日投与の3種類である16-18)(それぞれレベルⅡa,Ⅰb,Ⅱa)。
ドイツの脳腫瘍グループでは,90例の再発悪性神経膠腫患者を対象として,1日投与量150 mg/m2とし,1-week on/1-week off投与で用量強化療法の第Ⅱ相試験を実施した。通常用量の5-day on/23-day off投与より強い毒性は認められなかった。Grade4以上の血液毒性は2.6%であり,11例(12%)にGrade4以上のリンパ球減少症を認めたが,遷延性リンパ球減少も日和見感染も観察されなかった。6カ月無増悪生存割合は43.8%,無増悪生存期間中央値は24週(95%CI:17-26)であった。生存期間中央値は38週(95%CI:30-46),1年生存割合は23%であり,一定の安全性と有効性が示唆された16)(レベルⅡa)。
英国脳腫瘍グループでは,447例の化学療法の前治療歴のない再発悪性神経膠腫に対してPCV〔プロカルバジン(PCZ)+lomustine+ビンクリスチン(VCR)〕療法,TMZ 5-day on/23-day off投与とTMZ 3-week on/1-week off投与の3群間で比較試験を行っている17)(レベルⅠb)。9カ月時点での治療完遂率はそれぞれ17%,26%,13%であった。主な有害事象は3群間で大きな差がなかった。PCV群をTMZ全体の治療と比較すると,12カ月の生存割合においてPCV群とTMZ群には有意差は認めなかった(HR=0.91,95%CI:0.74-1.11,p=0.35)。TMZ投与群では5-day on/23-day off群と3-week on/1-week off群における12週無増悪生存割合はそれぞれ63.6%と65.7%と同程度であった(p=0.745)が,無増悪生存期間(HR=1.38,95%CI:1.05-1.82,p=0.023),生存割合(HR=1.32,95%CI:0.99-1.75,p=0.056),QOL(6カ月間QOLを10ポイント改善した割合:それぞれ49%と19%,p=0.005)と,5-day on/23-day off投与において良い傾向が示唆された。腫瘍制御,QOL改善の点で3-week on/1-week off群は5-day on/23-day off群に比べて高い有効性を示すことができなかった。
RESCUE試験と命名されたカナダでの臨床研究ではStuppプロトコールで治療された後に再発を認めた膠芽腫91例に対して,再増大が観察されるまでTMZ 50 mg/m2を毎日連続投与する治療法の有効性が検討された18)(レベルⅡa)。この91例は,まず再発様式から,B1(維持療法6サイクル未満で再発),B2〔6サイクル以上で再発(サイクルの中断なし)〕,B3(6サイクル以上施行し,かつ2カ月以上のTMZ無治療期間の後に再発)の3群に分類されている。91例全体の6カ月の無増悪生存割合は23.9%であった(B1:27.3%,B2:7.4%,B3:35.7%)。1年生存割合はB1,B2,B3グループそれぞれ27.3%,14.8%と28.6%であった。Grade3以上の有害事象は悪心・嘔吐(6.7%),疲労感(5.8%)が観察された。この結果より,再発膠芽腫に対するTMZ 50 mg/m2/日の連続投与は,有害事象も限定的であり,維持療法早期の再発例や,TMZが一度有効性を示し,かつTMZ無治療期間を有する症例では,治療選択肢の一つとなる可能性が示唆された18)(レベルⅡa)。
以上より,TMZの総投与量を増量する治療法が再発膠芽腫において生存期間を延長させる可能性を期待した臨床研究は現時点では肯定的なもの,否定的なもの,いずれも存在しており,今後の研究の展開が注目される。
[注意]
テモゾロミド(TMZ)1-week on/1-week off投与,3-week on/1-week off投与,連日投与:添付文書に記載された投与法・投与量以外の投与方法(適応外使用)
7.プラチナ製剤
Yungらは,1991年に再発悪性神経膠腫に対してカルボプラチン(CBCDA)単剤の治療の有効性を報告した。30例の再発悪性神経膠腫に対して,CBCDA 400~450 mg/m2を4週ごとに投与した。奏効割合は14%,無増悪期間中央値は26週であった。軽微な血小板減少と顆粒球減少は観察されたが,重篤な合併症はなかった。Grade3以上の骨髄抑制は約10%程度であった19)(レベルⅡa)。
再発悪性神経膠腫に対するCBCDAとエトポシド(VP-16)による併用化学療法を使用した第Ⅱ相試験には2つの報告がある。Jeremicらは,38例の再発悪性神経膠腫に対してCBCDA 300 mg/m2(3日間),VP-16 100 mg/m2(5日間)を4週間ごとに投与した。部分奏効(partial response:PR)21%,安定(stable disease:SD)32%,無増悪期間中央値は42.5週であった。Grade3以上の白血球減少は37%,血小板減少は42%に観察された20)(レベルⅡa)。また,Franceschiらは再発膠芽腫25例と再発退形成性星細胞腫5例,計30例に対して,放射線治療後に4週ごとに,3日間連続して1日あたりCBCDA 100 mg/m2とVP-16 120 mg/m2を投与した。6カ月無増悪生存割合が33.3%,無増悪期間中央値は4カ月,生存期間中央値は10カ月であった。Grade3/4の好中球減少を30例中13例(32.5%)に認めた21)(レベルⅡa)。
我が国でもAokiらにより低用量のICE〔イホスファミド(IFM)+CBCDA+VP-16〕療法の第Ⅱ相試験が行われている。1999年7月〜2005年3月に39例の再発膠芽腫が登録された。IFM(1,000 g/m2/日,第1,2,3治療日),CBCDA(110 mg/m2/日,第1治療日),VP-16(100 mg/m2/日,第1,2,3治療日)を6週間ごとに投与する化学療法を行った。Grade3/4の血液学的毒性は8%。臨床検査値の異常は12%に出現した。奏効割合25%,無増悪生存期間中央値は17週,6カ月,12カ月無増悪生存割合はそれぞれ39%と11%であった22)(レベルⅡa)。
プラチナ製剤を含んだ化学療法は再発悪性膠芽腫,再発悪性神経膠腫に一定の治療効果を示しているが,プロトコール構成薬剤が我が国では神経膠腫に対して適応がないこと,入院治療が必要になる場合が稀ならず存在することなどが,今後の対応課題である。
[注意]
カルボプラチン(CBCDA):適応外使用
エトポシド(VP-16):適応外使用
イホスファミド(IFM):適応外使用
|

|
| |
|
| 文献 |
| 1) |
Yung WK, Albright RE, Olson J, et al. A phase II study of temozolomide vs. procarbazine in patients with glioblastoma multiforme at first relapse. Br J Cancer. 2000;83(5):588-93.[PMID:10944597](レベルⅠb)
|
|
| 2) |
西川 亮,渋井壮一郎,丸野元彦,他.初回再発の退形成性星細胞腫患者に対するTemozolomide単剤投与の有効性および安全性の検討 多施設共同第Ⅱ相試験.癌と化療.2006;33(9):1279-85.(レベルⅡa)
|
|
| 3) |
Happold C, Roth P, Wick W, et al. ACNU-based chemotherapy for recurrent glioma in the temozolomide era. J Neurooncol. 2009;92(1):45-8.[PMID:18987781](レベルⅢ)
|
|
| 4) |
Wick W, Puduvalli VK, Chamberlain MC, et al. Phase III study of enzastaurin compared with lomustine in the treatment of recurrent intracranial glioblastoma. J Clin Oncol. 2010;28(7):1168-74.[PMID:20124186](レベルⅠb)
|
|
| 5) |
Yung WK, Prados M, Levin VA, et al. Intravenous recombinant interferon beta in patients with recurrent malignant gliomas:a phase I/II study. J Clin Oncol. 1991;9(11):1945-9.[PMID:1658242](レベルⅡa)
|
|
| 6) |
Wakabayashi T, Kayama T, Nishikawa R, et al. A multicenter phase I trial of combination therapy with interferon-beta and temozolomide for high-grade gliomas(INTEGRA study):the final report. J Neurooncol. 2011;104(2):573-7.[PMID:21327711](レベルⅡb)
|
|
| 7) |
Brem H, Piantadosi S, Burger PC, et al. Placebo-controlled trial of safety and efficacy of intraoperative controlled delivery by biodegradable polymers of chemotherapy for recurrent gliomas. The Polymer-brain Tumor Treatment Group. Lancet. 1995;345(8956):1008-12.[PMID:7723496](レベルⅠb)
|
|
| 8) |
De Bonis P, Anile C, Pompucci A, et al. Safety and efficacy of Gliadel wafers for newly diagnosed and recurrent glioblastoma. Acta Neurochir(Wien). 2012;154(8):1371-8.[PMID:22718138](レベルⅢ)
|
|
| 9) |
Vredenburgh JJ, Desjardins A, Herndon JE 2nd, et al. Bevacizumab plus irinotecan in recurrent glioblastoma multiforme. J Clin Oncol. 2007;25(30):4722-9.[PMID:17947719](レベルⅡa)
|
|
| 10) |
Vredenburgh JJ, Desjardins A, Herndon JE 2nd, et al. Phase II trial of bevacizumab and irinotecan in recurrent malignant glioma. Clin Cancer Res. 2007;13(4):1253-9.[PMID:17317837](レベルⅡa)
|
|
| 11) |
Friedman HS, Prados MD, Wen PY, et al. Bevacizumab alone and in combination with irinotecan in recurrent glioblastoma. J Clin Oncol. 2009;27(28):4733-40.[PMID:19720927](レベルⅡa)
|
|
| 12) |
Nagane M, Nishikawa R, Narita Y, et al. Phase II study of single-agent bevacizumab in Japanese patients with recurrent malignant glioma. Jpn J Clin Oncol. 2012;42(10):887-95.[PMID:22844129](レベルⅡa)
|
|
| 13) |
Iwamoto FM, Abrey LE, Beal K, et al. Patterns of relapse and prognosis after bevacizumab failure in recurrent glioblastoma. Neurology. 2009;73(15):1200-6.[PMID:19822869](レベルⅢ)
|
|
| 14) |
Yamasaki F, Kurisu K, Aoki T, et al. Advantages of high b-value diffusion-weighted imaging to diagnose pseudo-responses in patients with recurrent glioma after bevacizumab treatment. Eur J Radiol. 2012;81(10):2805-10.[PMID:22100373](レベルⅢ)
|
|
| 15) |
Tolcher AW, Gerson SL, Denis L, et al. Marked inactivation of O6-alkylguanine-DNA alkyltransferase activity with protracted temozolomide schedules. Br J Cancer. 2003;88(7):1004-11.[PMID:12671695](レベルⅡb)
|
|
| 16) |
Wick A, Felsberg J, Steinbach JP, et al. Efficacy and tolerability of temozolomide in an alternating weekly regimen in patients with recurrent glioma. J Clin Oncol. 2007;25(22):3357-61.[PMID:17664483](レベルⅡa)
|
|
| 17) |
Brada M, Stenning S, Gabe R, et al. Temozolomide versus procarbazine, lomustine, and vincristine in recurrent high-grade glioma. J Clin Oncol. 2010;28(30):4601-8.[PMID:20855843](レベルⅠb)
|
|
| 18) |
Perry JR, Bélanger K, Mason WP, et al. Phase II trial of continuous dose-intense temozolomide in recurrent malignant glioma:RESCUE study. J Clin Oncol. 2010;28(12):2051-7.[PMID:20308655](レベルⅡa)
|
|
| 19) |
Yung WK, Mechtler L, Gleason MJ. Intravenous carboplatin for recurrent malignant glioma:a phase II study. J Clin Oncol. 1991;9(5):860-4.[PMID:1849986](レベルⅡa)
|
|
| 20) |
Jeremic B, Grujicic D, Jevremovic S, et al. Carboplatin and etoposide chemotherapy regimen for recurrent malignant glioma:a phase II study. J Clin Oncol. 1992;10(7):1074-7.[PMID:1318951](レベルⅡa)
|
|
| 21) |
Franceschi E, Cavallo G, Scopece L, et al. Phase II trial of carboplatin and etoposide for patients with recurrent high-grade glioma. Br J Cancer. 2004;91(6):1038-44.[PMID:15305187](レベルⅡa)
|
|
| 22) |
Aoki T, Mizutani T, Nojima K, et al. Phase II study of ifosfamide, carboplatin, and etoposide in patients with a first recurrence of glioblastoma multiforme. J Neurosurg. 2010;112(1):50-6.[PMID:19538050](レベルⅡa)
|
|

|
| |
|
C 定位放射線照射
|

|
| |
|
推奨3
成人再発膠芽腫治療において局在した病変の制御を目的として,定位放射線照射を考慮してもよい。〔推奨度2C〕
|
|

|
| |
|
解説
|
| |
|
Combsらは,再発膠芽腫に対して定位手術的照射(SRS)を行った結果を報告した1)(レベルⅡb)。初期診断時32例の年齢中央値は56歳(33~76歳)であった。初回照射とSRSまでの期間中央値は10カ月で,SRSとして行われた線量中央値は,80%の等線量で15 Gy(範囲10~20 Gy)であった。化学療法の併用はなかった。Grade2以上の急性毒性はなく,放射線壊死を含む重篤な晩期毒性は観察されなかった。SRS後の全生存期間中央値は10カ月,無増悪生存期間中央値は7カ月であった1)(レベルⅡb)。
膠芽腫において,標準的放射線治療(60 Gy)が過去に施行されていたとしても,再発時には種々の放射線照射装置を用いた追加照射は可能である。しかし,再発膠芽腫に対するSRSあるいは定位放射線照射(STI)の前方視的なランダム化比較試験はこれまでに施行されておらず,大多数のデータは後方視的研究であり,さらにその適応が全身状態の良い患者,かつ小さな腫瘍径である場合に限定されているため2)(レベルⅢ),今後のランダム化比較試験を含めた詳細な検討が待たれるところである。
|

|
| |
|
| 文献 |
| 1) |
Combs SE, Widmer V, Thilmann C, et al. Stereotactic radiosurgery(SRS):treatment option for recurrent glioblastoma multiforme(GBM). Cancer. 2005;104(10):2168-73.[PMID:16220556](レベルⅡb)
|
|
| 2) |
Romanelli P, Conti A, Pontoriero A, et al. Role of stereotactic radiosurgery and fractionated stereotactic radiotherapy for the treatment of recurrent glioblastoma multiforme. Neurosurg Focus. 2009;27(6):E8.[PMID:19951061](レベルⅢ)
|
|

|

|
| 高齢者初発例への術後治療
|

|
| |
|
CQ7 高齢者初発膠芽腫に対して手術後どのような治療が推奨されるか?
|

|
| |
|
推奨1
高齢者においても,テモゾロミドを併用した化学放射線療法を考慮する。〔推奨度1B〕
|
|

|
| |
|
推奨2
高齢者における放射線治療では,線量の減量と照射期間の短縮を考慮する。〔推奨度1B〕
|
|

|
| |
|
推奨3
高齢者において,MGMT遺伝子プロモーター領域メチル化症例はテモゾロミド単独療法を考慮してもよい。〔推奨度2C〕
|
|

|
| |
|
推奨4
高齢者において,化学療法が困難な場合,放射線単独療法を考慮する。〔推奨度2C〕
|
|

|
| |
|
解説
|
| |
|
膠芽腫において,単独で最も検出力の高い予後因子は年齢である。米国Surveillance, Epidemiology, and End Resultsデータベースを用いた1993~2007年の膠芽腫19,674例の検討では,生存期間中央値は高齢になるにつれて著しく低下し,特にテモゾロミド(TMZ)使用開始前後での生存期間中央値の変化の検討では20~44歳群:13.5カ月→18.5カ月に延長が認められたのに対し,65~79歳群:5.5カ月→6.5カ月に留まった。さらに80歳以上の群では3.5カ月で生存期間の延長を認めなかった1)(レベルⅢ)。加えて,70歳以下の成人膠芽腫に対する標準治療を確立したStuppらの第Ⅲ相試験における副次的解析においても,患者が高齢になるほどハザード比(HR)が上昇,すなわちTMZの上乗せ効果が薄れることが示されている2,3)(いずれもレベルⅠb)。
これらの状況を踏まえ,高齢者初発膠芽腫・悪性神経膠腫の治療を考えるうえで示唆に富む臨床研究がなされている。
70歳以上の初発退形成性星細胞腫または膠芽腫でKPS70%以上の85例において放射線治療(50 Gy,1.8 Gy/日)とbest supportive care(BSC)を比較する第Ⅲ相試験が行われている。85例の年齢中央値は73歳(範囲70~85歳)であった。中間解析において放射線治療群の優越性が明らかとなったため,試験が中止となった。生存期間中央値はそれぞれBSC群が16.9週,放射線治療群が29.1週であった(HR=0.47,95%CI:0.29-0.76,p=0.002)4)(レベルⅠb)。また,60歳以上の初発膠芽腫100例を対象とした標準照射法60 Gy/30回に対する短期照射法40 Gy/15回の非劣性を検討するランダム化比較試験では,6カ月生存割合,全生存期間ともに短期照射法の標準照射法に対する非劣性が証明された(HR=0.89,95%CI:0.59-1.36,p=0.57)。全生存期間中央値はそれぞれ5.1カ月と5.6カ月,6カ月生存割合は,それぞれ44.7%,41.7%であった5)(レベルⅠb)。後年,限られた医療資源のなかで,高齢者・フレイル患者への放射線照射期間のさらなる短縮が有力な治療選択肢となり得るかを示すため,50歳以上かつKPS 50~70%および65歳以上かつKPS 50%以上の膠芽腫98例を対象にした国際多施設共同ランダム化比較試験が行われた。全生存期間中央値は25 Gy/5回で7.9カ月(95%CI:6.3-9.6)に対し,40 Gy/15回で6.4カ月(95%CI:5.1-7.6)で同等の結果(p=0.988)で,無増悪生存期間・QOLについても有意差を認めず,標準照射40 Gy/15回に対する短期照射25 Gy/5回の非劣性が示された6)(レベルⅠb)。本研究の副次的解析として,65歳以上の高齢者61例に対象を絞った検討が行われている。対象となった患者の約70%が PS 2,3に相当(25 Gy/5回群の69%,40 Gy/15回群の63%がKPS 50~70%)し,両群ともにTMZ投与は行われていない。結果は母研究と同様であり,全生存期間中央値は25 Gy/5回:6.8カ月(95%CI:4.5-9.1)および40 Gy/15回:6.2カ月(95%CI:4.7-7.7)で明らかな差を認めなかった。KPS低値(50~70%)の群においても,生存期間・QOLについて両群に明らかな差を認めなかった。高齢者において,超短期照射25 Gy/5回は標準照射40 Gy/15回に対して非劣性であることが示され,65歳以上の高齢者,とりわけ全身状態不良やTMZ投与が困難な患者において,さらなる照射期間の短縮が治療選択肢となり得ることが示された7)(レベルⅢ)。
Brandesらは,65歳以上の初発膠芽腫79例に対して放射線単独治療(59.4 Gy/33回,1.8 Gy/日)(1993~1995年),同放射線治療後PCV〔プロカルバジン(PCZ),lomustine,ビンクリスチン(VCR)〕維持化学療法(1995~1997年),および同放射線治療後TMZ維持化学療法(150 mg/m2/日,5-day on/23-day off)(1997~2000年)の3群に分け,3群の治療成績を比較する第Ⅱ相試験を行っている8)(レベルⅡb)。その結果,3群の全生存期間はそれぞれ11.2カ月(95%CI:9.43-13.35),12.7カ月(95%CI:11.2-18.74)14.9カ月(95%CI:13.37-24.35)となり,放射線治療後TMZ維持化学療法群は放射線単独治療群と比較して有意な優越性が認められた。通常放射線治療後にTMZ維持化学療法を行うことが高齢者において有効である可能性が示された。
ドイツのNeuro-oncology Working GroupによるNOA-08試験は,2005~2009年の期間において,KPSが60%以上で,65歳以上の退形成性星細胞腫または膠芽腫412例(膠芽腫が約9割を占める)に対して,放射線治療(54~60 Gy)群に対する用量強化TMZ(1日投与量100 mg/m2,1-week on/1-week off)群の非劣性を検証する第Ⅲ相ランダム化比較試験である。主要評価項目は全生存期間とし,非劣性マージンは25%とした。全生存期間中央値は,放射線治療群9.6カ月(95%CI:8.2-10.8),TMZ群8.6カ月(95%CI:7.3-10.2)(HR=1.09,95%CI:0.84-1.41,p=0.033)で,有害事象も許容できる範囲であったため,TMZ単独投与治療の非劣性が示された9)(レベルⅠb)。さらにはMGMT遺伝子プロモーター領域のメチル化症例においてTMZ単独投与治療は選択肢の一つとなり得ることが示された。しかし,逆にMGMT遺伝子プロモーター領域非メチル化症例においてTMZ単独投与治療は放射線単独治療より全生存期間,無イベント生存期間が有意に短縮する傾向になることも判明し,採取組織のMGMT遺伝子プロモーター領域のメチル化測定を行わない場合には,TMZ単独投与をしないことを推奨する9)(レベルⅠb)。
Nordic研究は,60歳以上の初発膠芽腫342例に対して,放射線治療(60 Gy,1回2 Gy,6週間)群(100例)を標準治療とし,短期照射(34 Gy,1回3.4 Gy,2週間)群(123例),TMZ(200 mg/m2/日,5-day on/23-day off)による6サイクルの化学療法群(119例)の試験治療,それぞれの優越性を検証するランダム化第Ⅲ相試験である10)(レベルⅠb)。全生存期間を主要評価項目とした。3群の全生存期間中央値は,それぞれ6カ月(95%CI:5.1-6.8),7.5カ月(95%CI:6.5-8.6),8.3カ月(95%CI:7.1-9.5)であり,TMZ群は標準放射線治療群に対して有意な生存期間の延長を示したが(HR=0.70,95%CI:0.52-0.93,p=0.01),短期照射群は標準的放射線治療群に比較して有意な生存期間延長を示すことはできなかった(HR=0.85,95%CI:0.64-1.12,p=0.24)。70歳以上に限定すれば標準放射線治療群に比べて短期照射群,TMZ群はそれぞれ有意に生存期間の延長が認められた(短期照射群HR=0.59,95%CI:0.37-0.93,p=0.02,TMZ群HR=0.35,95%CI:0.21-0.56,p<0.0001)。また70歳以上の患者において短期照射群とTMZ群の間には全生存割合において有意差は観察されなかった(HR=0.72,95%CI:0.50-1.05,p=0.09)。TMZ群においてMGMT遺伝子プロモーター領域メチル化症例は非メチル化症例に比べて生存期間の延長が観察されたが(HR=0.56,95%CI:0.34-0.93,p=0.02),標準あるいは短期照射群全体のなかではMGMT遺伝子プロモーター領域メチル化は生命予後に影響を与えなかった。TMZ群ではGrade3/4の好中球減少(12例),血小板減少(18例)が観察されており,高齢者ではよりきめ細かい治療管理が要求されることを示唆している。
Canadian Cancer Trials Group(CCTG)とEuropean Organization for Research and Treatment of Cancer(EORTC)の共同研究で,短期照射を標準治療群とし短期照射時にTMZ連日併用投与に加えて終了後6サイクルのTMZ維持化学療法を行う治療群のランダム化第Ⅲ相試験が行われた。65歳以上の膠芽腫562例について,放射線単独治療(40 Gy/15回)と放射線+TMZ併用投与(40 Gy/15回,75 mg/m2)を281例ずつ割り付けた。全生存期間を主要評価項目とした。全生存期間中央値は放射線単独群7.6カ月・TMZ併用群9.3カ月(HR=0.67,95%CI:0.56-0.80,p<0.001)で,短期照射にTMZを併用する化学放射線療法の有効性が確認された。また,年齢層別の全生存期間中央値については,65~70歳:放射線単独群8.3カ月・TMZ併用群8.7カ月(HR=0.93,95%CI:0.68-1.27)であるのに対し,71~75歳:放射線単独群7.6カ月・TMZ併用群9.3カ月(HR=0.63,95%CI:0.48-0.83),76歳以上:放射線単独群7.1カ月・TMZ併用群10.0カ月(HR=0.53,95%CI:0.38-0.73)で,より高齢の群での短期照射・TMZ併用療法の有益性が見出された。本研究の結果からは,70歳が短期照射+TMZ併用療法の恩恵を受ける一つの線引きであるように推察された。特にMGMT遺伝子プロモーター領域メチル化を示す例では,放射線単独群7.7カ月・TMZ併用群13.5カ月(HR=0.53,95%CI:0.38-0.73,p<0.001)で,全生存期間の延長が顕著であった。一方,MGMT遺伝子プロモーター領域非メチル化例でも生存期間中央値は放射線単独群7.9カ月・TMZ併用群:10.0カ月(HR= 0.75,95%CI:0.56-1.01,p<0.055)で統計学的有意差は認められないながらも,臨床的には意義深い生存予後延長が観察された。ただし,本研究は神経症状が比較的軽い群が対象であり,全身状態不良例に対する治療については課題として残されている11)(レベルⅠb)。
以上の試験を総括すると,高齢者の初発膠芽腫においては,生存期間延長の観点からは術後放射線治療を考慮することが重要であり,全身状態の良い患者では放射線治療および化学療法が考慮される。放射線治療は60 Gy/30回/6週間の通常の照射法に比べて,高齢者においては短期照射(34 Gy/10回/2週間,40 Gy/15回/3週間など)が有望である。手術後,採取組織のMGMT遺伝子プロモーター領域のメチル化を検討し,メチル化症例では,短期照射・TMZ併用療法が有効な治療選択肢である。メチル化症例では,TMZ単独治療も選択肢となり得るが,短期照射・TMZ併用療法とTMZ単独治療のランダム化第Ⅲ相試験による比較はなされていない。非メチル化症例でも併用療法が有効である可能性があるが,TMZ単独療法の有効性は乏しい。化学療法が困難な場合,放射線単独療法は選択肢の一つである。
[注意]
テモゾロミド(TMZ)1-week on/1-week off投与:添付文書に記載された投与法・投与量以外の投与方法(適応外使用)
MGMT遺伝子プロモーター領域のメチル化測定:保険適用となっていない検査法
|

|
| |
|
| 文献 |
| 1) |
Darefsky AS, King JT Jr, Dubrow R. Adult glioblastoma multiforme survival in the temozolomide era:a population-based analysis of Surveillance, Epidemiology, and End Results registries. Cancer. 2012;118(8):2163—72.[PMID:21882183](レベルⅢ)
|
|
| 2) |
Stupp R, Mason WP, van den Bent MJ, et al. European Organisation for Research and Treatment of Cancer Brain Tumor and Radiotherapy Groups;National Cancer Institute of Canada Clinical Trials Group. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med. 2005;352(10):987—96.[PMID:15758009](レベルⅠb)
|
|
| 3) |
Stupp R, Hegi ME, Mason WP, et al. European Organisation for Research and Treatment of Cancer Brain Tumour and Radiation Oncology Groups;National Cancer Institute of Canada Clinical Trials Group. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study:5-year analysis of the EORTC-NCIC trial. Lancet Oncol. 2009;10(5):459—66.[PMID:19269895](レベルⅠb)
|
|
| 4) |
Keime-Guibert F, Chinot O, Taillandier L, et al. Radiotherapy for glioblastoma in the elderly. N Engl J Med. 2007;356(15):1527—35.[PMID:17429084](レベルⅠb)
|
|
| 5) |
Roa W, Brasher PM, Bauman G, et al. Abbreviated course of radiation therapy in older patients with glioblastoma multiforme:a prospective randomized clinical trial. J Clin Oncol. 2004;22(9):1583—8.[PMID:15051755](レベルⅠb)
|
|
| 6) |
Roa W, Kepka L, Kumar N, et al. International Atomic Energy Agency randomized phase III study of radiation therapy in elderly and/or frail patients with newly diagnosed glioblastoma multiforme. J Clin Oncol. 2015;33(35):4145—50.[PMID:26392096](レベルⅠb)
|
|
| 7) |
Guedes de Castro D, Matiello J, Roa W, et al. Survival outcomes with short-course radiation therapy in elderly patients with glioblastoma:Data from a randomized phase 3 Trial. Int J Radiat Oncol Biol Phys. 2017;98(4):931—8.[PMID:28602417](レベルⅢ)
|
|
| 8) |
Brandes AA, Vastola F, Basso U, et al. A prospective study on glioblastoma in the elderly. Cancer. 2003;97(3):657—62.[PMID:12548608](レベルⅡb)
|
|
| 9) |
Wick W, Platten M, Meisner C, et al. Temozolomide chemotherapy alone versus radiotherapy alone for malignant astrocytoma in the elderly:the NOA-08 randomised, phase 3 trial. The Lancet Oncology. 2012;13(7):707—15.[PMID:22578793](レベルⅠb)
|
|
| 10) |
Malmström A, Grønberg BH, Marosi C, et al. Temozolomide versus standard 6-week radiotherapy versus hypofractionated radiotherapy in patients older than 60 years with glioblastoma:the Nordic randomised, phase 3 trial. Lancet Oncol. 2012;13(9):916—26.[PMID:22877848](レベルⅠb)
|
|
| 11) |
Perry JR, Laperriere N, O’Callaghan CJ, et al. Short-course radiation plus temozolomide in elderly patients with glioblastoma. N Engl J Med. 2017;376(11):1027—37.[PMID:28296618](レベルⅠb)
|
|

|

|

|
|

|
| |

|
|

|
|

|
|

|
|



