
|
| (2) 成人Grade II・IIIびまん性神経膠腫診療アルゴリズム
|

|
| |

|

|
| (3) 略語一覧
|

|
| |
| AA |
anaplastic astrocytoma |
退形成性星細胞腫 |
| ACNU |
nimustine |
ニムスチン |
| ADL |
activities of daily living |
日常生活動作 |
| AOA |
anaplastic oligoastrocytoma |
退形成性乏突起星細胞腫 |
| AO |
anaplastic oligodendroglioma |
退形成性乏突起膠腫 |
| BCNU |
carmustine |
カルムスチン |
| Bev |
bevacizumab |
ベバシズマブ |
| BSC |
best supportive care |
|
| CCNU |
lomustine |
|
| CIMP |
CpG island methylator phenotype |
CpGアイランドメチル化形質 |
| CR |
complete response |
完全奏効 |
| CTV |
clinical target volume |
臨床標的体積 |
| DA |
diffuse astrocytoma |
びまん性星細胞腫 |
| EANO |
European Association for Neuro-Oncology |
|
| EOR |
extent of resection |
摘出率 |
| EORTC |
European Organisation for Research and Treatment of Cancer |
|
| FDG |
fluorodeoxyglucose |
|
| GBM |
glioblastoma |
膠芽腫 |
| GTR |
gross total resection |
肉眼的全摘 |
| HGG |
high-grade glioma |
高悪性度神経膠腫 |
| HR |
hazard ratio |
ハザード比 |
| IDH |
isocitrate dehydrogenase |
イソクエン酸脱水素酵素 |
| IMRT |
intensity modulated radiation therapy |
強度変調放射線治療 |
| KPS |
Karnofsky performance status |
|
| LGG |
low-grade glioma |
低悪性度神経膠腫 |
| MGMT |
O6-methylguanine -DNA methyltransferase |
O6-メチルグアニンDNAメチル基転移酵素 |
| MMR |
mismatch repair |
ミスマッチ修復機構 |
| MMSE |
Mini Mental State Examination |
|
| MRI |
magnetic resonance imaging |
|
| NOS |
not otherwise specified |
未確定 |
| NR |
not reached |
未到達 |
| OA |
oligoastrocytoma |
乏突起星細胞腫 |
| OL |
oligodendroglioma |
乏突起膠腫 |
| OS |
overall survival |
全生存期間/割合 |
| PD |
progressive disease |
増悪 |
| PET |
positron emission tomography |
陽電子放射断層撮影 |
| PFS |
progression free survival |
無増悪生存期間/割合 |
| PR |
partial resection or partial reseponse |
部分摘出あるいは部分奏効 |
| PS |
performance status |
|
| QOL |
quality of life |
生活の質 |
| RT |
radiotherapy |
放射線療法 |
| RTOG |
Radiation Therapy Oncology Group |
|
| SD |
stable disease |
安定 |
| STR |
subtotal resection |
亜全摘 |
| TERT |
telomerase reverse transcriptase |
テロメラーゼ逆転写酵素 |
| TMZ |
temozolomide |
テモゾロミド |
| T/N |
tumor-to-normal cortex |
|
| TTF |
time to treatment failure |
治療成功期間 |
| TTP |
time to progression |
無増悪期間 |
| VEGF |
vascular endothelial growth factor |
血管内皮細胞増殖因子 |
| 3D-CRT |
3-dimensional conformal radiotherapy |
三次元原体照射 |
| 5-ALA |
5-aminolevulinic acid |
5-アミノレブリン酸 |
|

|
|

|
| (4) 作成組織・作成経過
|

|
| 1. 作成組織
|

|
| |
1.1.作成主体
|
| |
|
共通項目参照
|

|
| |
1.2.成人Grade II・III神経膠腫診療ガイドライン作成グループ(作成時)
|
| |
| 役 割 |
名 前 |
所 属 |
| Grade II委員長 |
成田善孝 |
国立がん研究センター中央病院 脳脊髄腫瘍科/脳神経外科 |
Grade III委員長 |
植木敬介 |
獨協医科大学医学部 脳神経外科/脳神経外科 |
| 委員 |
櫻田香 |
山形大学医学部看護学科・基礎看護学講座 |
| 委員 |
高橋雅道 |
国立がん研究センター中央病院 脳脊髄腫瘍科/脳神経外科 |
| 委員 |
村垣善浩 |
東京女子医科大学大学 先端生命医科学研究所/脳神経外科 |
| 委員 |
宇塚岳夫 |
獨協医科大学医学部 脳神経外科/脳神経外科 |
| 委員 |
上羽哲也 |
高知大学医学部 脳神経外科/脳神経外科 |
| 委員 |
井垣浩 |
国立がん研究センター中央病院 放射線治療科/放射線治療 |
| 委員 |
佐々木光 |
慶應義塾大学医学部 脳神経外科/脳神経外科 |
| 委員 |
大野誠 |
国立がん研究センター中央病院 脳脊髄腫瘍科/脳神経外科 |
| 委員 |
永根基雄 |
杏林大学医学部 脳神経外科/脳神経外科 |
| 委員 |
廣瀬雄一 |
藤田医科大学医学部 脳神経外科/脳神経外科 |
| 委員 |
竹島秀雄 |
宮崎大学医学部 脳神経外科/脳神経外科 |
| 委員 |
中洲敏 |
草津総合病院 脳神経外科/脳神経外科 |
| 委員 |
中洲庸子 |
滋賀医科大学医学部 脳神経外科/脳神経外科 |
| 委員 |
青木友和 |
京都医療センター 脳神経外科/脳神経外科 |
| 委員 |
夏目敦至 |
名古屋大学医学部 脳神経外科/脳神経外科 |
| 委員 |
西川亮 |
埼玉医科大学国際医療センター 脳脊髄腫瘍科/脳神経外科 |
| 委員 |
隈部俊宏 |
北里大学医学部 脳神経外科/脳神経外科 |
| 委員 |
杉山一彦 |
広島大学病院 がん化学療法科/脳神経外科 |
|

|
| |
1.3.システマティックレビュー委員
|
| |
| 役 割 |
名 前 |
所 属 |
| SR委員 |
新田雅之 |
東京女子医科大学 脳神経外科/脳神経外科 |
| SR委員 |
島聖 |
国立がん研究センター中央病院 放射線治療科/放射線治療 |
| SR委員 |
深田淳一 |
慶應義塾大学医学部 放射線科/放射線治療 |
| SR委員 |
金井隆一 |
永寿総合病院 脳神経外科/脳神経外科 |
| SR委員 |
島田大輔 |
杏林大学医学部 脳神経外科/脳神経外科 |
| SR委員 |
久米賢 |
杏林大学医学部 脳神経外科/脳神経外科 |
| SR委員 |
永石雅也 |
獨協医科大学埼玉医療センター 脳神経外科 |
| SR委員 |
樋口芙未 |
獨協医科大学 脳神経外科/脳神経外科 |
| SR委員 |
大谷亮平 |
東京都立駒込病院 脳神経外科/脳神経外科 |
| SR委員 |
田村郁 |
東京医科歯科大学 脳神経外科/脳神経外科 |
| SR委員 |
松谷智郎 |
千葉大学医学部 脳神経外科/脳神経外科 |
| SR委員 |
沖田典子 |
大阪国際がんセンター 脳神経外科/脳神経外科 |
| SR委員 |
渡邉孝 |
宮崎大学医学部 脳神経外科/脳神経外科 |
| SR委員 |
山下真治 |
宮崎大学医学部 脳神経外科/脳神経外科 |
| SR委員 |
横上聖貴 |
宮崎大学医学部 脳神経外科/脳神経外科 |
| SR委員 |
深見忠輝 |
滋賀医科大学医学部 脳神経外科/脳神経外科 |
| SR委員 |
新田直樹 |
滋賀医科大学医学部 脳神経外科/脳神経外科 |
| SR委員 |
三矢幸一 |
静岡がんセンター 脳神経外科 |
| SR委員 |
古瀬元雅 |
大阪医科大学 脳神経外科 |
|

|
| |
付票:診療ガイドライン作成グループ(WG)委員とシステマティックレビュー担当
|
| |
| CQ |
課題名 |
課題責任者 |
SR |
SR |
SR |
| |
総論
画像診断 |
植木敬介
成田善孝 |
|
|
|
| 1 |
手術 Grade II |
櫻田香
高橋雅道 |
成田善孝 |
櫻田香 |
高橋雅道 |
| 手術 Grade III |
村垣善浩 |
新田雅之 |
|
|
| 2 |
カルムスチン徐放性ポリマーの留置 |
宇塚岳夫
上羽哲也 |
樋口芙未 |
大谷亮平 |
成田善孝 |
| 3 |
放射線治療 Grade II |
井垣浩 |
成田善孝 |
島聖 |
|
| 放射線治療 Grade III |
佐々木光 |
深田淳一 |
金井隆一 |
|
| 4 |
化学療法 Grade II |
永根基雄 |
島田大輔 |
久米賢 |
|
| 化学療法 Grade III |
植木敬介 |
永石雅也 |
田村郁 |
松谷智郎 |
| 5 |
経過観察 Grade II |
廣瀬雄一 |
成田善孝 |
沖田典子 |
|
| 経過観察 Grade III |
竹島秀雄 |
渡邉孝 |
山下真治 |
横上聖貴 |
| 6 |
神経症状への対応 |
中洲敏
中洲庸子 |
深見忠輝 |
新田直樹 |
三矢幸一 |
| 7 |
再発治療 |
青木友和
大野誠 |
古瀬元雅 |
成田善孝 |
大野誠 |
| |
ガイドライン内の整合性 |
夏目敦至 |
|
|
|
| |
他のガイドラインとの整合性 |
隈部俊宏
杉山一彦 |
|
|
|
|
|

|
|
| 2.作成過程
|

|
| |
1) 作成方針
|
| |
|
成人Grade II・III神経膠腫に対するエビデンスを整理し,診療アルゴリズムと診療ガイドラインを示すことによって,成人Grade II・III神経膠腫患者の生命予後と機能予後の改善を目的とする。
|

|
| |
2) 使用上の注意
|
| |
|
(1) |
共通項目参照
|
| |
|
(2) |
本ガイドラインはWHO2007分類に基づく臨床試験結果などのエビデンスをもとに作成されている。
|
| |
|
(3) |
これまでに行われた臨床試験結果の遺伝子解析・手術摘出率・KPSなどの予後因子解析は主解析ではなく、臨床試験参加者を改めて対象とした2次的解析であり、WHO 2016分類にて規定された分子マーカーが付加した統合診断に対応する個別腫瘍型ごとの推奨治療法については、現時点では高いエビデンスが得られていない。
|
| |
|
(4) |
WHO2016分類に基づく治療方針のガイドラインはEANO などが公表している。
文献
1) Weller M, van den Bent M, Tonn JC, et al; European Association for Neuro-Oncology
(EANO) Task Force on Gliomas. European Association for Neuro-Oncology (EANO) guideline on the diagnosis and treatment of adult astrocytic and oligodendroglial gliomas. Lancet Oncol. 2017;18(6):e315-e329. [PMID: 28483413]
|

|
| |
3) 利益相反
|
| |
|
共通項目参照
|

|
| |
4) 作成資金
|
| |
|
共通項目参照
|

|
| |
5) 組織編成
|
| |
|
ガイドライン統括委員会:ガイドライン作成を統括する脳腫瘍診療拡大ガイドライン委員会は、2009年11月に日本脳腫瘍学会の内部組織として設置され、当時の理事と協力委員2名で構成された。その後、日本脳腫瘍学会の新理事が委員として加わった。また、対象疾患ごとに関連学会から協力委員の参加を得ている。
ガイドライン作成グループ:脳腫瘍診療拡大ガイドライン委員会から選出された20名にて構成されている。本ガイドラインは当初Grade別に独立したガイドライン作成を意図し、作成グループを構成したが、疾患概念として両者を弁別することは合理性を欠くと判断し、2つの作成グループを融合し、統一した。
システマティックレビューチーム:重要臨床課題ごとに作成グループ構成員がシステマティックレビュー(SR)チームのリーダーとなり、リーダーよりSR委員を選出してもらい、各課題3~6名でSRチーム編成した。神経膠腫が希少疾患であることを踏まえて、各チーム必ず1名以上のガイドライン委員が兼任することとした。
|

|
| |
6) 作成過程
|
| |
|
(1) |
準備:2014年11月30日の脳腫瘍診療拡大ガイドライン委員会で、Grade II神経膠腫およびGrade III神経膠腫のガイドライン作成グループが発足した。当初は別々にガイドラインを作成することにしていたが、Grade IIとGrade III神経膠腫の明確な線引きがあいまいで共通の課題も多く、スコープを作成する過程で、Grade II・III神経膠腫を一つのガイドラインとして治療方針を提示することが、より臨床的に有用と判断して、合同のガイドライン委員会を結成した。若干の課題については委員の追加を行った。
|
| |
|
(2) |
スコープ:ドラフトを作成し、メールでの回覧・討議を行い、改変を繰り返して完成し、委員全体にメールで回覧し意見を募った。
|
| |
|
(3) |
システマティックレビュー:Minds「診療ガイドライン作成の手引き 2014」に準拠した方法により2015年に開始した。当初はWHO2007分類に基づく臨床試験結果などのエビデンスをもとにレビューを行ったが、2016年に分子マーカーに基づくWHO 2016診断を考慮して文献検索をすすめ、最終的に2019年11月末までの文献レビューに基づきガイドラインを作成した。 オンライン会議を重ね、2020年11月末に委員会案を完成させた。
|
| |
|
(4) |
推奨作成とその決定
共通項目参照
付記:2021年5月に推奨文についてあらためて見直し、「~を推奨する」「~を提案する」だけでは、委員会案の意味が十分に伝わらない可能性があるため、一部は「~をしてもよい」といった表現を使用することを確認した。
最終的に2021年7月8日の脳腫瘍診療拡大ガイドライン委員会(メール審議)にて参加委員全員の投票により承認。
|
| |
|
(5) |
公開:2021年8月ホームページ上に公開し、各関連学会からの意見およびパブリックコメントを求めた。
|
| |
|
(6) |
2022年4月 修正版作成
|
| |
7) 推奨の強さ・エビデンスレベル・推奨度(臨床的意義)について
|
| |
|
共通項目参照
|
| |
8) 推奨の強さ・エビデンスレベル・推奨度(臨床的意義)について
|
| |
|
外部評価を求めた団体・委員
|

|
|
| 3.公開後の取り組み
|

|
| |
共通項目参照
|

|
|
| 4.脳腫瘍診療ガイドライン拡大委員会(ガイドライン統括委員会)構成委員
|

|
| |
共通項目参照
|

|
|
| 5.日本脳腫瘍学会 脳腫瘍診療ガイドライン作成事務局
|

|
| |
共通項目参照
|
|

|
| (5) スコープ
|

|
| 1. 成人Grade II・III びまん性神経膠腫の基本的特徴
|

|
| |
1) 成人Grade II・III びまん性神経膠腫の概括
|
| |
びまん性神経膠腫は脳実質内にびまん性、浸潤性に発育する、神経膠細胞(グリア細胞)由来と考えられている腫瘍で、主に成人の大脳半球に発生する1)。
(1) 疾患の病因:
通常の症例で特定されている外的因子はない。特殊な例として他の脳腫瘍等に対する放射線照射後にそれが誘因となって発生すると考えられる放射線誘発神経膠腫(radiation-induced glioma)が知られている。腫瘍発生母体細胞に起こる遺伝子異常の集積によって発生すると考えられ、稀に家族性遺伝性疾患の一部として発生する場合もある。 (2) 疾患の病態生理:
通常中枢神経系内での増殖にとどまり、頭蓋外転移は極めて稀である。画像上比較的境界鮮明にみえることもあるが、特に増殖中心から離れた周辺部では浸潤性の発育をし、腫瘍塊としての圧迫症状に加えて、浸潤部位の脳機能障害、てんかん発作を症状として惹き起こす。様々な時間経過で悪性度が進行し、頭蓋内圧亢進や腫瘍浸潤により生命維持に関わる脳機能の障害を起こして患者を死に至らしめる。
(3) 画像所見:
MRIにおいてGrade II・III神経膠腫の病変はT1強調画像では低信号(T1 hypointense)、T2強調画像では高信号(T2 hyperintense)を示す、多くの場合境界不鮮明な脳実質性病変として描出される。T2 高信号領域はFLAIR画像にて最も容易に把握できる。T2 高信号領域は、特に乏突起膠腫では大脳皮質表面を含むことが多く、深部では腫瘍細胞の浸潤を反映して白質線維の走行に沿うような形状を呈する。腫瘍細胞はMRIの異常部分を超えて浸潤していることがほとんどであることも示されている。Grade IIではガドリニウム(Gd-DTPA)によって造影増強される部分がみられることはほとんどないが、Grade IIIの場合は少なくとも部分的に造影増強を示すことが多い。乏突起膠腫は嚢胞性変化を伴う傾向がある2)。乏突起膠腫はCT上石灰化を伴う頻度が高い(35-80%)。
FDG-PET検査では、星細胞腫は低集積 (low uptake)であることが多く、Grade IIIになるとやや集積度が高くなる。乏突起膠腫/退形成性乏突起膠腫においては11C-methionine-PETでほぼ例外なく高集積(high uptake)になる。
この他にもさまざまな画像診断が試みられているが、確定診断は摘出腫瘍の組織診断によらなければならない。
|

|
| |
2) 疫学的事項
|
| |
現在の世界標準である診断基準は2016年に第4版のupdateという形で改訂されたWHO分類(WHO2016)であるが3)、脳腫瘍全国集計調査報告を含めて、過去の疫学的調査はほとんどそれ以前の診断基準に基づいており、今後新しい診断基準の浸透に伴って、各腫瘍の生存割合、頻度などは変化してくる可能性は高い。
脳腫瘍全国集計調査報告2005-2008はWHO2007分類に従って報告されている。原発性脳腫瘍における割合は、Grade II神経膠腫は4.8% [diffuse astrocytoma (DA) 2.5%, oligodendroglioma/ oligoastrocytoma(OL/OA) 2.3%、Grade III 神経膠腫は5.8% (anaplastic astrocytoma (AA) 3.3%, anaplastic oligodendroglioma / anaplastic oligoastrocytoma (AO/AOA) 2.5%] と報告されている。平均の発生年齢は、DA 38.0歳、OL/OA 41.0歳、AA 49. 0歳、AO/AOA 53.0歳と膠芽腫(Glioblastoma (GBM))の62.0歳に比して若い。予後は組織型で異なり、5年生存割合はDA 76.9%、OL/OA 91.9%、AA 43.2%、AO/AOA 62.6%と報告されている4)。
2016年の全国がん登録調査によると、グリオーマなどの神経上皮腫瘍が1年間に4,621人登録されていた。DAは399人、AAが414人、GBMが2,073人であった。OLが181人、AOが149人で、OA/AOAが101人であった。詳細不明のグリオーマが612人であった。
|

|
| |
3) 疾患の臨床分類と病理診断
|
| |
脳腫瘍の分類と診断は1926年に発表されたCushing-Baileyの病理組織所見による分類が基礎となっており、それ以来、組織形態学による分類と診断が行われてきた。これは、組織形態が臨床経過とよく相関していることに基づいている。
脳腫瘍におけるGrade、すなわち組織学的悪性度、の考え方は、最初に1952年にKernohan-Seyre によって提唱された。手術摘出のみで治療した場合の予後を指標として、それぞれの組織診断名にIからIVまでの悪性度を付与したものである。このような組織学的な所見のみに基づくGrade付与は、脳腫瘍以外には行われていないが、臨床的な有用性が高いため世界的なコンセンサスを得て、その後、世界標準であるWHO分類に引き継がれて今日に至っている。ここで取り扱うGrade II・IIIびまん性神経膠腫もWHO分類に準拠して組織学的な悪性度に基づいて診断される。
一方、脳腫瘍の病理・病態について分子レベル、遺伝子レベルでの研究が進んだ結果、WHO2016分類では多くの腫瘍で、その定義に遺伝子異常の記載が含まれた3)。これは、特定の腫瘍群においては組織形態のみでの診断よりも分子/遺伝子情報を加えた方がより正確に臨床経過を推定できることが明らかになったためである。本ガイドラインの対象であるGrade II・IIIのびまん性神経膠腫はその代表的なもので、診断に際してそのような遺伝子異常の有無を検索することが必要になった。本ガイドラインの対象となるWHO2016分類におけるGrade II・III神経膠腫は以下の腫瘍である。ここで分類に大きな意味を持つ遺伝子異常はIDH変異と染色体1番単腕(1p)、19番長腕(19q)の共欠失(1p/19q-codeleted)であることに留意されたい。
|

|
| |
|
WHO Grade II
|
| |
|
1) |
びまん性星細胞腫,IDH変異 (IDH-mutant)
|
| |
|
2) |
乏突起膠腫,IDH変異および1p/19q 共欠失 (IDH-mutant and 1p/19q-codeleted)
|
| |
|
3) |
びまん性星細胞腫,IDH野生型 (IDH-wildtype) *
|
| |
|
4) |
びまん性星細胞腫,詳細未確定(NOS: not otherwise specified)
|
| |
|
5) |
乏突起膠腫,詳細未確定(NOS)
|
| |
|
6) |
乏突起星細胞腫瘍,詳細未確定(NOS)
|

|
| |
*びまん性星細胞腫,IDH野生型 (IDH-wildtype)について
|
| |
WHO2016分類ではGrade II となっているが、実際にはより悪性の経過をたどる様々な病態を含む、不均一な集団と考えられるために、暫定的診断名として取り扱われている。この診断名に相当する腫瘍についての臨床的判断は、本ガイドラインによらず、個々の症例の状況によって判断される方が適切である。
|

|
| |
|
WHO Grade III
|
| |
|
1) |
退形成性びまん性星細胞腫,IDH変異 (IDH-mutant)
|
| |
|
2) |
退形成性乏突起膠腫,IDH変異型および1p/19q 共欠失 (IDH-mutant and 1p/19q-codeleted)
|
| |
|
3) |
退形成性びまん性星細胞腫,IDH野生型(IDH-wildtype)
|
| |
|
4) |
退形成性びまん性星細胞腫,詳細未確定(NOS)
|
| |
|
5) |
退形成性乏突起膠腫,詳細未確定(NOS)
|
| |
|
6) |
退形成性乏突起星細胞腫,詳細未確定(NOS)
|

|
| |
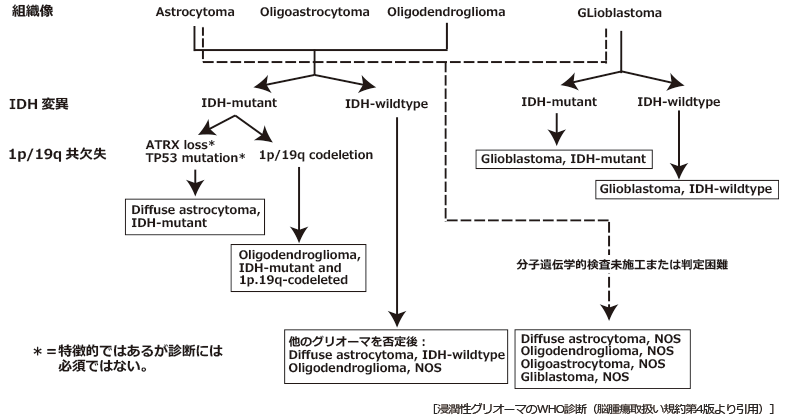
遺伝子異常の検索が行われなかった場合は組織形態診断のみの記述に続けてNOS: not otherwise specified (詳細未確定)という診断が付与され、いわば暫定的な診断名になる。診断の手順を図1にする。
|

|
| |
|
|
|
| |
|
|
図1 浸潤性グリオーマのWHO診断
The 2016 World Health Organization Classification of Tumorsof the Central Nervous System, IARCより改編
日本脳神経外科学会・日本病理学会.脳腫瘍取扱い規約第4版.2018.金原出版, p69より許諾を得て転載
|

|
| |
IDH変異(IDH-mutant)と1p/19q共欠失(1p/19q-codeleted)が診断基準に組み入れられたのは、この二つの遺伝子異常が臨床的に大きな意味を持つことが明確になってきたからである5)。
IDH変異は膠芽腫の5-10%程度に見られるが、それらはIDH変異のない膠芽腫より予後が良く、そのほとんどがGrade II・IIIから進行したいわゆるsecondary glioblastoma であると考えられている。逆に、Grade IIとGrade IIIのびまん性神経膠腫のほとんどはIDH変異型であり、おそらく共通の前駆細胞から発生、進行する連続した腫瘍であることが示唆される。組織学的にはGrade II・IIIびまん性神経膠腫と判断されるがIDH変異はない (IDH野生型)という症例が、特に星細胞腫において稀に見られる。これらは実は他の分類(びまん性中心性神経膠腫H3-K27 変異など)に属する腫瘍の可能性があり、これも暫定的な診断という考えがWHO2016分類では示されている。IDH野生型の星細胞腫について詳しく解析した研究において、①EGFR 増幅、② 染色体 7番の増幅または10番の欠失 ③TERT プロモーター変異のいずれかが認められると膠芽腫と同等の予後が見込まれることが報告されている6)。これらの知見をもとに、IDH遺伝子の野生型星細胞腫に、①微小血管増生(microvascular proliferation)・壊死・②EGFR 増幅、③ 染色体 7番の増幅または10番の欠失 ④TERT プロモーター 変異のいずれかが認められるものは膠芽腫と同様に扱ってもよいという提案がされている7-9)。さらに、IDH遺伝子変異型であっても、CDKN2A/B遺伝子のホモ接合性欠失・微小血管増生(microvascular proliferation)・壊死のいずれか一つの所見が認められるものはastrocytoma Grade IV という提言もされている9, 10)。このように、IDH野生型の星細胞腫は臨床的にはGrade IVの膠芽腫に近い経過を呈するという症例も多く、特にGrade II星細胞腫IDH野生型は本ガイドラインの適用される腫瘍とはしないことが適切である。
このように、実際的にはIDH変異はGrade II・IIIとIVの間に明確な線を引くマーカーとしての意味があると考えてよい。
1p/19q共欠失は、乏突起膠腫/退形成性乏突起膠腫に特徴的な遺伝子異常として同定された。一般に乏突起膠腫/退形成性乏突起膠腫は星細胞腫/退形成性星細胞腫と比べて予後が良好であるが、その後の情報の蓄積によって、組織形態学的には乏突起膠腫/退形成性乏突起膠腫であるが1p/19q共欠失がない、という腫瘍の臨床経過は星細胞腫/退形成性星細胞腫に準ずること、逆に、組織形態学的には星細胞腫/退形成性星細胞腫であるが1p/19q共欠失がある、という腫瘍の臨床経過は乏突起膠腫/退形成性乏突起膠腫に準ずることが明らかとなった。その結果、WHO 2016分類においては1p/19q共欠失が乏突起膠腫/退形成性乏突起膠腫の診断基準に組み入れられ、組織形態のみによる診断に比べて、より明瞭で、客観性のある診断が可能になった。したがって、びまん性神経膠腫の診断においては原則としてIDH変異の有無と1p19q共欠失の検索を行うことが必要となっている。従来しばしばつけられていた乏突起星細胞腫/退形成性乏突起星細胞腫という診断名は、原則として1p/19q共欠失の有無によって、乏突起膠腫/退形成性乏突起膠腫または星細胞腫/退形成性星細胞腫のいずれかに診断されることになり、遺伝子異常の検索が行われなかった場合に暫定的につけられる診断名と位置づけられる(この場合、NOSという接尾語をつけることになる)。
Grade IIとIIIを区別する分子マーカーはなく、その判断は組織形態学によってなされる。具体的には腫瘍細胞の退形成性(anaplasia)と分裂像(mitosis)があればGrade IIIという診断になる。びまん性星細胞腫では、生検標本などの小さな組織で分裂像が1個でも認められるとGrade IIIとなるが、十分大きな標本では複数個の分裂像が観察されるとGrade IIIと診断される。乏突起膠腫では10視野あたり分裂像が6個以上認められるとGrade IIIと診断される1, 3)。
本ガイドラインが基礎にするGrade II・III神経膠腫の分類と診断において、一つの問題はGrade IIとIIIの間に予後の差があるのかということである。過去に蓄積されたびまん性神経膠腫の経験は、ほとんどが組織診断のみによって母集団の選定を行っており、その場合は明らかにGrade IIとIIIの予後は違いがみられた。しかし、IDH変異と1p/19q共欠失を用いて腫瘍を診断した場合、Grade IIとIIIの間、つまり星細胞腫と退形成性星細胞腫の間、および乏突起膠腫と退形成性乏突起膠腫の間には明確な差が存在しない、という報告がみられるようになってきている。
もう一つの問題は、過去の研究におけるGrade IIIとGrade IVの境界の不明瞭性との整合性である。過去の臨床研究や治験においては、Grade IIIとGrade IVのびまん性神経膠腫を「悪性神経膠腫(malignant glioma)」としてひとまとめに取り扱ったものが多い。現在の診断基準からすると明確に異なり、予後も明らかに異なる腫瘍(例えばIDH変異型とIDH野生型)が混在して母集団として取り扱われているために、エビデンスとしてレベルの高いものが少ない状況になっている。また、Grade IIIのびまん性神経膠腫に限った臨床研究も少ない。
本ガイドラインでは、そのような状況下で、これまでの様々な知見をもとにして現在推奨される診療の指針を提示する。
|

|
| |
4) 臨床的予後因子
|
| |
(1) Grade II神経膠腫の予後因子とlow-risk 群、high-risk 群
Grade II神経膠腫の予後因子として、年齢・手術摘出率・組織型(星細胞腫か否か)などがあげられる。一般に増大が極めて緩徐なGrade II 神経膠腫においては、一定の条件を満たす、再発や死亡に至る期間が長い、リスクが低い集団については、放射線治療や化学療法の副作用を考慮して、手術後はまず注意深く経過観察を行う(watch and wait approachとかwatchful waitingといわれる)ことも選択肢とされてきた。そのような条件に該当しない集団については、放射線療法や化学療法を行うという選択がより強く考慮されることになる。そのような観点から、Grade II神経膠腫をhigh-risk群とlow-risk群に分けて臨床的な判断を行うことが一般的となってきた。
Radiation Therapy Oncology Group(RTOG)によるRTOG9802試験では、low-risk群を全摘出かつ40歳未満と定めて経過観察を行ったところ、①残存腫瘍最大径1 cm 以上、②術前の最大径が4 cm以上、③組織型がastrocytoma という3つが再発のリスク因子として抽出され、すべて当てはまらない場合は5年間の再発率が30 %、3項目すべてが当てはまる場合は87%であったと報告した。またhigh-risk 群を残存腫瘍ありまたは40歳以上として、low-risk群は手術後経過観察、high-risk群はRT (radiotherapy)単独とRT+PCV [プロカルバジン+ CCNU (lomustine) + ビンクリスチン] を比較し、PCVを加えた方が予後が改善したことを報告した11)。EORTCでは放射線治療の有効性を確認するために行われた2つのランダム化試験(22844と22845試験)のデータを分析し、生命予後を悪くする因子として、① 40歳以上、②最大径6 cm 以上、③中心線を超える腫瘍、④組織型がastrocytoma、⑤神経症状あり、という5つの因子を挙げ、このうちの3項目以上があるものをhigh-risk群( OS中間値3.7年)、2つ以下のものをlow-risk群(OS中間値7.8年)とすることを提唱している12)。
このような検討をもとに、Grade II 神経膠腫で 40歳未満で肉眼的全摘出がなされている、という条件を満たすものをlow-risk 群、①40歳以上であるか、または②部分摘出に終わっているもの、をhigh-risk 群と考えることが最も一般的である。この他、③組織診断が乏突起膠腫でないこと、④神経症状があること、⑤中心線を超える腫瘍であること、という因子もhigh-risk群に相当する条件ともされる。
これらの研究においては研究デザインの段階では分子診断が組み入れられていないが、大半のGrade II神経膠腫がIDH変異型で、大多数の乏突起膠腫が1p/19q共欠失型であると考えられるので、この振り分けはWHO2016分類におけるIDH変異型のGrade II神経膠腫においても通用し、また乏突起膠腫であること、というのは1p/19q共欠失 のある腫瘍であること、と読み替えてもよいと思われる。一方、組織形態上はGrade IIに相当するIDH変異型の神経膠腫は、実際は様々な腫瘍を含む、均一でない一群であり、glioblastomaの浸潤部に相当するものも含まれているので、このような振り分けの対象とはしないことが適当である。
(2) Grade III神経膠腫の臨床的予後因子
予後良好因子として、NOA-04試験13)やEORTC 26951試験14)の結果から、年齢(50歳以下)・手術摘出率(全摘出)・IDH1変異あり・1p/19q共欠失あり・O6-methylguanine -DNA methyltransferase (MGMT) 遺伝子プロモーター領域メチル化があげられた。
|

|
| |
| 文献 |
| 1) |
日本脳神経外科学会, 日本病理学会編. 脳腫瘍取扱い規約 第4版. 2018.
|
|
| 2) |
Kanazawa T, Fujiwara H, Takahashi H, et al. Imaging scoring systems for preoperative molecular diagnoses of lower- grade gliomas. Neurosurg Rev. 2019;42(2):433-41.
|
|
| 3) |
Louis DN, Ohgaki H, Wiestler OD, et al. WHO Classification of Tumours of the Central Nervous System, 4th edition. Fourth Edition ed. Lyon: IARC Press; 2016.
|
|
| 4) |
Brain Tumor Registry of Japan (2005-2008). Neuro Med Chir (Tokyo). 2017;57(Suppl 1):9-102.
|
|
| 5) |
Suzuki H, Aoki K, Chiba K, et al. Mutational landscape and clonal architecture in Grade II and III gliomas. Nat Genet. 2015;47(5):458-68.
|
|
| 6) |
Stichel D, Ebrahimi A, Reuss D. et al. Distribution of EGFR amplification, combined chromosome 7 gain and chromosome 10 loss, and TERT promoter mutation in brain tumors and their potential for the reclassification of IDHwt astrocytoma to glioblastoma. Acta Neuropathol. 2018;136(5):793-803.
|
|
| 7) |
Brat DJ, Aldape K, Colman H, et al. cIMPACT-NOW update 3: recommended diagnostic criteria for "Diffuse astrocytic glioma, IDH-wildtype, with molecular features of glioblastoma, WHO Grade IV". Acta Neuropathol. 2018;136(5):805-10.
|
|
| 8) |
Brat DJ, Aldape K, Colman H, et al. cIMPACT-NOW update 5: recommended grading criteria and terminologies for IDH-mutant astrocytomas. Acta Neuropathol. 2020;139(3):603-8.
|
|
| 9) |
Louis DN, Wesseling P, Aldape K, et al. cIMPACT-NOW update 6: new entity and diagnostic principle recommendations of the cIMPACT-Utrecht meeting on future CNS tumor classification and grading. Brain Pathol. 2020;30(4):844-56.
|
|
| 10) |
Shirahata M, Ono T, Stichel D, et al. Novel, improved grading system(s) for IDH-mutant astrocytic gliomas. Acta Neuropathol. 2018;136(1):153-66.
|
|
| 11) |
Buckner JC, Shaw EG, Pugh SL, et al. Radiation plus Procarbazine, CCNU, and Vincristine in Low-grade Glioma. N Engl J Med. 2016;374(14):1344-55.
|
|
| 12) |
Pignatti F, van den Bent M, Curran D, et al. Prognostic factors for survival in adult patients with cerebral low-grade glioma. J Clin Oncol. 2002;20(8):2076-84.
|
|
| 13) |
Wick W, Roth P, Hartmann C, et al. Long-term analysis of the NOA-04 randomized phase III trial of sequential radiochemotherapy of anaplastic glioma with PCV or temozolomide. Neuro Oncol. 2016;18(11):1529-37.
|
|
| 14) |
van den Bent MJ, Brandes AA, Taphoorn MJ, et al. Adjuvant procarbazine, lomustine, and vincristine chemotherapy in newly diagnosed anaplastic oligodendroglioma: long-term follow-up of EORTC brain tumor group study 26951. J Clin Oncol. 2013;31(3):344-50.
|
|

|
|

|

|
| 2.成人Grade II・III神経膠腫のスコープ作成
|

|
| |
1)診療ガイドラインがカバーする内容に関する事項
|
| |
|
(1) |
タイトル:成人Grade II・III神経膠腫の診療ガイドライン
|
| |
|
(2) |
目的:生命予後・機能予後の改善を目的とした治療方針の提示
WHO Grade II・IIIびまん性神経膠腫と診断された腫瘍に罹患した個々の成人症例において、生命予後・機能予後の改善を目的とした適切な治療方針を検討する上で必要となる重要な臨床事項を臨床的質問(Clinical Question:CQ)として提示し、エビデンスに基づく推奨事項を述べる。
|
| |
|
(3) |
目的:生命予後・機能予後の改善を目的とした治療方針の提示
WHO Grade II・IIIびまん性神経膠腫と診断された腫瘍に罹患した個々の成人症例において、生命予後・機能予後の改善を目的とした適切な治療方針を検討する上で必要となる重要な臨床事項を臨床的質問(Clinical Question:CQ)として提示し、エビデンスに基づく推奨事項を述べる。
|
| |
|
(4) |
想定される利用者、利用施設:脳腫瘍診療に従事する医師
|
| |
|
(5) |
既存ガイドラインとの関係:日本では既存のガイドラインは作成されていない
|
| |
|
(6) |
最重要臨床課題
課題1:手術摘出の適応と意味
課題2:組織診断後の治療の選択
課題3:経過観察の方法と再発の診断
課題4:臨床症状への対応
課題5:再発時の治療
|
| |
|
(7) |
ガイドラインがカバーする範囲
Grade II・IIIびまん性神経膠腫に罹患した成人患者(20歳以上)。
ここで対象とする「Grade II・IIIびまん性神経膠腫」は、WHO分類2016分類(WHO2016)における、びまん性星細胞腫( diffuse astrocytoma:DA )、退形成性星細胞腫( anaplastic astrocytoma:AA )、乏突起膠腫( oligodendroglioma:OL )、退形成性乏突起膠腫( anaplastic oligodendroglioma:AO )、および、いわば暫定的な分類として扱われる乏突起星細胞腫( oligoastrocytoma:OA )、退形成性乏突起星細胞腫( anaplastic oligoastrocytoma:AOA ) である。ここではこれらをまとめて「Grade II・III びまん性神経膠腫、または単にGrade II・III神経膠腫」と記載する。上衣腫(ependymal tumors)は含めない。
|
| |
|
(8) |
CQリスト
課題1:手術摘出の適応と意味
CQ1: どのような手術を選択すべきか?
課題2:組織診断後の治療の選択
CQ2:手術中に腫瘍摘出腔にカルムスチン徐放性ポリマー(BCNU-wafer)を留置すべきか?
CQ3:手術後に放射線治療を行うべきか?
CQ4:手術後に化学療法を行うべきか?
課題3:経過観察の方法と再発の診断
CQ5:術後の経過観察と画像診断の方法と頻度はどうするか?
課題4:臨床症状への対応
CQ6:神経症状(てんかん、高次機能障害など)への対応はどうするか?
課題5:再発時の治療
CQ7:再発時の治療はどのように行うのか?
|

|
| |
2)システマティックレビューに関する事項
|
| |
|
(1) |
実施スケジュール
文献検索・選出:
「Minds診療ガイドライン作成の手引き 2014」に準拠した方法により2015年に開始した。当初はWHO2007分類に基づく臨床試験結果などのエビデンスをもとにレビューを行ったが、2016年に分子マーカーに基づくWHO 2016分類を考慮して文献検索をすすめ、最終的に2019年11月末までの文献レビューを行った。
エビデンス総体の評価:上記の文献検索に基づき2020年11月末に委員会案を作成した。
|
| |
|
(2) |
エビデンスの検索
①エビデンスタイプ
・個別研究論文:ランダム化比較試験の報告は、海外からいくつか報告されている。その他、非ランダム化比較試験、観察研究を検索
対象にする。症例報告に関しては一部を除いて省略する。
②データベース
主にPubMed
③検索方法
・介入の検索に関してはPICOフォーマットを用いる。
④検索対象期間
・すべてのデータベースで2019年11月まで
|
| |
|
(3) |
文献の選択基準、除外項目
採択条件を満たす観察研究がない場合、システマティックレビューは実施しない。
|
| |
|
(4) |
エビデンスの評価と統合の方法
エビデンス総体の強さの評価は「Minds作成手引き2014」の方法に基づく。
エビデンス総体の統合は質的な統合を基本とし、適切な場合が量的統合を実施。
|

|
|

|

|
|

|
| 課題1:手術摘出の適応と意味)
|

|
| |
CQ1 どのような手術を選択すべきか?
|

|
| |
推奨
1. 臨床経過および放射線診断学的にGrade II・IIIの神経膠腫が強く疑われる病変に対しては、
(1) 機能温存を前提に、病変の可及的摘出術を推奨する。(推奨度1C)
(2) 摘出術で神経症状を悪化させる可能性が高い症例では、診断のために生検術を行うことを推奨する。(推奨度 1C)
2. 無症状で偶然見つかった病変は、神経膠腫の可能性を患者に説明したうえで、MRI等の画像検査による注意深い経過観察を行うことを考慮してもよい。(推奨度 2D) |
|

|
| |
解説
|
| |
放射線診断学的にGrade II・IIIの神経膠腫が疑われる病変に対して手術を行う目的は、①診断を得ること、②摘出による治療を行うこと(機能予後、生命予後の改善)の2つである。
Grade II神経膠腫のみ、またはGrade III神経膠腫のみを対象として、摘出率や残存腫瘍量と予後との関係を主要評価項目としたランダム化比較試験は存在しない。
|

|
| |
1. Grade II神経膠腫
|
| |
1) Grade II 神経膠腫の自然経過:増大速度と悪性化
Grade II神経膠腫はGrade III・IVの神経膠腫に比べ、生物学的悪性度は低いものの、直線的経時的に増大し成長につれ悪性転化をきたす。Grade II神経膠腫の増大速度は最大径3-5mm/年、体積では0.187cm3/月の割合で増大し、腫瘍の増大速度は手術前および手術後でも変わらないとされる1-3)。乏突起膠腫においても直線的増大は変わらない。悪性転化はGrade II・III神経膠腫の50-90%で生じると報告されている4-8)。フランスグリオーマ研究グループ(Re´seau d’Etude des Gliomes [REG])によると2)、1296例のGrade II神経膠腫のうち、47例(3.6%)が頭痛やめまい、他の脳腫瘍の検査のために偶然見つかった無症候性腫瘍 (incidental tumor)であった。1249例の症候性腫瘍と比較検討すると、無症候性腫瘍では腫瘍体積中央値が17.2 cm3 (0.2–50.0)と、症候性腫瘍の54.6 cm3 (0.1–461.1)に比較して有意に小さかった(p<0.001)。無症候性腫瘍は女性に多く、平均年齢がやや若く (35.5 vs.37.0, p=0.67)、非優位半球の前頭葉に限局するものが多かった。MRI上造影増強病変をもつ腫瘍は無症候性では2%であったのに対して、症候性腫瘍では21%であった。13例は経過観察のみ行われたが、観察期間中央値48か月後に増悪を認めた。無症候性腫瘍であっても14例で悪性転化を認め(10例は組織学的に確認)、4人が死亡した。腫瘍径の増大速度は無症候性腫瘍、症候性腫瘍で3.9mm/年・4.2mm/年と差が認められなかった。無症候性腫瘍は、症候性腫瘍に対して生存期間は長いものの、小さいうちに見つかった腫瘍が確実に増大し、増悪するGrade II神経膠腫の早期像を見ているに過ぎないことが示された。
2) 組織診断について
総論・画像所見に記載したように、放射線診断学的にGrade II神経膠腫が疑われる病変については、組織診断を得るために生検術、もしくは摘出を考慮する。組織診断の結果、Grade III以上の悪性神経膠腫の可能性もあるが、一方で非腫瘍性病変の可能性もあるため、無症状で、脳ドックなどで偶然見つかった病変は、神経膠腫の可能性もあることを患者に説明したうえで、画像検査による注意深い経過観察も考慮する。
外科的侵襲を加えること、合併症リスクがあることを考慮すると、Grade II神経膠腫を疑わせる病変に対する手術介入を考慮する際は、非腫瘍性病変の可能性をできる限り除外する必要がある。画像上完全に鑑別することはできないが、腫瘍か否かをより正確に推定するためにはMR spectroscopyやPETなどがある程度有用である。Watanabeらは、163例のT1低信号・T2高信号で造影されない病変に対してメチオニンPETを施行し、T/N (tumor-to-normal cortex)比1.9以上の症例では症状悪化までの期間が統計学的に有意に短かったことから、T/N比1.9以上である場合は腫瘍性病変である可能性が高く、画像診断による経過観察のみというのは合理的な選択ではないと報告している9)。
生検術により採取できる組織量は少量であるために、神経膠腫の診断はつくものの、Gradeについては下記のようにサンプリングエラーの危険性があることが報告されている。生検術によりWHO Grade IIの神経膠腫と診断された28例に対して摘出術を追加し正診率を検討したMuragakiらの報告によれば、28%の症例で摘出術による病理診断はWHO Grade III以上であった10)。画像上Grade II神経膠腫と考えて矛盾しないCTおよびMRIで造影増強効果のない低吸収(低信号)に描出された病変について、Kondziolkaらは20例中9例(45%)11)、Barker らは31例中9例(32%)12)が退形成性星細胞腫であったと報告している。
[注意]:メチオニンPETは未承認である。
3) 治療としての摘出の意義
(1) 生命予後に関して
Grade II神経膠腫に対する手術を行う時期および摘出率と予後の関係は地域コホート研究13)および後方視的検討14)が報告されている。
ノルウェーでは患者が住んでいる地域により受診する病院が決まっており、ある病院では画像上Grade II神経膠腫が疑われた場合に早期に腫瘍摘出を行う方針、もう一つの病院では生検のみを行いGrade II神経膠腫の診断がなされたあとは経過観察の方針としていた。1998~2009年にこの2つの病院で治療を受けたGrade II神経膠腫153例の治療成績を比較したところ、早期に摘出術を行った病院の5年生存割合が74%であったのに対して、生検のみを行った病院では60%と早期に摘出術を行うことで生存期間を延長する可能性が報告された(P=0.01)13)。術後の手術合併症は両病院で差がなかった。術後6ヶ月以内の放射線治療施行割合は早期に摘出術を行った病院で43%、生検のみを行い経過観察を行った病院で29%と、早期に摘出術を行った病院で多く放射線治療が行われる傾向であるものの有意差は認められなかった(P=0.09)。この報告から生検と経過観察を行うよりも、早期に摘出術と術後照射を行うことでGrade II神経膠腫の予後が改善する可能性が示唆される。
SmithらはGrade II神経膠腫216例を対象にMRI FLAIR画像を用いた体積摘出率と生存期間の関係を検討した。その結果、手術での摘出率と生存割合に正の相関が認められた。多変量解析の結果では、生存期間は術前腫瘍体積、術後残存腫瘍体積、摘出率が有意に相関し、再発までの期間は術前腫瘍体積、術後残存腫瘍体積と有意に相関することが示された14)。
脳腫瘍全国集計調査報告においても、術者評価ではあるがFLAIRでの高信号病変の75%以上摘出されたGrade II神経膠腫で有意に生存期間が延長していることが報告されているが、術前の腫瘍体積に関する情報は無い15)。Yangらは13,289例のGrade II神経膠腫の摘出率と予後についてメタ解析を行い、摘出率は生存期間、無再発生存期間、てんかん発作コントロール率、悪性転化までの期間すべて正の相関が認められたと報告している16)。
分子診断による腫瘍型別に摘出率と予後を考察した報告として、Wijinengaらは、IDH変異の有無と摘出率と予後の関係についてlow-grade glioma 228例の後方視的研究を行い、IDH-mutant astrocyomaではわずかな残存腫瘍であっても生存期間を短縮すると報告している17)。また、Nittaらは摘出術を施行した154例のlow-grade gliomaについて検討し、diffuse astrocytomaにおいては摘出率が、より長い全生存期間 (overall survival; OS)、無増悪生存期間 (progression free survival; PFS)と相関することを報告し、またIDH1変異のある患者では明らかにOS が長かったと報告している18)。
このように、特に摘出率と生命予後の相関を示す臨床研究データ、およびメタ解析の報告は多いが、頭書に述べたようにRCTは存在しない。後方視的研究では症例選択のバイアスがあると考えられるため、生命予後の点から可及的摘出を推奨するエビデンスレベルは高くないが、しかし、手術合併症のリスクが低い場合は可及的摘出が推奨される。病変の部位、大きさ、年齢やPSなどにより摘出術による合併症のリスクが高いと判断される場合にはよりリスクの少ない生検術を選択することが推奨される。
可及的最大限の摘出を安全に行うために、ニューロナビゲーション、運動誘発電位(motor evoked potential: MEP)などの術中モニタリングや覚醒下手術、術中蛍光診断、術中MRIなどが用いられる19-22)。覚醒下手術については、日本Awake Surgery学会でガイドラインが作成されている23)。覚醒下開頭手術による保険加算請求を行うには、施設認定が必要である。神経膠腫は適応疾患であり、病変の局在として摘出術によって神経症状の悪化の恐れがあるが、術中のタスクによってそれが評価できるものとされている。De Witt Hamerらは1990年~2010年までに発表された90論文・8091症例のGrade II-IVの神経膠腫についてメタアナリシスを行った19)。脳表マッピングの有・無で腫瘍が全摘できた割合はそれぞれ75%・58%であった。腫瘍の存在する領域が機能領域を含む症例は99.9%・95.8%で、3ヶ月以内の重篤な麻痺などの神経学的な合併症が生じた割合は、36.0%・11.3%とマッピング群で多かったが、3ヶ月後も神経症状の悪化が残存した割合はそれぞれ3.4%・8.2%とマッピング群で神経症状が回復して後遺症を残す率が低かった。5-アミノレブリン酸(5-Aminolevulinic Acid; 5-ALA)を用いた術中蛍光診断の有効性についてシステマティックレビューを行ったFerraroらはlow-grade glioma(WHO Grade I+II)のsensitivityは16%と報告21)しており、low-grade gliomaにおける術中蛍光診断の有用性は限定的である。術中MRIに関しては、Coburgerらがドイツの6つの脳神経外科センターにて術中MRIガイド下に摘出術が施行されたGrade II 神経膠腫 288例を後方視的に解析した22)。低磁場MRIに比べ高磁場MRIを使用した集団において全摘出(gross total resection)の割合は有意に高かったが、PFSに関しては磁場強度による差は認められなかった。
(2) 機能予後に関して
70〜90%のGrade II神経膠腫が痙攣発作を合併する。腫瘍と関連のない頭痛やめまい、頭部外傷でCTやMRI検査を受けて診断される無症候性Grade II神経膠腫は3.0~9.6%と報告されている3, 24 25)。Englotらは、low-grade gliomaの摘出術後のてんかん発作コントロールについてのレビューにおいて、36~100%で発作消失が得られていたと報告している26)。すなわち、てんかん発症のGrade II神経膠腫に対する摘出術は、発作コントロールによるQOL改善も期待される。てんかん発作はGrade II神経膠腫の長期の認知機能や健康関連QOLにも影響するため、抗てんかん薬による発作のコントロールも重要である27)。
|

|
| |
システマティックレビュー結果
|
| |
このCQに応えるため、2000年1月〜2019年10月の文献を対象に下記の検索式による文献検索を2019年11月に行った。
|

|
| |
| # |
検索式 |
文献数 |
| #1 |
low-grade glioma x resection |
1377 |
| #2 |
low-grade glioma x resection x survival |
656 |
| #3 |
low-grade glioma x resection x survival x outcome |
319 |
|
| |
以上の検索式より、一次スクリーニングとして319の文献を抽出し、最終的に下記に示した27の文献を抽出した。
|

|
| |
| 文献 |
| 1) |
Mandonnet E, Pallud J, Fontaine D, et al. Inter- and intrapatients comparison of WHO Grade II glioma kinetics before and after surgical resection. Neurosurg Rev. 2010;33(1):91-6.
|
|
| 2) |
Pallud J, Fontaine D, Duffau H, et al. Natural history of incidental World Health Organization Grade II gliomas. Ann Neurol. 2010;68(5):727-33.
|
|
| 3) |
Potts MB, Smith JS, Molinaro AM, et al. Natural history and surgical management of incidentally discovered low-grade gliomas. J Neurosurg. 2012;116(2):365-72.
|
|
| 4) |
Chaichana KL, McGirt MJ, Laterra J, et al. Recurrence and malignant degeneration after resection of adult hemispheric low-grade gliomas. J Neurosurg. 2010;112(1):10-7.
|
|
| 5) |
Jaeckle KA, Decker PA, Ballman KV, et al. Transformation of low-grade glioma and correlation with outcome: an NCCTG database analysis. J Neurooncol. 2011;104(1):253-9.
|
|
| 6) |
Lavon I, Zrihan D, Zelikovitch B, et al. Longitudinal assessment of genetic and epigenetic markers in oligodendrogliomas. Clin Cancer Res. 2007;13(5):1429-37.
|
|
| 7) |
Ohno M, Narita Y, Miyakita Y, et al. Histopathological malignant progression of grade II and III gliomas correrated with IDH1/2 mutation status. Brain Tumor Pathol. 2012;29(4):183-91.
|
|
| 8) |
Schmidt MH, Berger MS, Lamborn KR, et al. Repeated operations for infiltrative low-grade gliomas without intervening therapy. J Neurosurg. 2003;98(6):1165-9.
|
|
| 9) |
Watanabe A, Muragaki Y, Maruyama T, et al. Usefulness of (1)(1)C-methionine positron emission tomography for treatment-decision making in cases of non-enhancing glioma-like brain lesions. J Neurooncol. 2016;126(3):577-83.
|
|
| 10) |
Muragaki Y, Chernov M, Maruyama T, et al. Low-grade glioma on stereotactic biopsy: how often is the diagnosis accurate? Minim Invasive Neurosurg. 2008;51(5):275-9.
|
|
| 11) |
Kondziolka D, Lunsford LD, Martinez AJ. Unreliability of contemporary neurodiagnostic imaging in evaluating suspected adult supratentorial (low-grade) astrocytoma. J Neurosurg. 1993;79(4):533-6.
|
|
| 12) |
Barker FG, Chang SM, Huhn SL, et al. Age and the risk of anaplasia in magnetic resonance-nonenhancing supratentorial cerebral tumors. Cancer. 1997;80(5):936-41.
|
|
| 13) |
Jakola AS, Myrmel KS, Kloster R, et al. Comparison of a strategy favoring early surgical resection vs a strategy favoring watchful waiting in low-grade gliomas. JAMA. 2012;308(18):1881-8.
|
|
| 14) |
Smith JS, Chang EF, Lamborn KR, et al. Role of extent of resection in the long-term outcome of low-grade hemispheric gliomas. J Clin Oncol. 2008;26(8):1338-45.
|
|
| 15) |
Narita Y, Shibui S, Committee of Brain Tumor Registry of Japan Supported by the Japan Neurosurgical Society. Trends and Outcomes in the Treatment of Gliomas Based on Data during 2001-2004 from the Brain Tumor Registry of Japan. Neurol Med Chir (Tokyo). 2015;55(4):286-95.
|
|
| 16) |
Yang K, Nath S, Koziarz A, et al. Biopsy Versus Subtotal Versus Gross Total Resection in Patients with Low-grade Glioma: A Systematic Review and Meta-Analysis. World Neurosurg. 2018;120:e762-e775.
|
|
| 17) |
Wijnenga MMJ, French PJ, Dubbink HJ, et al. The impact of surgery in molecularly defined low-grade glioma: an integrated clinical, radiological, and molecular analysis. Neuro Oncol. 2018;20(1):103-12.
|
|
| 18) |
Nitta M, Muragaki Y, Maruyama T, et al. Proposed therapeutic strategy for adult low-grade glioma based on aggressive tumor resection. Neurosurg Focus. 2015;38(1):E7.
|
|
| 19) |
De Witt Hamer PC, Robles SG, Zwinderman AH, et al. Impact of intraoperative stimulation brain mapping on glioma surgery outcome: a meta-analysis. J Clin Oncol. 2012;30(20):2559-65.
|
|
| 20) |
Hervey-Jumper SL, Berger MS. Maximizing safe resection of low- and high-grade glioma. J Neurooncol. 2016;130(2):269-82.
|
|
| 21) |
Ferraro N, Barbarite E, Albert TR, et al. The role of 5-aminolevulinic acid in brain tumor surgery: a systematic review. Neurosurg Rev. 2016;39(4):545-55.
|
|
| 22) |
Coburger J, Merkel A, Scherer M, et al. Low-grade Glioma Surgery in Intraoperative Magnetic Resonance Imaging: Results of a Multicenter Retrospective Assessment of the German Study Group for Intraoperative Magnetic Resonance Imaging. Neurosurgery. 2016;78(6):775-86.
|
|
| 23) |
Kayama T, Guidelines Committee of The Japan Awake Surgery Conference. The guidelines for awake craniotomy guidelines committee of the Japan awake surgery conference. Neurol Med Chir (Tokyo). 2012;52(3):119-41.
|
|
| 24) |
Bauchet L, Rigau V, Mathieu-Daudé H, et al. French brain tumor data bank:methodology and first results on 10,000 cases. J Neurooncol. 2007;84(2):189-99.
|
|
| 25) |
Kamiguchi H, Shiobara R, Toya S. Accidentally detected brain tumors: clinical analysis of a series of 110 patients. Clin Neurol Neurosurg. 1996;98(2):171-5.
|
|
| 26) |
Englot DJ, Berger MS, Barbaro NM, et al. Predictors of seizure freedom after resection of supratentorial low-grade gliomas. A review. J Neurosurg. 2011;115(2):240-4.
|
|
| 27) |
Klein M. Neurocognitive functioning in adult WHO Grade II gliomas: impact of old and new treatment modalities. Neuro Oncol. 2012;14(Suppl 4):iv17-iv24.
|
|

|
| |
2. Grade III神経膠腫
|
| |
摘出率と予後に関するシステマティックレビューが3件あり、いずれも、高い摘出率がより良い予後と相関するとしている1-3)。また、RCTのサブグループ解析の報告が3報存在する。まず、退形成性神経膠腫全体を対象とした補助療法に関するRCT(NOA−04試験)では、PFSの多変量解析で、摘出率(p=0.0006)が他の因子(年齢、組織、IDH変異、MGMTメチル化)とともに、有意差をもってより良い予後と相関していた。HR (hazard ratio)は非全摘出対全摘出で1.6、生検対非全摘出で2.1、生検対全摘出で3.5であった4)。AOとAOAを対象に放射線治療に対するPCV化学療法の上乗せ効果を検討したEORTC26951試験でも、サブグループ解析で摘出群と生検群で予後(OS)に有意差を認めた(摘出対生検でHR=0.57、p=0.005)5)。AOを対象に放射線治療単独に対するPCV化学療法の上乗せ効果を検討したRTOG9402試験におけるサブグループ解析での多変量解析でも、摘出群が生検群より有意に予後(OS)が長かった(HR=0.52、p=0.0059) 6)。
後方視研究に関しては、volumetryを用いた摘出率と予後を解析した研究は2件ある。Kelesらは、AA 67例において、T2高信号領域の体積とPFSが相関し(p<0.0001)、残存造影病変の体積がOSと相関(p=0.003)すると報告した7)。Fujiiらは、122例のGrade III神経膠腫において、AA+AOAで摘出率(extent of resection:EOR)と予後(OS)は相関し(p=0.0208)、摘出閾値は術中MRIのT2画像で53%であった。多変量解析ではT2高信号領域の摘出率が有意差を示した(HR=3.28, p=0.0192) 8)。Volumetryを用いない後方視解析は6報あり、Nomiyaらの報告では、170例のAAを解析し、GTR+STR vs. PR+biopsyで予後との相関がみられた(gross total resection:GTR, 肉眼的全摘;subtotal resection:STR, 亜全摘;partial resection:PR, 部分摘出)9)。その他は、high-grade gliomaとしてGrade III・IVをまとめた報告が5件ありEORと予後は相関した。一方、Grade IIIにおいて摘出率と予後が相関しないという報告も4件あり、そのうち2報はAO についてである。
病理組織別では、AOに関しては、AlattarらがSurveillance, Epidemiology, and End Results (SEER) analysisで、1028例のデータベースを解析、EORとOSの相関がなかったと報告しており10)、Fujiiらの報告でもAOではEORと予後に相関はなかった8)。Puduvallらは107例のAOでEORと予後は相関しなかったと報告した11)。
遺伝子情報を含めた診断に基づく解析として、Kawaguchiらは、Grade IIIにおける全摘出群と非全摘出群を遺伝子プロファイル別に後方視解析し、1p/19q共欠失のある群(AO、IDH変異型および1p/19q共欠失にあたる、IDH野生型群では予後に差がなく、AA, IDH変異型にあたる)では全摘出群の予後が良かったと報告した12)。
以上、Grade III全体としては、高い摘出率がより良い予後と相関し、摘出術と生検では摘出術を行った例がより良い予後を示す、という報告が多い。一方で、組織診断別にみると組織形態のみに基づく場合(WHO2007分類以前)においても、遺伝子情報を含めた新たな診断(WHO 2016分類)においても、AAでは摘出率と予後との関連が示唆されるが、AOではその差は今のところ予後との相関は示唆されていない。
以上より、手術前に病理診断は未知であることを考えれば、Grade III神経膠腫が疑われる場合、低リスクで摘出が可能と考えられる病変に関しては、可及的に摘出を行うことが推奨される。リスクが高いと考えられる場合は生検術を考慮する。
|

|
| |
システマティックレビュー結果
|
| |
このCQに答えるために、2000年1月~2019年11月までの文献を対象に下記の検索式による文献検索を2019年11月に行った。
|

|
| |
| # |
検索式 |
文献数 |
| #1 |
Glioma |
62968 |
| #2 |
Glioma x survival |
20122 |
| #3 |
Glioma x survival x surgery |
6220 |
| #4 |
Glioma x survival x surgery x anaplastic |
563 |
|
| |
|
以上の検索式より、一次スクリーニングとして563の文献を抽出し、最終的に下記に示した12の文献を抽出した。
|

|
| |
| 文献 |
| 1) |
Fang JH, Lin DD, Deng XY, et al. Epidemiological trends, relative survival, and prognosis risk factors of WHO Grade III gliomas: A population-based study. Cancer Med. 2019;8(6):3286-95.
|
|
| 2) |
Hardesty DA, Sanai N. The value of glioma extent of resection in the modern neurosurgical era. Front Neurol. 2012; 3:140.
|
|
| 3) |
Sanai N, Berger MS. Glioma extent of resection and its impact on patient outcome. Neurosurgery. 2008;62(4):753-64; discussion 264-6.
|
|
| 4) |
Wick W, Hartmann C, Engel C, et al. NOA-04 randomized phase III trial of sequential radiochemotherapy of anaplastic glioma with procarbazine, lomustine, and vincristine or temozolomide. J Clin Oncol. 2009;27(35):5874-80.
|
|
| 5) |
van den Bent MJ, Carpentier AF, Brandes AA, et al. Adjuvant procarbazine, lomustine, and vincristine improves progression-free survival but not overall survival in newly diagnosed anaplastic oligodendrogliomas and oligoastrocytomas: a randomized European Organisation for Research and Treatment of Cancer phase III trial. J Clin Oncol. 2006;24(18):2715-22. [PMID: 16782911]
|
|
| 6) |
Cairncross G, Wang M, Shaw E, et al. Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma: long-term results of RTOG 9402. J Clin Oncol. 2013;31(3):337-43.
|
|
| 7) |
Keles GE, Chang EF, Lamborn KR, et al. Volumetric extent of resection and residual contrast enhancement on initial surgery as predictors of outcome in adult patients with hemispheric anaplastic astrocytoma. J Neurosurg. 2006;105(1):34-40.
|
|
| 8) |
Fujii Y, Muragaki Y, Maruyama T, et al. Threshold of the extent of resection for WHO Grade III gliomas: retrospective volumetric analysis of 122 cases using intraoperative MRI. J Neurosurg. 2018;129(1):1-9.
|
|
| 9) |
Nomiya T, Nemoto K, Kumabe T, et al. Prognostic significance of surgery and radiation therapy in cases of anaplastic astrocytoma: retrospective analysis of 170 cases. J Neurosurg. 2007;106(4):575-81.
|
|
| 10) |
Alattar AA, Brandel MG, Hirshman BR, et al. Oligodendroglioma resection: a Surveillance, Epidemiology, and End Results (SEER) analysis. J Neurosurg. 2018;128(4):1076-83.
|
|
| 11) |
Puduvalli VK, Hashmi M, McAllister LD, et al. Anaplastic oligodendrogliomas: prognostic factors for tumor recurrence and survival. Oncology. 2003;65(3):259-66.
|
|
| 12) |
Kawaguchi T, Sonoda Y, Shibahara I, et al. Impact of gross total resection in patients with WHO Grade III glioma harboring the IDH 1/2 mutation without the 1p/19q co-deletion. J Neurooncol. 2016;129(3):505-14.
|
|

|
|

|

|
| 課題2:組織診断後の治療の選択
|

|
| |
CQ2 手術中に腫瘍摘出腔にカルムスチン徐放性ポリマー(BCNU-wafer)を留置すべきか?
|

|
| |
推奨
手術中の迅速診断で悪性神経膠腫の診断がなされた場合は、カルムスチン徐放性ポリマー (BCNU-wafer)を留置してもよい。(推奨度2C)
|
|

|
| |
解説
|
| |
カルムスチン徐放性ポリマーは, 生体内分解性ポリマー基剤にカルムスチンを含有し, 腫瘍摘出腔壁に留置する局所的抗がん剤徐放性製剤である。本邦では2012年9月に悪性神経膠腫に対して承認され, 2013年1月より発売となった。術中迅速病理診断等により悪性神経膠腫と診断された場合に使用可能である。
|

|
| |
1. Grade II神経膠腫
|
| |
Grade II神経膠腫に対してカルムスチン徐放性ポリマーの有用性は明らかではない。カルムスチン徐放性ポリマーはGrade III・IV神経膠腫に対しての保険適用となっており、術前の画像検査でGrade II神経膠腫が疑われ、術中の迅速診断でも悪性神経膠腫(high-grade glioma)の診断が得られない場合は、カルムスチン徐放性ポリマーの留置は推奨されない。
迅速診断で、Gradeを確定することは容易ではない。Ishikawaら 1)は、術中迅速診断でGrade III・IVと診断されたものは95%以上の確率で最終組織診断もGrade III・IVの診断となり、迅速診断でGrade IIと診断されても、54.5%が最終組織診断でGrade III・IVとなったことを報告している。
|

|
| |
システマティックレビュー結果
|
| |
このCQに応えるため、2000年1月~2019年10月の文献を対象に下記の検索式による文献検索を2019年11月に行った。
|

|
| |
| # |
検索式 |
文献数 |
| #1 |
BCNU wafer & Grade II glioma・diffuse astrocytoma・oligodendroglioma・lower Grade glioma |
5 |
|
| |
以上の検索式より、一次スクリーニングとして5の文献を抽出したが、留置経験・治療成績について記載した論文は見つからなかった。
|

|
| |
| 文献 |
| 1) |
Ishikawa E, Yamamoto T, Satomi K, et al. Intraoperative pathological diagnosis in 205 glioma patients in the pre-BCNU wafer era: retrospective analysis with intraoperative implantation of BCNU wafers in mind. Brain Tumor Pathol. 2014;31(3):156-61.
|
|

|

|
| |
2. Grade III神経膠腫
|
| |
術中迅速診断で悪性神経膠腫(high-grade gliomaあるいはGrade III以上の神経膠腫)と診断された場合、カルムスチン徐放性ポリマー(BCNU wafer) を留置してもよい。これまでに悪性神経膠腫に対するカルムスチン徐放性ポリマーについて、3つのランダム化試験 1-4)および2つのメタ解析5-6)、および1つのCochrane Libraryのレビューが報告されている7)。これらの大部分は膠芽腫を主な対象としており、初発 Grade III神経膠腫を主な対象とした報告は皆無である。初発Grade III神経膠腫に対するカルムスチン徐放性ポリマー留置の有効性・安全性についての検討は, 悪性神経膠腫を対象とした報告の非直接性の検討によらざるを得ない。 膠芽腫に対するエビデンスについては, 1章 膠芽腫のCQを参照されたい. 悪性神経膠腫を対象とした臨床試験のなかには, 少数例の初発Grade III神経膠腫を含む報告を認めたが8-10)、治療成績について意味のある情報として得られるものは見当たらなかった。
ランダム化比較試験及びメタ解析及び複数の症例対象研究の結果からは, 初発Grade III神経膠腫に対するカルムスチン徐放性ポリマーの術中留置は有効である可能性があるが11-14), 直接的には確認されていない. 一方, 副作用としてのけいれん発作, 頭蓋内圧亢進, 脳浮腫, 手術部位感染の報告もある15-22)。
上記のような理由から, 初発Grade III神経膠腫を対象としたカルムスチン徐放性ポリマー留置の治療成績は明らかでは無く, 留置に伴う副作用もあることから, 推奨する根拠は弱いと考える。
|

|
| |
システマティックレビュー結果
|
| |
このCQに応えるため、2000年1月〜2019年10月の文献を対象に下記の検索式による文献検索を2019年11月に行った。
|

|
| |
| # |
検索式 |
文献数 |
| #1 |
gliadel[tiab] |
129 |
| #2 |
carmustine[tiab] OR carmustine[MeSH Terms] |
4488 |
| #3 |
"BCNU"[tiab] |
2768 |
| #4 |
#1 OR #2 OR #3 |
5189 |
| #5 |
"glioma"[MeSH Terms] OR "glioma"[tiab] |
82560 |
| #6 |
#4 AND #5 |
1218 |
| #7 |
Filters: Clinical Trial,Comparative Study,Multicenter Study,Research Support, Non-U.S. Gov't |
658 |
| #8 |
Filters: "0001/01/01"[PDAT] : "2019/110/30" |
677 |
|
| |
以上の検索式より、一次スクリーニングとして677の文献を抽出し、二次スクリーニングにて36の文献を抽出した。ハンドサーチによる4の文献を加え、最終的に下記に示した22の文献を抽出した。初発Grade III神経膠腫に対するカルムスチン徐放性ポリマー留置の有効性・安全性について調査するに当たり, 40論文のレビューを行った. 特に副作用についての情報を得るために, 再発症例や膠芽腫症例のみを対象とした論文も対象とした。
|

|
| |
| 文献 |
| 1) |
Westphal M, Ram Z, Riddle V, et al. Executive Committee of the Gliadel Study Group. Gliadel wafer in initial surgery for malignant glioma: long-term follow-up of a multicenter controlled trial. Acta Neurochir (Wien). 2006;148(3):269-75.
|
|
| 2) |
Westphal M, Hilt DC, Bortey E, et al. A phase 3 trial of local chemotherapy with biodegradable carmustine (BCNU) wafers (Gliadel wafers) in patients with primary malignant glioma. Neuro Oncol. 2003;5(2):79-88.
|
|
| 3) |
Valtonen S, Timonen U, Toivanen P, et al. Interstitial chemotherapy with carmustine-loaded polymers for high-grade gliomas: a randomized double-blind study. Neurosurgery. 1997;41(1):44-8; discussion 48-9.
|
|
| 4) |
Brem H, Piantadosi S, Burger PC, et al. Placebo-controlled trial of safety and efficacy of intraoperative controlled delivery by biodegradable polymers of chemotherapy for recurrent gliomas. The Polymer-brain Tumor Treatment Group. Lancet. 1995;345(8956):1008-12.
|
|
| 5) |
Xing WK, Shao C, Qi ZY, et al. The role of Gliadel wafers in the treatment of newly diagnosed GBM: a meta-analysis. Drug Des Devel Ther. 2015;9:3341-8.
|
|
| 6) |
Chowdhary SA, Ryken T, Newton HB. Survival outcomes and safety of carmustine wafers in the treatment of high-grade gliomas: a meta-analysis. J Neurooncol. 2015;122(2):367-82.
|
|
| 7) |
Hart MG, Grant R, Garside R, et al. Chemotherapy wafers for high-grade glioma. Cochrane Database Syst Rev. 2011;2011(3):CD007294.
|
|
| 8) |
Noël G, Schott R, Froelich S, et al. Retrospective comparison of chemoradiotherapy followed by adjuvant chemotherapy, with or without prior gliadel implantation (carmustine) after initial surgery in patients with newly diagnosed high-grade gliomas. Int J Radiat Oncol Biol Phys. 2012;82(2):749-55.
|
|
| 9) |
Menei P, Metellus P, Parot-Schinkel E, et al. Biodegradable carmustine wafers (Gliadel) alone or in combination with chemoradiotherapy: the French experience. Ann Surg Oncol. 2010;17(7):1740-6.
|
|
| 10) |
Aoki T, Nishikawa R, Sugiyama K, et al; NPC-08 study group. NPC-08 study group. A multicenter phase I/II study of the BCNU implant (Gliadel(®) Wafer) for Japanese patients with malignant gliomas. Neurol Med Chir (Tokyo). 2014;54(4):290-301.
|
|
| 11) |
Pallud J, Audureau E, Noel G, et al. Long-term results of carmustine wafer implantation for newly diagnosed glioblastomas: a controlled propensity-matched analysis of a French multicenter cohort. Neuro Oncol. 2015; 17(12): 1609-19.
|
|
| 12) |
Burri SH, Prabhu RS, Sumrall AL, et al. BCNU wafer placement with temozolomide (TMZ) in the immediate postoperative period after tumor resection followed by radiation therapy with TMZ in patients with newly diagnosed high-grade glioma: final results of a prospective, multi-institutional, phase II trial. J Neurooncol. 2015; 123(2) :259-66.
|
|
| 13) |
Chaichana KL, Kone L, Bettegowda C, et al. Risk of surgical site infection in 401 consecutive patients with glioblastoma with and without carmustine wafer implantation. Neurol Res. 2015;37(8):717-26.
|
|
| 14) |
Pavlov V, Page P, Abi-Lahoud G, et al. Combining intraoperative carmustine wafers and Stupp regimen in multimodal first-line treatment of primary glioblastomas. Br J Neurosurg. 2015;29(4):524-31.
|
|
| 15) |
Shah RS, Homapour B, Casselden E, et al. Delayed post-operative haemorrhage after carmustine wafer
|
|
| 16) |
Duntze J, Litré CF, Eap C, et al. Implanted carmustine wafers followed by concomitant radiochemotherapy to treat newly diagnosed malignant gliomas: prospective, observational, multicenter study on 92 cases. Ann Surg Oncol. 2013;20(6):2065-72.
|
|
| 17) |
Della Puppa A, Denaro L, Rossetto M, et al. Postoperative seizure in high-grade glioma patients treated with BCNU wafers. A mono-institutional experience. J Neurooncol. 2011;105(2):275-80.
|
|
| 18) |
Dörner L, Ulmer S, Rohr A, et al. Space-occupying cyst development in the resection cavity of malignant gliomas following Gliadel® implantation--incidence, therapeutic strategies, and outcome. J Clin Neurosci. 2011; 18(3) :347-51.
|
|
| 19) |
Bock HC, Puchner MJA, Lohmann F, et al. First-line treatment of malignant glioma with carmustine implants followed by concomitant radiochemotherapy: a multicenter experience. Neurosurg Rev. 2010;33(4):441-9.
|
|
| 20) |
Della Puppa A, Rossetto M, Ciccarino P, et al. The first 3 months after BCNU wafers implantation in high-grade glioma patients: clinical and radiological considerations on a clinical series. Acta Neurochir (Wien). 2010; 152(11): 1923-31.
|
|
| 21) |
McGovern PC, Lautenbach E, Brennan PJ, et al. Risk factors for postcraniotomy surgical site infection after 1,3-bis (2-chloroethyl)-1-nitrosourea (Gliadel) wafer placement. Clin Infect Dis. 2003;36(6):759-65.
|
|
| 22) |
Brem H, Ewend MG, Piantadosi S, et al. The safety of interstitial chemotherapy with BCNU-loaded polymer followed by radiation therapy in the treatment of newly diagnosed malignant gliomas: phase I trial. J Neurooncol. 1995;26(2):111-23.
|
|

|

|
| |
CQ3 手術後に放射線治療を行うべきか?
|

|
| |
推奨
Grade II神経膠腫
① High-risk症例*では放射線治療を行うことを推奨する。 (推奨度1C)
② Low-risk症例*では、放射線治療を行わず慎重に経過をみることを提案する 。(推奨度2C)
*High risk症例とlow-risk症例の区分については、総説の臨床予後因子の項を参照
Grade III神経膠腫
成人初発退形成性神経膠腫に対しては,放射線治療を行うことを強く推奨する。(推奨度1B)
|
|

|
| |
解説
|
| |
1. Grade II神経膠腫
Grade II神経膠腫に対して、早期照射を行うメリットは、腫瘍が縮小し、PS (performance status)や神経学的脱落症状が改善すること、また認知機能低下の原因となり得るてんかん発作が減少または消失することである1)。
EORTC22845試験では、術後早期放射線治療と経過観察後のRTが比較された。照射線量はいずれも54 Gy (1.8 Gy x 30回)で、PFS中央値は5.3年対3.4年で有意差がみられたものの(p<0.0001)、OS中央値はそれぞれ7.2年対7.4年と有意差がみられなかった(p=0.872)2)。経過観察群では70%の症例で照射が行われた。1年後のてんかん制御率はそれぞれ75%・59%と早期RT群で有意に減少することが示された。EORTC22845試験により、放射線治療は初発時に行っても生存期間が延長しないという結果から、後述するように放射線治療による認知能低下などの有害事象の割合が高くなる可能性があるならば慎重に経過観察し、再発時に放射線治療を行ってもよいのではないかという考え方が提唱され、”watch and wait” or “wait and see” approachなどと呼ばれている。EORTC22845試験はフォローアップ期間が10年未満であり、現時点では①術後早期の放射線治療、もしくは②経過観察を行い再発時に放射線治療を含めた治療、の両者(時期を問わない放射線治療)がGrade II神経膠腫に対する標準治療と考えられる。しかし、術後残存腫瘍の有無によりGrade II神経膠腫の予後が異なることはよく知られており、残存腫瘍がある場合には早期放射線治療が行われることが多い。
照射線量について、EORTC 22844試験では局所照射線量45 Gy (1.8 Gy x 25回)と59.4 Gy (1.8 Gy x 33回)を比較したが、5年PFSはそれぞれ47% vs. 50%、5年生存割合は58% vs. 59%と有意差は認められなかった3)。またNCCTG 76-72-51/RTOG/ECOG試験では50.4 Gy (1.8 Gy x 28回)と64.8 Gy (1.8 Gy x 36回)が比較されたが、5年PFSはそれぞれ55%・52%、5年生存割合は72%・65%と有意差は認められなかった4)。しかし、Grade 3~5の放射線壊死の2年累積発生率は50.4 Gyで2.5%、64.8 Gyで5.0%と線量の高い群で有意に高かった。これまでのところ、45 Gyから64.8 Gyの範囲では線量増加によるPFS/OSの改善は示されていない。最近の海外での臨床試験では1.8 Gy x 30回の54 Gyが採用されることが多く、国内での日常診療でもしばしば用いられている線量であるが、高次機能への影響を考えて45 Gyや50.4 Gyを採用している施設も少なくない。
放射線治療後にさらに認知機能が低下するという論文のほとんどは転移性脳腫瘍に対する全脳照射、あるいは神経膠腫に対しても全脳照射を行っていた時代のものであり、結果を解釈する際には注意が必要である。放射線治療による合併症のリスク因子として,年齢60歳以上,1回照射線量2 Gy以上,累積線量,放射線照射体積,多分割照射,化学療法の併用,糖尿病などの血管障害の合併、がある5, 6)。
Brownらは、NCCTG 76-72-51/RTOG/ECOG試験に登録されて50.4 Gyもしくは64.8 Gyの放射線治療を受けた低悪性度神経膠腫患者203人を対象にして、7.4年の中央値観察期間でMMSE (Mini Mental Status Examination)を用いて神経認知機能を評価した7)。腫瘍が再発していない患者の中でベースラインよりも有意に神経認知機能が低下した患者の割合は1年、2年、5年でそれぞれ8.2%、4.6%、5.3%で、ベースラインのMMSEが異常値(27点未満)の患者の大半は、治療後経過観察中にMMSEが向上していた。また、50.4 Gyと64.8 Gyで神経認知機能の変化に差はみられなかったとしている。これらの結果よりBrownらは、局所照射後も大半の患者で神経認知機能は安定していると結論している。一方、Surma-ahoらは、低悪性度神経膠腫(low-grade glioma:LGG)に対して放射線治療を行った28人(平均観察期間7年)と、手術のみで放射線治療を行わなかった23人(平均観察期間10年)について認知機能テストを行った8)。放射線治療を受けた群では、verbal IQが低い傾向にあり、performance IQやvisual memory・attentionなどが有意に低く、またKPSも術後平均94%だったのが、79%に低下したと報告した。放射線治療のうち68%が40 Gyの全脳照射と追加ブースト20-28 Gyをうけており、局所照射をうけたのは32%であった。現在一般的に行われている治療と比べて線量が高く、照射範囲も大きいことから、現在の45-54 Gyの局所照射主体の治療について、この報告に示された結果が適用できるかどうかは明らかでない。Kleinらは、放射線治療を行ったLGG 104人(局所照射が90%・全脳照射が10%)、放射線治療を受けていないLGG患者91人、非ホジキンリンパ腫・慢性骨髄性白血病などの血液がん100人について、認知機能を評価した9)。診断から調査までの平均期間はそれぞれ6.1・5.1・6.6年であった。認知機能が低下していた患者はLGG患者で66/195人(34%)、非ホジキンリンパ腫・慢性骨髄性白血病患者で22/100人(22%)とLGG患者で有意な低下が見られた。しかし、平均6年までの観察期間では、放射線治療群と放射線治療を受けていない群では認知機能の低下には有意な差が見られなかったと報告している。ただし、1回照射線量が2.1-3.0 Gyの群や抗てんかん薬を服用している患者では記憶などの認知機能が低下することが報告された。この195人のうち、さらに経過観察が行われ、再発していない患者65人について、治療開始から平均観察期間12年後の認知機能テストが行われた10)。放射線治療群33人、放射線治療を受けていない群は32人であった。前述の通り治療開始から6年までは両群では差が見られなかったが、観察期間が12年になると放射線治療を受けた群では実行機能 (Executive functioning)・情報処理速度 (Information processing speed)・注意機能 (Attentional functions)などが、放射線治療を受けていない群に比べて有意に低下することが報告された。放射線治療をうけた患者で経時的に、有意な低下を認めたものは注意機能のみであった。注意機能の低下には、年齢・腫瘍の左右差・1回線量・摘出率・抗てんかん薬の影響はなかった。この報告では65人のほとんどの患者はKPSが高く、日常生活動作(activities of daily living: ADL)が保たれて正常の生活を行っており、62/65人(95%)が自立した生活を送っていた。これまでのところ、Grade II神経膠腫に対する局所照射で長期の認知機能の低下を示した数少ない論文であるが、初期治療時には1回線量を1.8 Gyから2.0 Gyとするのが一般的であり、1回線量さえ上げなければ放射線治療による神経認知機能の低下は少ないとも考えられる。
Grade II神経膠腫において、放射線治療を少しでも遅らせる(delayed radiation)治療方針をとるのは、放射線治療により認知機能の低下を示す患者が一部にいるのがその理由の一つであるが、どの程度の患者が認知機能低下により日常生活に影響を受けるかどうかを含めて明らかになっていないことが多い。神経膠腫患者における認知機能の低下には、腫瘍の増悪や放射線治療のみだけでなく、てんかん発作を合併していることや抗てんかん薬を服用していることも関連しており10, 11)、今後さらに長期間の研究も必要である。その一方で、放射線治療によっててんかん制御率が向上することがEORTC 22845試験によって示されており2)、PSや神経学的脱落症状の改善も期待できる1)。また、遡及的解析ではあるが、切除範囲が亜全摘以下である場合には放射線治療による疾患特異的生存割合の向上が示唆される報告もあり12)、局所制御を期待して早期に放射線治療を行うことの利点も存在する。Grade II神経膠腫に対する術後放射線治療の適応は、これらの点を考慮して決定する必要がある。
Rykenらは、Grade IIびまん性神経膠腫に対する放射線治療成績の論文のシステマティックレビューを行い、その結果を報告した13)。彼らによると、切除範囲に関わらず、PFSの延長を目的とした放射線治療は推奨され、認知機能は経過観察と同等の保持が期待できるとしている。また、術後早期の放射線治療では低線量(45-50.4 Gy)でも高線量(59.4-64.8 Gy)と同等の効果が期待できて有害事象も少ないと結論づけている。さらに、全生存割合に関しては、40歳超の年齢、星細胞系の病理診断、腫瘍径6cm超、正中を超える腫瘍、術前の神経脱落症状の存在が予後不良因子で、小さい腫瘍サイズ、切除範囲、MMSE高点数が予後良好因子としている。
従って、生命予後を低下させる予後不良因子を有する症例では、局所制御によって救済治療の先送りと機能予後の向上が期待できる。以上より、Grade II神経膠腫に対して画一的に術後放射線治療を行うのは適切ではないが、high-risk症例では局所制御によって得られるメリットが大きく、術後に放射線治療を行うことが推奨される。逆にlow-risk症例では、認知機能の低下を来した場合の弊害が大きく、早期に放射線治療を行うメリットは相対的に小さいことから、放射線治療を行わず慎重に経過をみることが提案される。
神経膠腫に対する照射の方法、機器については、従来、三次元原体照射(3-dimensional conformal radiotherapy:3D- CRT)が行われてきた。一方、近年普及しつつある強度変調放射線治療(Intensity Modulated Radiation Therapy: IMRT)は、専用のコンピューターを用いて照射野の形状を変化させたビームを用い、可能な限り正常組織への照射を減らし、腫瘍の形にほぼ一致した線量分布で放射線治療を行うことができる新しい照射方法である。従来の3D-CRT法に比べて、IMRTでは海馬や大脳辺縁系など記憶や高次機能に関する部位への照射を30-50%減少させることが可能であり14)、局所照射による認知機能への影響がこれまでの報告と比較して少なくなることが期待されているが、今のところこれを証明するための前向き試験はない。
|

|
| |
システマティックレビュー結果
|
| |
このCQに応えるため、2000年1月~2019年10月の文献を対象に下記の検索式による文献検索を2019年11月に行った。
|

|
| |
| # |
検索式 |
文献数 |
| #1 |
((diffuse astrocytoma[Title/Abstract]) OR Grade II [Title/Abstract] OR low-grade [Title/Abstract] OR low-grade [Title/Abstract] ) AND ((radiation therapy) OR radiotherapy) AND (glioma[Title/Abstract] ) AND adult |
515 |
| #2 |
"2000/01/01"[Date - Create] : "2019/10/31"[Date - Create] |
17449000 |
| #3 |
#1 and #2 |
410 |
|
| |
以上の検索式より、一次スクリーニングとして52の文献を抽出し、ハンドサーチによる3の文献を加え、最終的に下記に示した14の文献を抽出した。
|

|
| |
| 文献 |
| 1) |
Singer JM. Supratentorial low-grade gliomas in adults. A retrospective analysis of 43 cases treated with surgery and radiotherapy. Eur J Surg Oncol. 1995;21(2):198-200.
|
|
| 2) |
van den Bent MJ, Afra D, de Witte O, et al; EORTC Radiotherapy and Brain Tumor Groups and the UK Medical Research Council. Long-term efficacy of early versus delayed radiotherapy for low-grade astrocytoma and oligodendroglioma in adults: the EORTC 22845 randomised trial. Lancet. 2005;366(9490):985-90.
|
|
| 3) |
Karim AB, Maat B, Hatlevoll R, et al. A randomized trial on dose-response in radiation therapy of low-grade cerebral glioma: European Organization for Research and Treatment of Cancer (EORTC) Study 22844. Int J Radiat Oncol Biol Phys. 1996;36(3):549-56.
|
|
| 4) |
Shaw E, Arusell R, Scheithauer B, et al. Prospective randomized trial of low- versus high-dose radiation therapy in adults with supratentorial low-grade glioma: initial report of a North Central Cancer Treatment Group/Radiation Therapy Oncology Group/Eastern Cooperative Oncology Group study. J Clin Oncol. 2002;20(9):2267-76.
|
|
| 5) |
Crossen JR, Garwood D, Glatstein E, et al. Neurobehavioral sequelae of cranial irradiation in adults: a review of radiation-induced encephalopathy. J Clin Oncol. 1994;12(3):627-42.
|
|
| 6) |
Lee AW, Kwong DL, Leung SF, et al. Factors affecting risk of symptomatic temporal lobe necrosis: significance of fractional dose and treatment time. Int J Radiat Oncol Biol Phys. 2002;53(1):75-85.
|
|
| 7) |
Brown PD, Buckner JC, O'Fallon JR, et al. Effects of radiotherapy on cognitive function in patients with low-grade glioma measured by the folstein mini-mental state examination. J Clin Oncol. 2003;21(13):2519-24.
|
|
| 8) |
Surma-aho O, Niemela M, Vilkki J, et al. Adverse long-term effects of brain radiotherapy in adult low-grade glioma patients. Neurology. 2001;56(10):1285-90.
|
|
| 9) |
Klein M, Heimans JJ, Aaronson NK, et al. Effect of radiotherapy and other treatment-related factors on mid-term to long-term cognitive sequelae in low-grade gliomas: a comparative study. Lancet. 2002;360(9343):1361-8.
|
|
| 10) |
Douw L, Klein M, Fagel SS, et al. Cognitive and radiological effects of radiotherapy in patients with low-grade glioma: long-term follow-up. Lancet Neurol. 2009;8(9):810-8.
|
|
| 11) |
Klein M, Engelberts NHJ, van der Ploeg HM, et al. Epilepsy in low-grade gliomas: the impact on cognitive function and quality of life. Ann Neurol. 2003;54(4):514-20.
|
|
| 12) |
Hanzely Z, Polgar C, Fodor J, et al. Role of early radiotherapy in the treatment of supratentorial WHO Grade II astrocytomas: long-term results of 97 patients. J Neurooncol. 2003;63(3):305-12.
|
|
| 13) |
Ryken TC, Parney I, Buatti J, et al. The role of radiotherapy in the management of patients with diffuse low-grade glioma: A systematic review and evidence-based clinical practice guideline. J Neurooncol. 2015;125(3):551-83.
|
|
| 14) |
Marsh JC, Godbole R, Diaz AZ, et al. Sparing of the hippocampus, limbic circuit and neural stem cell compartment during partial brain radiotherapy for glioma: a dosimetric feasibility study. J Med Imaging Radiat Oncol. 2011;55(4):442-9.
|
|

|

|
| |
2. Grade III神経膠腫
|
| |
1990年代前半までは、ほぼすべての臨床研究が、Grade IVの膠芽腫とGrade IIIの退形成性神経膠腫を含む悪性神経膠腫を対象としてきた。WalkerらBrain Tumor Study Group (BTSG)は、悪性神経膠腫303例に対して、手術のみ(Best Supportive Care: BSC)、術後カルムスチン(carmustine:BCNU)化学療法のみ、術後放射線治療のみ、術後放射線治療とカルムスチン化学療法併用、の4群によるランダム化比較試験を行った。主解析において、放射線を含む後者2治療群は、BSCに対して統計学的に有意に生存期間を延長した(生存期間中央値14週、18.5週、36週、34.5週)1)。同グループは、続いて、悪性神経膠腫467例に対して、術後補助療法としてsemustine(methyl-CCNU)化学療法単独群、放射線治療(全脳照射60 Gy)単独群、放射線治療+カルムスチン群,放射線治療+semustine群の4群でのランダム化比較試験を行い、semustine化学療法単独群に対して他の放射線治療を含む3群が統計学的に有意に生存期間を延長したことを報告した2)。ただし、これら2論文における対象疾患は、80~90%が膠芽腫、約10%が退形成性神経膠腫であり、Grade IIIのみを対象とした、術後BSCと放射線治療を比較した臨床試験は存在しない。一方、より悪性度の低いGrade II神経膠腫に対して、術後経過観察に対する術後放射線治療の有効性(PFS延長効果)は示されているため3)、Grade III神経膠腫に対する放射線治療の有効性も明白と考えられる。
照射範囲を検討するための情報としては、Hochbergらは、膠芽腫の再発の90%は、原発巣(摘出腔と思われる)から2 cm 以内に生じると報告し4)、またHalperinらは膠芽腫剖検脳と死亡前CT所見とを対比した研究を行い、11 例全例で組織学的腫瘍進展範囲はCTでの浮腫域+3 cmマージンの範囲内であったことを示した5)。一方、複数の局所照射に関するコホート研究において、局所照射による治療成績が全脳照射に劣らないことが示唆されている6, 7)。また悪性神経膠腫(80%が膠芽腫)を対象とした全脳照射の後半で照射野を絞り込む照射方法(全脳43 Gy + ブースト17.2 Gy)と全脳照射(60.2 Gy)を比較したランダム化比較試験では、生存期間に差は認められなかった8)。全脳照射と局所照射を比較した臨床試験は存在しないものの、これらの知見、および全脳照射による高次脳機能障害に対する懸念から、現在では、悪性神経膠腫(Grade III・IV)に対しては、CTやMRIにおける造影領域と周囲浮腫あるいは腫瘍浸潤域(T2/FLAIR高信号域)に2 cm程度のマージンを付加した領域を臨床標的体積( Clinical Target Volume:CTV)とする拡大局所照射が標準照射法となっているが、より狭いCTV設定も行われている9)。
照射線量に関して、Changらは、悪性神経膠腫(Grade III・IV)を対象としてランダム化比較試験を行い、全脳照射60 Gyと全脳60 Gy + ブースト照射10 Gyで、生存期間に有意差を認めなかった10)。一方東京大学のグループは,初発悪性神経膠腫に対する通常分割高線量照射(2 Gy/分割. 拡大局所照射. T2 + 2 cmから絞込み、腫瘍床80~90 Gy)の観察研究を行い、退形成性星細胞腫(Grade III)、膠芽腫(Grade IV)いずれにおいても、生命予後延長の可能性を示唆した。しかし、高線量群(1990年から2002年)に比べてhistorical controlとした通常照射群(2 Gy/分割. 全脳から絞込み、腫瘍床60 Gy)が古い症例(1979~1989年)であるという問題があり、また高線量群では通常照射群に比べて白質障害が高頻度に観察された11)。よって、高齢者を除く初発成人退形成性神経膠腫に対しては、膠芽腫と同様に、約60 Gyを1.7~2.0 Gy/分割で照射する方法が標準的と考えられ 2, 8)、実際に近年の退形成性神経膠腫に対する臨床試験では、拡大局所照射59.4 Gy/33分割(1.8 Gy/分割, T2高信号域 + 2cmマージンなど)あるいは60 Gy/30分割が用いられている12-15)。
Grade IIの項でも記載したが、照射の方法、機器については一般的な三次元原体照射(3D-CRT)に加え、強度変調放射線治療(Intensity Modulated Radiation Therapy:IMRT)が用いられるようになった。3D-CRTとIMRTでは、腫瘍部位への投与線量は変わらないため抗腫瘍効果に差はないと考えられるが、正常脳への照射線量を減少させることによる高次機能低下などの晩期有害事象の軽減は期待できる。現時点でこれらを比較した前向き研究はない。
退形成性神経膠腫のなかで、WHO 2016分類における退形成性乏突起膠腫(anaplastic oligodendroglioma, IDH-mutant, 1p/19q-codeleted)は、化学療法の有効性が高いことが知られている。Lassmanらによる1000例の(形態学的)退形成性乏突起膠腫における後方視的解析16)、退形成性神経膠腫に対する放射線単独治療と化学療法単独治療を比較したランダム化比較試験(NOA-04試験)などにおいて17)、PCV療法単独治療による治療成績は放射線単独治療に劣らなかった(無増悪生存期間:PCV 9.4年, 放射線単独 8.7年)。現在フランスにおいて、退形成性乏突起膠腫に対して、放射線治療とPCV療法の併用療法(標準治療)と、PCV療法単独治療(初期治療において放射線を温存)を比較する第III相臨床試験が行われている(NCT02444000)。従って、退形成性乏突起膠腫においては初期治療として放射線治療を行わず、化学療法を行うことが選択肢として考慮される可能性があるが、現時点ではそれを支持するレベルの高いエビデンスはない。
[注意]
カルムスチン(carmustine:BCNU):注射薬は国内未承認,徐放性ポリマーは悪性神経膠腫に対して承認済み。
semustine: (methyl-CCNU):国内未承認。
PCV療法:プロカルバジン、lomustine、ビンクリスチンの組み合わせ。lomustine:CCNUは国内未承認。
|

|

|
| |
システマティックレビュー結果
|
| |
このCQに応えるため、2000年1月~2019年10年31日の文献を対象に下記の検索式による文献検索を2019年11月に行った。
|

|
| |
| # |
検索式 |
文献数 |
| #1 |
PubMed
("Glioma/radiotherapy"[Mesh:NoExp] OR "Astrocytoma/radiotherapy"[Mesh] OR "Oligodendroglioma/radiotherapy"[Mesh] OR "Ependymoma/radiotherapy"[Mesh]) OR ((malignant[tiab] OR anaplastic[tiab]) AND (glioma*[tiab] OR astrocytoma*[tiab] OR oligoastrocytoma*[tiab] OR oligodendroglioma*[tiab] OR ependymoma*[tiab])) AND ("Radiotherapy"[Mesh] OR radiotherap*[tiab] OR radiosurger*[tiab] OR radiation*[tiab]) AND ("Postoperative Care"[Mesh] OR "Postoperative Period"[Mesh] OR postoperative[tiab] OR "after surgery"[tiab]) AND (Randomized Controlled Trial[pt] OR Controlled Clinical Trial[pt] OR randomized[tiab] OR randomised[tiab] OR randomly[tiab] OR trial[tiab] OR trials[tiab]) AND (1980/01/01[dp]:2019/10/31[dp]) AND English[la]
|
210 |
| #2 |
Cochrane
2 MeSH descriptor: [Glioma] explode all trees and with qualifier(s): [Radiotherapy - RT]
3 malignant:ti,ab,kw (Word variations have been searched)
4 anaplastic:ti,ab,kw (Word variations have been searched)
5 #3 or #4
6 glioma*:ti,ab,kw (Word variations have been searched)
7 astrocytoma*:ti,ab,kw (Word variations have been searched)
8 oligoastrocytoma*:ti,ab,kw (Word variations have been searched)
9 oligodendroglioma*:ti,ab,kw (Word variations have been searched)
10 ependymoma*:ti,ab,kw (Word variations have been searched)
11 #6 or #7 or #8 or #9 or #10
12 #5 and #11
13 #2 or #12
14 MeSH descriptor: [Radiotherapy] explode all trees
15 radiotherap*:ti,ab,kw (Word variations have been searched)
16 radiation:ti,ab,kw (Word variations have been searched)
17 #14 or #15 or #16
18 MeSH descriptor: [Postoperative Care] explode all trees
19 MeSH descriptor: [Postoperative Period] explode all trees
20 postoperative:ti,ab,kw (Word variations have been searched)
21 "after surgery":ti,ab,kw (Word variations have been searched)
22 #18 or #19 or #20 or #21
23 #13 and #17 and #22
24 #23 not pubmed
|
48 |
| #3 |
#2 in Trials with Cochrane Library publication date to Oct 2019 |
47 |
| #4 |
#2 in Cochrane Reviews with Cochrane Library publication date to Oct 2019 |
1 |
|
| |
以上の検索式より、一次スクリーニングとして258の文献を抽出し、最終的に下記に示した17の文献を抽出した。ただし、化学療法の有効性に関する記述における引用文献はハンドサーチによる。
|

|
| |
| 文献 |
| 1) |
Walker MD, Alexander E Jr, Hunt WE, et al. Evaluation of BCNU and/or radiotherapy in the treatment of anaplastic gliomas. A cooperative clinical trial. J Neurosurg. 1978; 49(3): 333-43.
|
|
| 2) |
Walker MD, Green SB, Byar DP, et al. Randomized comparisons of radiotherapy and nitrosoureas for the treatment of malignant glioma after surgery. N Engl J Med.1980; 303(23): 1323-9.
|
|
| 3) |
van den Bent MJ, Afra D, de Witte O, et al. Long-term efficacy of early versus delayed radiotherapy for low-grade astrocytoma and oligodendroglioma in adults: the EORTC 22845 randomised trial. Lancet. 2005; 366(9490): 985-90.
|
|
| 4) |
Hochberg FH, Pruitt A. Assumptions in the radiotherapy of glioblastoma. Neurology. 1980; 30(9): 907-11.
|
|
| 5) |
Halperin EC, Bentel G, Heinz ER, et al. Radiation therapy treatment planning in supratentorial glioblastoma multiforme: an analysis based on post mortem topographic anatomy with CT correlations. Int J Radiat Oncol Biol Phys. 1989; 17(6): 1347-50.
|
|
| 6) |
Ramsey RG, Brand WN. Radiotherapy of glioblastoma multiforme. J Neurosurg. 1973; 39(2): 197-202.
|
|
| 7) |
Schryver AD, Greitz T, Forsby N, et al. Localized shaped field radiotherapy of malignant glioblastoma multiforme. Int J Radiat Oncol Biol Phys. 1976;1(7-8): 713-6.
|
|
| 8) |
Shapiro WR, Green SB, Burger PC, et al. Randomized trial of three chemotherapy regimens and two radiotherapy regimens in postoperative treatment of malignant glioma. Brain Tumor Cooperative Group Trial 8001. J Neurosurg. 1989; 71(1): 1-9.
|
|
| 9) |
Cabrera AR, Kirkpatrick JP, Fiveash JB, et al. Radiation therapy for glioblastoma: Executive summary of an American Society for Radiation Oncology Evidence-Based Clinical Practice Guideline. Pract Radiat Oncol. 2016; 6(4): 217-25.
|
|
| 10) |
Chang CH, Horton J, Schoenfeld D, et al. Comparison of postoperative radiotherapy and combined postoperative radiotherapy and chemotherapy in the multidisciplinary management of malignant gliomas. A joint Radiation Therapy Oncology Group and Eastern Cooperative Oncology Group study. Cancer. 1983; 52(6): 997-1007
|
|
| 11) |
Tanaka M, Ino Y, Nakagawa K, et al. High-dose conformal radiotherapy for supratentorial malignant glioma: a historical comparison. Lancet Oncol. 2005; 6(12): 953-60
|
|
| 12) |
Cairncross G, Berkey B, Shaw E, et al. Phase III trial of chemotherapy plus radiotherapy compared with radiotherapy alone for pure and mixed anaplastic oligodendroglioma: Intergroup Radiation Therapy Oncology Group Trial 9402. J Clin Oncol. 2006; 24(18): 2707-14
|
|
| 13) |
van den Bent MJ, Carpentier AF, Brandes AA, et al. Adjuvant procarbazine, lomustine, and vincristine improves progression-free survival but not overall survival in newly diagnosed anaplastic oligodendrogliomas and oligoastrocytomas: a randomized European Organisation for Research and Treatment of Cancer phase III trial. J Clin Oncol. 2016; 24(18): 2715-22.
|
|
| 14) |
Wick W, Hartmann C, Engel C, et al. NOA-04 randomized phase III trial of sequential radiochemotherapy of anaplastic glioma with procarbazine, lomustine, and vincristine or temozolomide. J Clin Oncol. 2009; 27(35): 5874-80.
|
|
| 15) |
van den Bent MJ, Baumert B, Erridge SC, et al. Interim results from the CATNON trial (EORTC study 26053-22054) of treatment with concurrent and adjuvant temozolomide for 1p/19q non-co-deleted anaplastic glioma: a phase 3, randomised, open-label intergroup study. Lancet. 2017; 390(10103): 1645-53.
|
|
| 16) |
Lassman AB, Iwamoto FM, Cloughesy TF, et al. International retrospective study of over 1000 adults with anaplastic oligodendroglial tumors. Neuro Oncol. 2011; 13(6): 649-59.
|
|
| 17) |
Wick W, Roth P, Hartmann C, et al. Long-term analysis of the NOA-04 randomized phase III trial of sequential radiochemotherapy of anaplastic glioma with PCV or temozolomide. Neuro Oncol. 2016;18(11):1529-37.
|
|

|

|
| |
CQ4 手術後に化学療法を行うべきか?
|

|
| |
推奨
Grade II神経膠腫
①High risk症例*では、術後薬物療法を推奨する。(推奨度1C)
②Low risk症例*では術後、薬物療法を待機しても良い。(推奨度1C)
*High risk症例とlow-risk症例の区分については、総説の臨床予後因子の項を参照
Grade III神経膠腫
Grade III神経膠腫に対しては術後薬物療法を推奨する。(推奨度1B)
|
|

|
| |
解説
|
| |
1. 薬物療法のレジメンについて
現在Grade II・III神経膠腫に対して高いエビデンスレベルで有効性が確認されている化学療法のレジメンはテモゾロミドの単独療法と、プロカルバジン(PCZ)+lomustine(CCNU)+ビンクリスチン(VCR)の3剤併用療法(PCV療法)である。本邦ではテモゾロミド(TMZ)の適応疾患は悪性神経膠腫に限られているが、highriskのGrade IIのびまん性神経膠腫は悪性神経膠腫として治療されることが多い。しかし、lomustineは本邦では未承認であるため、lomustineを同じニトロソウレア系薬剤であるニムスチン (ACNU)に変更したPAV療法を代替レジメンとすることが一般的である。悪性星細胞腫、乏突起膠腫成分を有する神経膠腫に対するプロカルバジンは、ニムスチン、ビンクリスチンとの併用療法を行う場合に適応となる薬剤として認可されている。PAV療法とPCV療法が同様の効果を示すかどうかについて直接比較する研究は本邦では不可能で、かつ存在しないが、実臨床では一般的に用いられ、Iwadateら、Sasakiらの報告などでも乏突起膠腫の治療において、PCVに準ずると思われる効果が期待できることが示唆されている1, 2)。
したがって、本邦ではGrade II・III神経膠腫に対する化学療法は、TMZ単独療法とPAV療法が中心となるレジメンであると考えられる。
2. Grade II神経膠腫
びまん性神経膠腫は脳実質内に発生し、浸潤性に進展する性格を有する悪性腫瘍であるため、原則として摘出のみ、あるいは照射のみでは腫瘍細胞すべてを治療することはできない。そのため、中枢神経系に到達性の良い抗がん薬等の薬物療法が治療上重要な位置づけにある。しかし、血液脳関門の透過性が良く、殺腫瘍細胞効果の高い薬剤が少ないこと、また神経膠腫の年間発生数が国内で約5,000人程度と稀少がんであることなどから、検証的第III相試験によりびまん性神経膠腫に薬物療法の有効性が示されたのは、2005年に報告された膠芽腫に対するTMZが最初であった3)。
本稿の対象は、WHO 2016分類によるびまん性神経膠腫、Grade IIであるが、今回のガイドライン作成の対象論文(試験)は、いずれもWHO 2007分類、あるいはそれ以前の診断基準をもとにして対象腫瘍型が定められている点に留意が必要である。しかし、サブグループ解析としてIDH変異と1p/19q共欠失を検索し、その結果による分類での有効性解析を行っている場合もあり、参考とした。
びまん性神経膠腫(Grade II)に対して、症状が軽く(けいれん発作のみなど)、若年者(通常40 ~45歳以下)であり、病巣(通常MRIでのT2/FLAIR画像上の腫瘍部高信号域)が肉眼的全摘( gross total resection:GTR) された場合、早期の再発リスクは低いことから4)、術後放射線治療および薬物療法は施行せず、経過観察(”watch and wait”)する方針が一般的には行われている5)。ただし、術前腫瘍サイズが大きい場合や星細胞腫系腫瘍の場合は、早期再発のリスクが高い可能性がある4)。
近年、びまん性神経膠腫(Grade II)を対象とした術後薬物療法を放射線治療単独療法と比較検証する第III相試験が2件報告された。
米国のRTOGは、“ハイリスク”の初発びまん性神経膠腫(Grade II)(WHO 2007分類で、DA、OA、OL)を対象として、術後放射線治療(54 Gy/30 回分割)単独と放射線治療後に補助療法としてPCV療法を6サイクル行う(RT+PCV)併用療法のランダム化第III相比較試験を行った(RTOG9802試験)6)。この試験で“ハイリスク”とは、40歳未満の非全摘例、または40歳以上で全摘出術を含めた手術例を指す。この第III相試験は、2003年に報告されたBucknerらのOL/OAを対象とした術後照射前のPCV療法の第II相試験7)の後に開始された。1998年~2002年に251例が登録され、年齢中央値41歳、DAが26%、OLが43%、OAが15%、半数でIDH R132H変異が調べられており、63%がIDH変異型、37%がIDH野生型であった。1p/19qの解析は標本量不足のため63例(25%)でしか施行できなかった。また全摘例は10%であった。2012年に報告された規定の解析結果ではイベント数が有効域に達しなかったため、追跡期間中央値11.9年と長期追跡後の再解析が行われた。その結果、全生存期間中央値(mOS)は、PCV併用群で13.3年、RT単独群で7.8年と有意にPCV併用群で延長した( HR=0.59、P = 0.003)8)。無増悪生存期間は中央値(mPFS)が各10.4年 vs. 4.0年と同様に有意に併用療法で延長した(HR=0.50、P < 0.001)。腫瘍組織型によるサブグループ解析でも、OLおよびOAではOS/PFSともに有意にPCV群が良好であり、DAでも同様の傾向が特にPFSにおいて認められた(PFS P = 0.06)。分子分類では、IDH R132H変異を認めた患者群(計71例)では、よりPCV併用による予後改善が認められた(PFS: P < 0.001、OS: P = 0.02)。有害事象としては両群とも軽度の倦怠感、食欲不振、嘔気・嘔吐が好発し、PCV併用群にGrade 3の好中球減少、血小板減少が2-3割で認められたが、二次発がんは認めなかった6)。
欧州のEuropean Organisation for Research and Treatment of Cancer(EORTC)は、他の臨床試験グループのCanadian Cancer Trials Group(CTG)、Trans Tasman Radiation Oncology Group(TROG)、Medical Research Council(MRC)と共同で、“ハイリスク”の初発びまん性神経膠腫(Grade II)に対するRT単独と用量強化テモゾロミド(dose-dense temozolomide; ddTMZ)療法を比較する第III相試験(EORTC22033-26033試験)を実施した8)。この試験における“ハイリスク”とは、40歳超、腫瘍増悪あり、腫瘍サイズ5 cm以上、対側への進展あり、神経症状あり、のいずれかの項目が認められる場合と定義された。19ヶ国より2005年~2010年までに登録された患者のうち、477例(年齢中央値44歳)がRT(50.4 Gy/28回分割)単独、またはddTMZ(75 mg/m2/dayを21日間連日服用、7日間休薬のサイクルを最大12サイクル。本邦未承認用法)療法にランダムに割り付けられた。組織型は、DA 35%、OL 40%、OA 25%、IDH解析は82%で、1p/19q解析は75%の患者で行われ、IDH変異が69%、1p19q共欠失が25%でみられた。追跡期間中央値48か月で、mPFSはddTMZ群で39か月、RT群で46か月(HR=1.16、p = 0.22)と有意差を認めず、mOSは未到達であった。探索的な解析として、分子分類ができた患者は318例あり(67%)、IDH変異+共欠失(すなわちWHO 2016分類でのOL, IDH変異および1p/19q 共欠失に該当)に対して、IDH変異+非共欠失(すなわちDA, IDH変異に該当)(HR=1.51、P = 0.018)、IDH野生型(すなわちDA, IDH野生型)(HR=4.08、P < 0.0001)はPFSが有意に不良であった(全体でP = 0.013)。さらに、DA, IDH変異(1p/19q 非共欠失)では、RT単独がddTMZに比べ有意にPFSが延長したが(HR=1.86, P = 0.0043)、他の群(IDH変異+共欠失群、IDH野生型群)では有意差はみられなかった。有害事象としては、Grade 3/4の血液毒性がddTMZ群の14%に認めたのに対してRT群では1%未満であった。OSに関してはデータベースロック時点でのイベントが少なく、結論は得られていない8)。同様のTMZ単独療法の探索的な第II相試験が米国から報告されており、別のddTMZ療法(75 mg/m2/dayを7週間服用後4週間休薬、計最大6サイクル。本邦未承認用法)をMIB-1 indexが5%以上の初発びまん性神経膠腫(Grade II)または薬物療法未施行の再発例を対象として、44例(年齢中央値43歳)が治療された。DAは14%で、全例再発例であった。放射線治療既施行例が12例(27%)含まれた。観察期間中央値39.4カ月で 、部分奏効(partial response: PR)20%、不変(stable disease: SD)75%、増悪(progressive disease:PD)5%、mPFSは38カ月 であった。18例(41%)の初発例が再発例より有意にPFSが延長した(HR=0.35、P = 0.03)9)。
標準量のTMZ単独療法は、英国のBradaらが2003年にびまん性神経膠腫(Grade II)に対しての第II相試験を報告している10)。1998年~2000年までに30例(年齢中央値40歳、内訳DA 17例、OL 11例、OA 2例)が登録され、初回手術後(中央値23カ月、2~104カ月 )TMZ単独標準用法(200 mg/m2/day、5日間、28日サイクル、計12サイクル)で治療された。追跡期間中央値3年で、評価可能29例中PR 3例、SD 25例、PD 1例、3年PFS割合66%、3年OS割合82%であった10)。
さらに米国のUCSFのグループが、その後同様の術後残存腫瘍のあるびまん性神経膠腫(Grade II)を対象として、術後TMZ単独療法の単アーム第II相試験を実施した11)。2000年~2013年までに120例(年齢中央値39歳、内訳DA 36%、OL 48%、OA 17%)が登録され、97例で分子診断が可能で、1p/19q共欠失37%、IDH変異および1p/19q非共欠失31%、IDH野生型13%、不明19%であった。追跡期間中央値7.5年で、奏効割合6%、mPFS 4.2年、mOS 9.7年であった。PFS、OSとも分子分類により有意差を認め(各P = 0.07、P < 0.001)、mPFSおよびmOSは、共欠失で各4.9年、9.7年、IDH変異および1p/19q非共欠失で各3.6年、11.2年、IDH野生型で各0.6年、1.8年と、前2者で類似であったのに対し、IDH野生型で最も不良であった。OL(共欠失型)ではTMZ治療中に増悪は認めなかった。一方、組織型ではOSのみ有意差がみられた(P = 0.01)。
TMZと放射線治療を併用するStuppレジメンの有効性を“ハイリスク”びまん性神経膠腫(Grade II)に対して探索した単アームの第II相試験(RTOG0424試験)が報告された12)。ここでの“ハイリスク”とは、術後早期照射と増悪後の照射を比較した第III相試験(EORTC22845試験)のサブグループ解析により予後因子として抽出されたPignattiの5因子(年齢40歳以上、組織型がastrocytoma、対側への進展あり、術前腫瘍径が6 cm以上、神経症状あり)13)のうち、3項目以上を認める場合と定義された。2005年から2009年までに129例が登録され、年齢中央値49歳、組織型はDA 55%、OL 22.5%、OA 22.5%であった。分子分類の検討はされていない。54 Gy/30回分割のRTとTMZの併用療法後、TMZ維持療法が最大12サイクル施行された。追跡期間中央値4.1年で、3年OS割合が73.1%で、ヒストリカルコントロールと比較して有意に延長(P < 0.001)し、mOSは未到達であった。3年PFS割合は59.2%、mPFSは4.5年であった。Grade 3/4の有害事象は各43%/10%の患者に認められた12)。
このように、近年Grade IIの初発びまん性神経膠腫に対しても、複数の前向き試験が実施され、薬物療法の意義が明らかとなってきた。これらの試験結果を解釈する際に留意しなければならない点として、試験毎に“ハイリスク”の定義が異なること、登録された組織型の割合が異なること、試験が開始された時点はWHO 2016分類が発表される前であり、副次的解析を含めても分子分類が十分に行われていない試験が多く、現在診断される各腫瘍型に対する治療法は純粋には検証されていないこと、などが挙げられ、各試験間の結果を比較検討することはできない。
しかし、そのうえで上記試験結果をまとめると、①RT単独療法とTMZ単独療法によるmPFSは概ね3~5年程度であった、②組織型ではOLで治療後の予後が良好であり、分子分類ではIDH野生型では薬物単独療法の予後が不良であった、③ OL特にIDH変異および1p/19q共欠失型に対しては、PCVの上乗せ効果が高かった、④IDH野生型ではRT/PCV併用療法でもPCVの上乗せ効果は不十分であり、その多くが遺伝子異常プロファイルからは膠芽腫と同様な腫瘍であることから14)、膠芽腫に準じた治療を適用する場合がある。欧州では2017年にWHO 2016分類を反映した成人星細胞腫・乏突起膠腫に対する診療ガイドラインが発表されている5)。
BellらによるRTOG9802試験の分子サブタイプ解析の報告では、試験登録251名中106名(42%)でIDH変異及び1p/19q共欠失の解析が実施され、24%がIDH野生型、41%がIDH変異および共欠失、35%がIDH変異型および1p/19q共欠失であった。IDH変異および共欠失では、PCV追加群でPFS(P<0.001)、OS(P=0.029)と、またIDH変異および1p/19q非共欠失では、PCV追加群でPFS(P=0.003)、OS(P=0.013)とともに有意に延長がみられた。一方、IDH野生型では、PCVの追加の有無OS/PFSともに有意差は認められなかった。したがって、WHO 2016分類でのDA, IDH変異およびOL, IDH変異および1p/19q共欠失ではRT+PCVなどの化学療法が推奨される15)。
化学療法のレジメンとして、RTOG9802試験で有効性のエビデンスが示されたPCV療法が推奨されるのか、膠芽腫の標準治療薬であるTMZで代替することが許容される、あるいはより有効であるのか、は未解決な問題である。現在欧州で、1p19q共欠失のあるGrade III AOを対象として、RT + PCVとRT + TMZ(PCVは照射後の維持療法、TMZは照射併用+照射後の維持療法)を比較する第III相試験(CODEL)が実施されており、途中からプロトコール改正にて、対象にGrade II OLが追加されたことから、この論点に対する検証的答えが得られることが期待されている。
これまでのところでは、ハイリスクのGrade IIびまん性神経膠腫に対しての後方視的解析で、有意差はないもののPCVの方が、TMZよりOS、無増悪期間( time to progression:TTP )がともに延長する傾向があったとの報告がある16)。
比較的若年層に好発するびまん性神経膠腫(Grade II)においては、高悪性度神経膠腫( high-grade glioma:HGG) (Grade III・IV)と比べ長期生存の割合が多いことから、治療に伴う晩期合併症に関しても留意が必要となる。特にTMZ、PCZなどのアルキル化剤を使用する薬物療法では、血液毒性を中心とする治療中の急性の有害事象に加え、長期的な有害事象として、妊孕性低下17)、白血病等の二次発がんのリスク増加18)が知られている。放射線治療では、晩期白質障害に伴う認知機能障害や健康関連QOLの低下が懸念されるが、薬物療法によって同様の長期的影響の有無が生じるかどうか、十分な検討がなされていないのが現状である。
注目すべきは、特にDAに対するTMZ療法後に、悪性転化を伴う高頻度の点突然変異を来す"hypermutator"形質の出現の可能性が報告されていることである19,20)。これはTMZの抗腫瘍作用機序の主体を構成するミスマッチ修復機構(mismatch repair; MMR)の異常によって生じると考えられている。このhypermutator形質がどのような割合で、どのような腫瘍型に生じるのか、またその形質への変化が予後にどのように影響するかなど、不明の点が多く、前向きな検討は上記試験のサブグループ解析でもこれまでのところ報告されていない。
[注意]
テモゾロミドの本邦での適応は悪性神経膠腫であり、Grade II神経膠腫に対しても日常診療で使用されているものの、厳密には適応外使用であり支払基金により査定されることがある。
|

|
| |
システマティックレビュー結果
|
| |
このCQに応えるため、2000年1月~2019年10月の文献を対象に下記の検索式による文献検索を2019年11月に行った。
|

|
| |
| # |
検索式 |
文献数
(2018.4.25まで) |
文献数
(2019.10.31まで) |
| |
データベースPubMed |
| #1 |
oligodendroglioma[Mesh] OR astrocytoma[Mesh] OR oligoastrocytoma[Mesh] |
33,741 |
34,351 |
| #2 |
oligodendroglioma[tiab] OR astrocytoma[tiab] OR oligoastrocytoma[tiab] OR glioma[tiab] |
48,242 |
48,242 |
| #3 |
(anaplastic[tiab] AND malignant[tiab]) |
4,024 |
4,226 |
| #4 |
(#1 OR #2) NOT #3 |
67,133 |
75,302 |
| #5 |
(chemotherapy OR pharmacotherapy OR drug therapy) |
3,0501,600 |
3,308,830 |
| #6 |
#4 AND #5 |
16,881 |
19,509 |
| #7 |
glioblastoma[mh] |
21,159 |
24,267 |
| #8 |
#6 NOT #7" |
9,687 |
10,986 |
| #9 |
"high-grade" |
49,896 |
56,653 |
| #10 |
#8 NOT #9 |
8,594 |
9,730 |
| #11 |
adult[mh] |
6,514,297 |
7,030,654 |
| #12 |
#10 AND #11 |
1,847 |
2,025 |
| #13 |
Filters: Meta-Analysis; Randomized Controlled Trial; Systematic Reviews; Clinical Trial |
396 |
|
| (Meta-Analysis[ptyp] OR Randomized Controlled Trial[ptyp] OR systematic[sb]) |
|
904,944 |
| #14 |
#12 AND #13 |
|
90 |
| #15 |
2018/04/26:2019/10/31 [edat] |
|
1,805,240 |
| #16 |
#14 AND #15 |
|
1 |
| |
データベース:Cochrane |
| #1 |
MeSH descriptor: [Oligodendroglioma] explode all trees |
41 |
56 |
| #2 |
oligodendroglioma |
128 |
209 |
| #3 |
MeSH descriptor: [Astrocytoma] explode all trees |
418 |
643 |
| #4 |
astrocytoma |
383 |
553 |
| #5 |
oligodendroglioma or astrocytoma or oligoastrocytoma or glioma |
1,328 |
1,930 |
| #6 |
#1 or #2 or #3 or #4 or #5 |
1,567 |
2,332 |
| #7 |
anaplastic and malignant |
151 |
224 |
| #8 |
#6 not #7 |
1,477 |
2,200 |
| #9 |
chemotherapy or pharmacotherapy or drug therapy |
383,974 |
462,342 |
| #10 |
#8 and #9 |
888 |
1,240 |
| #11 |
MeSH descriptor: [Glioblastoma] explode all trees |
348 |
557 |
| #12 |
glioblastoma |
1,185 |
2,055 |
| #13 |
#11 or #12 |
1,185 |
2,055 |
| #14 |
#10 not #13 |
426 |
609 |
| #15 |
"high-grade" |
2,989 |
4,022 |
| #16 |
#14 not #15 |
335 |
472 |
| #17 |
pediatric |
32,800 |
50,489 |
| #18 |
#16 not #17 |
269 |
|
| #19 |
18 limit Cochrane Reviews |
11 |
|
| #20 |
#18 limit Trials |
242 |
|
| #16 not #17 with Publication Year from 2018 to 2019, in Trials |
|
43 |
| #16 not #17 with Cochrane Library publication date Between May 2018 and 2019, in Cochrane Reviews |
|
4 |
| |
データベース:医中誌 |
| #1 |
(乏突起神経膠腫/TH or 乏突起神経膠腫/AL) or (星状細胞腫/TH or 星状細胞腫/AL) or (神経膠腫/TH or 神経膠腫/AL) |
21,100 |
21,336 |
| #2 |
(膠芽腫/TH or 膠芽細胞腫/AL) |
3,369 |
3,675 |
| #3 |
#1 not #2 |
16,750 |
17,6856 |
| #4 |
(#3) and (PT=原著論文) |
4,093 |
4,281 |
| #5 |
(#4) and (SH=薬物療法) |
352 |
374 |
| #6 |
(#5) and (CK=成人(19~44),中年(45~64),高齢者(65~),高齢者(80~)) |
93 |
105 |
| #7 |
(#6) and (PT=症例報告除く) |
43 |
49 |
| (#7) and (DT=2018:2019) |
|
3 |
|
|
以上の検索式より、一次スクリーニングとして561の文献を抽出し、抽出後追加文献を3件加え、最終的に下記に示した20の文献を抽出した。
|

|
| |
| 文献 |
| 1) |
Iwadate Y, Matsutani T, Shinozaki N, et al. Anaplastic oligodendroglial tumors harboring 1p/19q deletion can be successfully treated without radiotherapy. Anticancer Res. 2011;31(12):4475-9.
|
|
| 2) |
Sasaki H, Hirose Y, Yazaki T, et al. Upfront chemotherapy and subsequent resection for molecularly defined gliomas. J Neurooncol. 2015;124(1):127-35.
|
|
| 3) |
Stupp R, Mason WP, van den Bent, et al; European Organisation for Research and Treatment of Cancer Brain Tumor and Radiotherapy Groups; National Cancer Institute of Canada Clinical Trials Group. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med. 2005;352(10):987-96.
|
|
| 4) |
Shaw EG, Berkey B, Coons SW, et al. Recurrence following neurosurgeon-determined gross-total resection of adult supratentorial low-grade glioma: results of a prospective clinical trial. J Neurosurg. 109(5):835-41.
|
|
| 5) |
Weller M, van den Bent M, Tonn JC, et al; European Association for Neuro-Oncology (EANO) Task Force on Gliomas. European Association for Neuro-Oncology (EANO) guideline on the diagnosis and treatment of adult astrocytic and oligodendroglial gliomas. Lancet Oncol. 2017;18(6):e315-e329.
|
|
| 6) |
Buckner JC, Shaw EG, Pugh SL, et al. Radiation plus Procarbazine, CCNU, and Vincristine in Low-grade Glioma. N Engl J Med. 2006;374(14):1344-55.
|
|
| 7) |
Buckner JC, Gesme D Jr, O'Fallon JR, et al. Phase II trial of procarbazine, lomustine, and vincristine as initial therapy for patients with low-grade oligodendroglioma or oligoastrocytoma: efficacy and associations with chromosomal abnormalities. J Clin Oncol. 2003;21(2):251-5.
|
|
| 8) |
Baumert BG, Hegi ME, van den Bent MJ, et al. Temozolomide chemotherapy versus radiotherapy in high-risk low-grade glioma (EORTC 22033-26033): a randomised, open-label, phase 3 intergroup study. Lancet Oncol. 2016;17(11):1521-32.
|
|
| 9) |
Kesari S, Schiff D, Drappatz J, et al. Phase II study of protracted daily temozolomide for low-grade gliomas in adults. Clin Cancer Res. 2009;15(1):330-7.
|
|
| 10) |
Brada M, Viviers L, Abson C, et al. Phase II study of primary temozolomide chemotherapy in patients with WHO Grade II gliomas. Ann Oncol. 2003;14(12):1715-21.
|
|
| 11) |
Wahl M, Phillips JJ, Molinaro AM, et al. Chemotherapy for adult low-grade gliomas: clinical outcomes by molecular subtype in a phase II study of adjuvant temozolomide. Neuro Oncol. 2017;19(2):242-51.
|
|
| 12) |
Fisher BJ, Hu C, Macdonald DR, et al. Phase 2 study of temozolomide-based chemoradiation therapy for high-risk low-grade gliomas: preliminary results of Radiation Therapy Oncology Group 0424. Int J Radiat Oncol Biol Phys. 2015;91(3):497-504.
|
|
| 13) |
Pignatti F, van den Bent M, Curran D, et al. Prognostic factors for survival in adult patients with cerebral low-grade glioma. J Clin Oncol. 2002;20(8):2076-84.
|
|
| 14) |
Reuss DE, Kratz A, Sahm F, et al. Adult IDH wild type astrocytomas biologically and clinically resolve into other tumor entities. Acta Neuropathol. 2015;130(3):407-17.
|
|
| 15) |
Bell EH, Zhang P, Shaw EG, et al: Comprehensive Genomic Analysis in NRG Oncology/RTOG 9802: A Phase III Trial of Radiation Versus Radiation Plus Procarbazine, Lomustine (CCNU), and Vincristine in High-Risk Low-grade Glioma. J Clin Oncol. 2020;38(29):3407-17.
|
|
| 16) |
Youland RS, Kreofsky CR, Schomas DA, et al. The impact of adjuvant therapy for patients with high-risk diffuse WHO Grade II glioma. J Neurooncol. 2017;135(3):535-43.
|
|
| 17) |
Stone JB, Kelvin JF, DeAngelis LM. Fertility preservation in primary brain tumor patients. Neurooncol Pract. 2017;4(1):40-5
|
|
| 18) |
Momota H, Narita Y, Miyakita Y, et al. Secondary hematological malignancies associated with temozolomide in patients with glioma. Neuro Oncol. 2013;15(10):1445-50.
|
|
| 19) |
Johnson BE, Mazor T, Hong C, et al. Mutational analysis reveals the origin and therapy-driven evolution of recurrent glioma. Science. 2014;343(6167):189-93.
|
|
| 20) |
van Thuijl HF, Mazor T, Johnson BE, et al. Evolution of DNA repair defects during malignant progression of low-grade gliomas after temozolomide treatment. Acta Neuropathol. 2015;129(4):597-607.
|
|

|

|
| |
3. Grade III神経膠腫
|
| |
Grade IIIについて組織診断別に、そのエビデンスについて解説する。
1) 退形成性乏突起膠腫 IDH mutant and 1p19q codeleted/NOS (Grade III)
Grade IIIの乏突起膠腫と乏突起星細胞腫を対象とした、放射線単独と放射線+PCV化学療法の2件のランダム化比較試験(EORTC26951試験, RTOG9402試験)が2006年に報告され、その長期成績も2013年に報告された1-4)。これらの試験では1p/19q共欠失やIDH変異の有無は前方視的には調べられておらず、ランダム化の段階では組織形態診断によっている。EORTC26951試験の長期間追跡調査では、PCV併用群で有意なOS・PFSの延長が見られ(RT/PCV vs. RT :OS 42.3カ月 vs. 30.6カ月) 、後方視的研究として行われた遺伝子情報を含む解析では、1p/19q共欠失のある80例では中間観察期間140カ月の時点でRT単独群(32例)のOS中間値は112カ月に対し、RT/PCV群(38例)では50%以上が生存しておりOS中間値は140カ月以上ということになり、PCV併用の効果は1p/19q共欠失群でより顕著な傾向が示唆されている3)。RTOG9402ではRT/PCV148例とRT143例が解析され、観察期間中央値11.3カ月で、PCV併用群での全生存期間の上乗せ効果は見られなかった(RT/PCV vs. RT:4.6カ月 vs. 4.7カ月)。しかし、遺伝子型別にその効果を検討したRTOG9402試験の後方的視解析では1p/19q の検査が91%で行われ、1p/19q共欠失の腫瘍(126例)は、非共欠失型腫瘍 (134例)に比べて明らかにOSが長く(RT/PCV群は14.7年、RT単独でも7.3年)、PCV併用の効果が顕著であった。一方、1p/19q非共欠失の腫瘍はOSがRT/PCV群で2.6年、RT単独群で2.7年となり、全体の予後不良に加えてPCV併用の効果も認められなかった4)。
Grade III 神経膠腫を対象とし、治療成功期間(再発までの期間 time to treatment:TTF)を主要評価項目として、RT vs. PCV vs. TMZで初期治療方法の効果を比較したNOA-04試験では、TTF, OS 共に群間に差は見られなかった。CpGアイランドメチル化形質(CIMP)陽性と1p/19q共欠失を有するグループでは、TMZ単独療法に比較しPCV単独あるいは放射線単独療法群で無増悪生存期間が延長していた5)。CIMP陽性症例での、PCV上乗せ効果はEORTC26951試験の後ろ向き研究でも示されている6)。また同解析では、MGMT遺伝子プロモーター領域メチル化を有する症例でも、PCV上乗せによるOSおよびPFSの延長効果が明らかにされている。EORTC26951試験、およびBucknerらが報告した低悪性度グリオーマに対するランダム化比較試験7)では、放射線治療後PCV 6サイクルのレジメが組まれたが、血液毒性や腫瘍進行で44~70%の患者がレジメンを完遂できず、PCV施行回数の中央値は3~4サイクルであった。
以上より、退形成性乏突起膠腫IDH変異および1p/19q共欠失においては、術後の化学療法は有効で、化学療法のレジメンとしてはPCV療法がTMZよりも有効性が高い可能性があるが、十分なエビデンスはないことがわかる。化学療法を先行しても、放射線療法を先行してもその予後には変わりがないと考えられる。
Grade IIの項で述べたように、本邦ではlomustine (CCNU)が使用できないため、その代わりにニムスチン(ACNU)を使用したPAV療法が用いられることが多く、ほぼ同様の効果があると考えられるが、直接にその有効性を確認した第III相試験はない8,9)。
2) 退形成性星細胞腫 IDH mutant /IDH wildtype /NOS (Grade III)
CATNON試験は1p/19q共欠失のないGrade IIIのglioma を対象として、RT 59.4 GyにTMZの同時投与および照射後追加併用(12サイクル)の効果をみる試験であるが、その中間解析(観察期間中央値27ヶ月)で、放射線照射後のTMZ補助化学療法のOS及びPFSの延長効果が報告された(RT+TMZ vs. RT:OS NR (not reached vs. 41.1 カ月, PFS 42.8カ月 vs. 19.0カ月)。 この試験ではIDH変異は対象の条件にはなっておらず、その有無が層別化の因子としての解析対象となっているが、大半はIDH変異型と考えられる10)。NOA-08試験は、65歳以上の高齢者悪性神経膠腫(anaplastic astrocytoma とglioblastoma)における、TMZ単独療法の放射線照射単独療法(60Gy)に対する非劣性が証明されたが、Grade IIIは全体の10.7 %(40/473)しか占めていない8)。付随研究では、遺伝子検索がなされた126例のうち3例(2.4 %)しかIDH変異は無く、IDH変異に限った評価はできていない。IDH野生型でMGMT遺伝子プロモーター領域のメチル化を有する症例においては、TMZの有意な無PFS延長効果が示された9)。Grade III神経膠腫に対する放射線治療へのPCV上乗せ効果は議論の残るところであるが、2001年に報告されたGrade III・IV星細胞腫(AAとGBM)を対象とした大規模ランダム化比較試験では、全体の17 % (113/674)がanaplastic astrocytoma であったが、全体としてその有効性は否定されている11)。JCOG0305試験では、Grade III・IV星細胞腫(AAとGBM)において放射線併用ニムスチン投与患者への、プロカルバジン上乗せ効果を検証したが、効果は認められなかった12)。前項でも記載した組織学的に乏突起膠腫及び乏突起星細胞腫と診断された症例を対象としたEORTC26951試験, RTOG9402試験の付随研究において、1p/19q共欠失の無い症例、つまり現行の分類では退形成性星細胞腫に分類される患者群では、PCV療法のOS、PFSともに延長効果が認められなかった2,4)。ニトロソウレア併用療法に関しての臨床試験は、1980年代に多くGrade III・IVをまとめてmalignant gliomaとして扱った報告がありその限定的な効果が示唆されている13)。その多くがBCNUであり、我が国で保険適用となっているACNUに対するランダム化比較試験はTakakuraらの1986年の報告までさかのぼるが、生存期間の延長効果は認められていない14)。明確な結論が出ない悪性神経膠腫に対する単剤、あるいは多剤化学療法有効性(テモゾロミド登場前)に関して、2002年に報告された悪性神経膠腫の化学療法の効果について12のランダム化比較試験をまとめたメタアナリシスでは、退形成性神経膠腫における有意な化学療法効果は認められなかった15)。退形成性神経膠腫のみを対象とした放射線照射とテモゾロミド併用群(n=97)と、放射線照射とニトロソウレア(BCNU もしくはCCNU,)併用群(n=99)のランダム化比較試験(RTOG9813)が2002年に開始されたが、2005年の膠芽腫に対するテモゾロミド有効性の結果を受けて早期に終了となった。その結果は観察期間中間値3.6年の時点で報告されているが、この研究ではOS及びPFSともに両群間で有意差は認められなかった。196例のうち103例でIDH R132Hの免疫染色での確認がされているが、103例中54例がIDH1 R132H negativeであった16)。
以上から、Grade IIIの星細胞腫においてはPCV療法の有効性は示されておらず、TMZを用いた化学療法が推奨される。
|

|
| |
システマティックレビュー結果
|
| |
このCQに応えるため、2000年1月~2019年10月の文献を対象に下記の検索式による文献検索を2019年11月に行った。
|

|
| |
データベース:PubMed
|
| |
| # |
検索式 |
文献数 |
| #1 |
oligodendroglioma[Mesh] OR astrocytoma[Mesh] OR oligoastrocytoma[Mesh]
|
32553 |
| #2 |
anaplastic[tiab] OR diffuse[tiab] OR malignant[tiab]
|
465168 |
| #3 |
oligodendroglioma[tiab] OR astrocytoma[tiab] OR oligoastrocytoma[tiab] OR glioma[tiab] |
46416 |
| #4 |
#2 AND #3 |
14180 |
| #5 |
#1 OR #4 |
41834 |
| #6 |
chemotherapy OR pharmacotherapy OR drug therapy |
2974375 |
| #7 |
#5 AND #6 |
12050 |
| #8 |
Filters: Clinical Study; Meta-Analysis; Randomized Controlled Trial; Systematic Reviews |
1657 |
| #9 |
Filters: Meta-Analysis; Randomized Controlled Trial; Systematic Reviews |
520 |
|
| |
上記の検索式により一次スクリーニングとして521の文献を抽出し、さらに下記のremove criteriaで該当しない文献を除き、最終的に39の文献を抽出した。SRの結果、最終的に16の文献を引用した。医中誌データベースにおいても一次スクリーニング同様の検索を行い219の文献をピックアップしたが、2次スクリーニングの結果適切な対象文献はなかった。
|

|
| |
| 文献 |
| 1) |
Intergroup Radiation Therapy Oncology Group Trial 9402; Cairncross G, Berkey B, Shaw E, et al. Phase III trial of chemotherapy plus radiotherapy compared with radiotherapy alone for pure and mixed anaplastic oligodendroglioma: Intergroup Radiation Therapy Oncology Group Trial 9402. J Clin Oncol. 2006;24(18):2707-14.
|
|
| 2) |
van den Bent MJ, Carpentier AF, Brandes AA, et al. Adjuvant procarbazine, lomustine, and vincristine improves progression-free survival but not overall survival in newly diagnosed anaplastic oligodendrogliomas and oligoastrocytomas: a randomized European Organisation for Research and Treatment of Cancer phase III trial. J Clin Oncol. 2006;24(18):2715-22.
|
|
| 3) |
van den Bent MJ, Brandes AA, Taphoorn MJ, et al. Adjuvant procarbazine, lomustine, and vincristine chemotherapy in newly diagnosed anaplastic oligodendroglioma: long-term follow-up of EORTC brain tumor group study 26951. J Clin Oncol. 2013;31(3):344-50.
|
|
| 4) |
Cairncross G, Wang M, Shaw E, et al. Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma: long-term results of RTOG 9402. J Clin Oncol. 2013;31(3):337-43.
|
|
| 5) |
Wick W, Roth P, Hartmann C, et al; Neurooncology Working Group (NOA) of the German Cancer Society. Long-term analysis of the NOA-04 randomized phase III trial of sequential radiochemotherapy of anaplastic glioma with PCV or temozolomide. Neuro Oncol. 2016;18(11):1529-37.
|
|
| 6) |
van den Bent MJ, Erdem-Eraslan L, Idbaih A, et al. MGMT-STP27 methylation status as predictive marker for response to PCV in anaplastic Oligodendrogliomas and Oligoastrocytomas. A report from EORTC study 26951. Clin Cancer Res. 2013;19(19):5513-22.
|
|
| 7) |
Buckner JC, Shaw EG, Pugh SL, et al. Radiation plus Procarbazine, CCNU, and Vincristine in Low-grade Glioma. N Engl J Med. 2016;374(14):1344-55.
|
|
| 8) |
Iwadate Y, Matsutani T, Shinozaki N, et al.: Anaplastic oligodendroglial tumors harboring 1p/19q deletion can be successfully treated without radiotherapy. Anticancer Res 31:4475-4479, 2011
|
|
| 9) |
Sasaki H, Hirose Y, Yazaki T, et al. Upfront chemotherapy and subsequent resection for molecularly defined gliomas. J Neurooncol. 2015;124(1):127-35.
|
|
| 10) |
van den Bent MJ, Baumert B, Erridge SC, et al. Interim results from the CATNON trial (EORTC study 26053-22054) of treatment with concurrent and adjuvant temozolomide for 1p/19q non-co-deleted anaplastic glioma: a phase 3, randomised, open-label intergroup study. Lancet. 2017;390(10103):1645-53.
|
|
| 11) |
Medical Research Council Brain Tumor Working Party. Randomized trial of procarbazine, lomustine, and vincristine in the adjuvant treatment of high-grade astrocytoma: a Medical Research Council trial. J Clin Oncol. 2001;19(2):509-18.
|
|
| 12) |
Shibui S, Narita Y, Mizusawa J, et al.: Randomized trial of chemoradiotherapy and adjuvant chemotherapy with nimustine (ACNU) versus nimustine plus procarbazine for newly diagnosed anaplastic astrocytoma and glioblastoma (JCOG0305). Cancer Chemother Pharmacol. 2013;71(2):511-21.
|
|
| 13) |
Nelson DF, Diener-West M, Horton J, et al. et al. Combined modality approach to treatment of malignant gliomas--re-evaluation of RTOG 7401/ECOG 1374 with long-term follow-up: a joint study of the Radiation Therapy Oncology Group and the Eastern Cooperative Oncology Group. NCI Monogr. 1988;(6):279-84.
|
|
| 14) |
Takakura K, Abe H, Tanaka R, et al. Effects of ACNU and radiotherapy on malignant glioma. J Neurosurg. 1986;64(1):53-7.
|
|
| 15) |
Stewart LA. Chemotherapy in adult high-grade glioma: a systematic review and meta-analysis of individual patient data from 12 randomised trials. Lancet. 2002;359(9311):1011-8.
|
|
| 16) |
Chang S, Zhang P, Cairncross JG, et al. Phase III randomized study of radiation and temozolomide versus radiation and nitrosourea therapy for anaplastic astrocytoma: results of NRG Oncology RTOG 9813. Neuro Oncol. 2017;19(2):252-8.
|
|

|

|

|
| 課題3:経過観察の方法と再発の診断
|

|
| |
CQ5 術後の経過観察と画像診断の方法と頻度はどうするか?
|

|
| |
推奨
1.経過観察の方法
臨床評価としては、神経機能、痙攣発作の有無と様態、ステロイド使用の適否、化学療法あるいは放射線療法の有害事象などを念頭に置いて、身体検査、神経学的検査、血液生化学検査、画像検査を推奨する。(推奨度1A)
2. Grade II神経膠腫の画像検査
Grade II神経症状の変化に注意しながら治療開始5年までは3-6カ月おき、5年目以降は6-12カ月おきにMRIを撮影することを推奨する。必要に応じて間隔を調整する。(推奨度1C)
1. Grade III神経膠腫の画像検査
造影MRIを3−4ヶ月ごとに行うことを提案する。必要に応じて間隔を調整する。 (推奨度1C)
|
|

|
| |
解説
|
| |
1.経過観察の方法
術後の臨床評価・経過観察項目として、神経機能(neurological function)、痙攣発作、ステロイド使用、化学療法の有害事象の評価が必要であり、これらに着目して、身体検査、神経学的検査、血液生化学検査を定期的に実施する。ステロイドに関しては、可及的早期に漸減・中止が望ましく、使用中は血糖値の評価が必要である。残存や再発病変がある場合、深部静脈血栓症がしばしば起こるため、血液凝固検査が必要である1)。抗てんかん薬服用中は血液検査(ヘモグラムを含む)と肝機能評価が必要である1 ,2)。
化学療法を行っている場合は、投与間隔に応じて、身体検査、神経学的検査、血液生化学検査を定期的に実施する。ランダム化比較試験では、初期治療で放射線治療または放射線化学療法を行っている期間は、週1回の臨床評価が行われている3-7)。維持化学療法では、テモゾロミド療法、Grade III・IV神経膠腫に対するテモゾロミドとアバスチン併用療法では4週ごと5, 6)、アバスチン単独療法では、15 mg/kg/ 3週ごと、10 mg/kg/2週ごと5, 8, 9)、PCV療法(本邦ではPAV療法)は6週間毎3,10)の化学療法開始直前に臨床評価が実施されている。アバスチンを使用する場合は、蛋白尿の有無を確認するため尿検査も実施する。抗痙攣薬、ステロイド、化学療法薬を使用していない場合は、血液生化学検査の必要はなく、身体所見、神経学的所見を定期的に実施する2)。
|

|
| |
| 文献 |
| 1) |
Galbán CJ, Chenevert TL, Meyer CR, et al. Prospective analysis of parametric response map-derived MRI biomarkers: identification of early and distinct glioma response patterns not predicted by standard radiographic assessment. Clin Cancer Res. 2011;17(14):4751-60.
|
|
| 2) |
Stupp R, Mason WP, van den Bent MJ, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med. 2005;352(10):987-96.
|
|
| 3) |
Chinot OL, Wick W, Mason W, et al. Bevacizumab plus radiotherapy-temozolomide for newly diagnosed glioblastoma. N Engl J Med. 2014;370(8):709-22.
|
|
| 4) |
Gilbert MR, Dignam JJ, Armstrong TS, et al. A randomized trial of bevacizumab for newly diagnosed glioblastoma. N Engl J Med. 2014;370(8):699-708.
|
|
| 5) |
Cairncross G, Wang M, Shaw E, et al. Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma: long-term results of RTOG 9402. J Clin Oncol. 2013;31(3):337-43.
|
|
| 6) |
Balducci M, D'Agostino GR, Manfrida S, et al. Radiotherapy and concomitant temozolomide during the first and last weeks in high-grade gliomas: long-term analysis of a phase II study. J Neurooncol. 2010;97(1):95-100.
|
|
| 7) |
Tsuyuguchi N, Takami T, Sunada I, et al. Methionine positron emission tomography for differentiation of recurrent brain tumor and radiation necrosis after stereotactic radiosurgery--in malignant glioma. Ann Nucl Med. 2004;18(4):291-6.
|
|
| 8) |
Drappatz J, Lee EQ, Hammond S, et al. Phase I study of panobinostat in combination with bevacizumab for recurrent high-grade glioma. J Neurooncol. 2012;107(1):133-8.
|
|
| 9) |
Nihashi T, Dahabreh IJ, Terasawa T. Diagnostic accuracy of PET for recurrent glioma diagnosis: a meta-analysis. AJNR Am J Neuroradiol. 2013;34(5):944-50.
|
|
| 10) |
Cairncross JG, Wang M, Jenkins RB, et al. Benefit from procarbazine, lomustine, and vincristine in oligodendroglial tumors is associated with mutation of IDH. J Clin Oncol. 2014;32(8):783-90.
|
|

|
| |
2.Grade II神経膠腫の画像検査による経過観察
Grade II 神経膠腫は再発や悪性転化の恐れがあり、継続的な経過観察が必要であるが、経過観察の期間や頻度に関して定義する臨床試験は行われておらず、適正な撮影頻度についてのエビデンスはない。表1にガイドラインや様々な臨床試験で行われているMRIの撮影間隔を示す1-9)。
一般に造影増強病変を持たないGrade II 神経膠腫の再発の画像判定はResponse assessment in neuro-oncology(RANO)による判定が行われる10)。RANOの判定に用いるMRI撮影法は、axial FLAIR (3-5 mm スライス厚・1 mm gap)・axial T2 (5 mm スライス厚・1 mm gap)・coronal T1 (5 mm スライス厚・1 mm gap)・Gd-DTPA (axial, coronalあるいはpre- and post- Gd-DTPA volumetric T1-MRI )が定められている。Grade II 神経膠腫はMRIでFLAIR画像かT2強調画像で経過観察されていることが多いものの、axial 1方向だけでは腫瘍の増大について見落とす可能性が高いので、axial/coronalの2方向の情報が必要である。また、悪性転化の可能性を考慮し、造影MRIも考慮する必要がある。MRIのフォローアップの期間は様々であるが、過去の臨床試験では1年の経過で3~4ヶ月での検査の施行、その後の2年間は少なくとも6ヶ月に1度、それ以降少なくとも年1回の頻度で再発するまでフォローアップされている。
RTOG9802試験におけるlow-risk群(40歳未満・全摘出群)に対する経過観察の5年無増悪生存割合は48%で、5年生存割合は93%と半数が5年以内に再発している6)。RTOG9802試験におけるhigh-risk群に対する長期フォローアップのGrade II神経膠腫の全体・DA・OL・IDHR132H変異型神経膠腫の5年無増悪生存割合は、それぞれ61%・約50%・約85%・約75%で、10年無増悪生存割合は、それぞれ51%・約35%・約60%・約60%であった。また5年生存割合は72%・約55%・約85%・約85%で、10年生存割合は61%・約40%・約70%・約75%と報告されている7)。これらのデータから、患者の状態、残存腫瘍の有無などを考慮して、治療開始後2年までは3-4ヶ月ごとのMRI、5年までは4-6か月毎に、10年までは6-12か月ごとにMRIを施行することがのぞましい。しかしながら10年後もGrade II神経膠腫の生存割合は下がり続け、20年生存割合は22%程度と報告されていることから11)、10年を超えても少なくとも1年に1回はMRIによるフォローアップが必要と考えられる。MRIの間隔は、患者の状態・画像変化など必要によって調整が必要である。MRIの撮影間隔や、毎回造影MRIが必要かどうかは今後の検討課題である。
|

|
| |
表1 様々な臨床試験で行われているMRIの撮影間隔
|
| |
| Trial |
Study design |
画像 |
Follow-up |
| NCCN guideline1) |
|
MRI |
治療開始5年目まで:3-6カ月おき
治療開始6年目以降:6-12カ月おき |
| RT 50.4 Gy vs. 64.8 GyNCCTG/RTOG/ECOG2) |
PhaseIII |
CT orMRI |
治療開始2年目まで:4カ月おき
治療開始2-3年目: 6カ月おき
治療開始4年目以降:少なくとも1年おき |
| RT 45 Gy vs. 59.4 GyEORTC228443) |
PhaseIII |
CT |
神経所見とCTを再発までフォローアップする |
| early versus delayed RTEORTC228454) |
PhaseIII |
造影CT |
治療開始2年目まで:4カ月おき
治療開始3年目以降:少なくとも1年おき |
Observation
RTOG9802 (Low risk)5) |
Phase II |
MRI |
手術後6カ月おき |
RT vs. RT+PCV
RTOG9802 (High risk)6) |
PhaseIII |
MRI |
治療開始1年目まで:4カ月おき
治療開始1-2年目: 6カ月おき
治療開始3年目以降:1年おき |
TMZ alone vs. RT
EORTC220337) |
PhaseIII |
MRI |
神経学的な検査は3カ月おきに行い、MRIは6カ月おきに行う。 |
RT+TMZ
RTOG04248) |
PhaseII |
MRI |
3カ月おきにMRIを行う |
RT alone vs. RT+TMZ
JCOG13039) |
PhaseIII |
MRI |
治療開始3年目まで:3カ月おき
治療開始3-5年目: 4カ月おき
治療開始6年目以降:少なくとも1年おき |
|

|
| |
システマティックレビュー結果
|
| |
このCQに応えるため、2000年1月~2019年10月の文献を対象に下記の検索式による文献検索を2019年11月に行った。
|

|
| |
| # |
検索式 |
文献数 |
| #1 |
Observation & Grade II glioma・diffuse astrocytoma・oligodendroglioma・lower Grade glioma・Grade II glioma
|
2 |
| #2 |
Follow_up & Grade II glioma・diffuse astrocytoma・oligodendroglioma・lower Grade glioma
|
0 |
|
| |
以上の検索式より、一次スクリーニングを行ったが、フォローアップのタイミングについて検討した論文は見つからなかった。Grade II神経膠腫に対して行われた前向き臨床試験のプロトコールと診断基準について記載した11の文献についてまとめた。
|

|
| |
| 文献 |
| 1) |
NCCN guideline. 2019(1):9-11.
|
|
| 2) |
Shaw E, Arusell R, Scheithauer B, et al. Prospective randomized trial of low- versus high-dose radiation therapy in adults with supratentorial low-grade glioma: initial report of a North Central Cancer Treatment Group/Radiation Therapy Oncology Group/Eastern Cooperative Oncology Group study. J Clin Oncol. 2002;20(9):2267-76.
|
|
| 3) |
Karim ABMF, Maat B, Hatlevoll R, et al. A randomized trial on dose-response in radiation therapy of low-grade cerebral glioma: European Organization for Research and Treatment of Cancer (EORTC) study 22844. Int J Radiat Oncol Biol Phys. 1996;36(3):549-56.
|
|
| 4) |
van den Bent MJ, Afra D, de Witte O, et al; EORTC Radiotherapy and Brain Tumor Groups and the UK Medical Research Council. Long-term efficacy of early versus delayed radiotherapy for low-grade astrocytoma and oligodendroglioma in adults: the EORTC 22845 randomised trial. Lancet. 2005;366(9490):985-90.
|
|
| 5) |
Shaw EG, Wang M, Coons SW, et al. Randomized trial of radiation therapy plus procarbazine, lomustine, and vincristine chemotherapy for supratentorial adult low-grade glioma: initial results of RTOG 9802. J Clin Oncol. 2012;30(25):3065-70.
|
|
| 6) |
Buckner JC, Shaw EG, Pugh SL, et al. Radiation plus Procarbazine, CCNU, and Vincristine in Low-grade Glioma. N Engl J Med. 2016;374(14):1344-55.
|
|
| 7) |
Baumert BG, Hegi ME, van den Bent MJ, et al. Temozolomide chemotherapy versus radiotherapy in high-risk low-grade glioma (EORTC 22033-26033): a randomised, open-label, phase 3 intergroup study. Lancet Oncol. 2016;17(11):1521-32.
|
|
| 8) |
Fisher BJ, Hu C, Macdonald DR, et al. Phase 2 study of temozolomide-based chemoradiation therapy for high-risk low-grade gliomas: preliminary results of Radiation Therapy Oncology Group 0424. Int J Radiat Oncol Biol Phys. 2015;91(3):497-504.
|
|
| 9) |
JCOG1303プロトコール
|
|
| 10) |
van den Bent MJ, Wefel JS, Schiff D, et al. Response assessment in neuro-oncology (a report of the RANO group): assessment of outcome in trials of diffuse low-grade gliomas. Lancet Oncol. 2011;12(6):583-93.
|
|
| 11) |
Bauman G, Fisher B, Watling C, et al. Adult supratentorial low-grade glioma: long-term experience at a single institution. Int J Radiat Oncol Biol Phys. 2009;75(5):1401-7.
|
|

|
| |
3.Grade III神経膠腫の画像検査による経過観察
Grade IIIについてもこのCQに関して高いエビデンスレベルの報告は存在せず、先行する欧米のガイドラインでもこの部分はexpert opinionとして記載・補完されている。また、Grade III gliomaのみを取り扱った研究・報告は少なく、多くの文献はGrade IVを含めたHGGとして取り扱われているため、以下の記述はGrade IVと共通する内容を含む可能性があることに注意する必要がある。
経過観察のための画像診断の標準は、造影MRIである1-3)。一方、ベバシズマブ(bevacizumab)の登場により起こるようになったpseudoresponseに対しては、非増強病変に対する新たな評価基準を考慮すべきであり、近年はRANO criteriaをもとに、評価には造影MRIに加えて、T2強調画像やFLAIR (fluid-attenuated inversion recovery)画像を撮像することが推奨されている1-3)。
拡散強調画像やADC値が初期の変化として重要であるとするとする報告もあるが4)、一方でheterogeneousな腫瘍であるgliomaの治療判定を行うのは困難であるとする報告もある。
また、手術の影響による造影病変が術後4日目から3カ月にわたって出現するため5)、摘出率の評価に関しては、まず術後3日以内に造影MRIを撮影する必要がある。
次に、初期治療1ヶ月後からpseudoprogressionの評価が必要となることがある。その場合、true progressionかpseudoprogressionかの判定は、12週後の造影MRIで判定するが1, 3)、perfusion MRI 6)やアミノ酸PET 7, 8)が補助診断として有用であるとする報告がある。しかし、残存腫瘍と壊死組織はしばしば混在することに留意する必要がある。
その後の画像評価に関しては、ランダム化比較試験では、3カ月ごとに画像評価が行われている9-11)。European Society for Medical Oncology(ESMO)のclinical practice guidelineでは、治験以外の実臨床においては画像による経過観察として3−4ヶ月ごとのMRIを推奨されている3)。ただし、症例によって進行が懸念される場合は、より頻回の(4−6週間隔で)MRIを撮影する必要がある。その後、徐々に間隔を延ばし、5年以上の長期生存例では1年ごとに行っても良い12, 13)。表2に様々な臨床試験で行われているMRIの撮影間隔を示す1-3, 9-17)。
また、最近の後方視研究で、妊娠中はLGGにおいて腫瘍の増大が促進される可能性が指摘されており18) (Evidence Class IV)、妊娠前からの既知のHGGであれば妊娠は推奨されないが、妊娠中に判明した場合は造影剤を投与せず、単純のみで経過観察を行う19)。
|

|

|
| |
表2 様々な臨床試験で行われているMRIの撮影間隔
|
| |
| Trial |
Study design |
対象疾患 |
画像 |
Follow-up |
| EANO guidelines1,2) |
GL |
Grade II-IV
Astrocytic and Oligodendrocytic tumors |
MRI |
摘出術後は24~72時間以内に評価
初期治療終了から12週まではpseudoprogressionに注意
維持療法開始後、症状が安定していたら3カ月ごと
進行が疑われる場合は4~6週ごと |
| EANO guidelines3) |
Guideline |
Grade III AA, AOA, AO, Grade IV GBM |
MRI |
初期治療が終了してから維持化学療法中 6~8週ごと
治験以外の日常臨床での経過観察 3~4カ月ごと
進行が疑われる場合は適宜間隔を短縮
|
RT+TMZ vs. RT10)
EORTC26981/22981-NCIC-CE.3
|
PhaseIII |
18~70歳 初発 Grade IV GBM |
CT or MRI |
初期治療終了後 4週(28日)
維持療法開始後 3カ月ごと
|
| TMZ vs. RT NOA-0811)
|
PhaseIII |
65歳以上 初発 Grade III AA, Grade IV GBM |
MRI |
初期治療終了後 4週(28日)
維持療法開始後、症状が安定している期間 3カ月ごと
症状が進行している場合 4~6週ごと
|
| RT+PCV vs. RT RTOG940212,13) |
PhaseIII |
18歳以上 Grade III AO, AOA |
CT or MRI |
放射線治療終了後 4~6週
PCV療法中 各サイクル直前 6週ごと
PCV療法終了後 徐々に間隔を延ばし、5年以上経過したら1年ごと
|
| RT+PCV vs. RT EORTC 269519) |
PhaseIII |
18~70歳 初発 Grade III AO |
CT or MRI |
治療開始から3カ月ごと
|
RT+TMZ+Bev vs. RT+TMZ+placebo
AVAglio (BO21990)14) |
PhaseIII |
18歳以上 初発 Grade IV GBM |
MRI |
初期治療後 4週(28日)
TMZ-Bev維持療法中 2カ月ごと
Bev単独投与中 9週ごと
|
| Single arm Bev JO2250615) |
Phase II |
20歳以上 再発 Grade III glioma, Grade IV GBM |
CT or MRI |
初期治療後 4週
TMZ-Bev維持療法開始後 3カ月ごと
|
Standard CRT+Bev vs. Standard CRT+placebo
RTOG 082516) |
PhaseIII |
18歳以上 初発 Grade IV GBM |
CT or MRI |
Bev開始後6週ごと
|
| Single arm Bev17) |
PhaseIII |
20歳以上 再発 HGG (GBM, gliosarcoma, AA AO, AOA) |
MRI |
Bev開始後6週ごと
|
|

|
| |
システマティックレビュー結果
|
| |
このCQに応えるため、2000年1月~2019年10月の文献を対象に下記の検索式による文献検索を2019年11月に行った。
|

|
| |
| # |
検索式 |
文献数 |
| #1 |
(((((((glioma[MeSH Terms]) OR astrocytoma[MeSH Terms]) OR oligodendroglioma[MeSH Terms]) OR high-grade glioma[MeSH Terms]) OR anaplastic glioma[MeSH Terms]) AND ( ( Clinical Trial[ptyp] OR Review[ptyp] ) AND ( adult[MeSH] OR adult[MeSH:noexp] OR aged[MeSH] ) ))) NOT case reports[Publication Type]
|
2806 |
| #2 |
削除 Key words:Ependymoma -51;Glioblastoma -714:Older than 1990 -176:Low-grade glioma -81
Pediatric -53
|
656 |
| #3 |
#1から#2を削除 |
1731 |
|
| |
以上の検索式より、一次スクリーニングとして1731の文献を抽出し、最終的に下記に示した18の文献を抽出した。
|

|
| |
| 文献 |
| 1) |
Weller M, van den Bent M, Tonn JC, et al. European Association for Neuro-Oncology (EANO) guideline on the diagnosis and treatment of adult astrocytic and oligodendroglial gliomas. Lancet Oncol. 2017;18(6):e315-e329.
|
|
| 2) |
Pace A, Dirven L, Koekkoek JAF, et al. European Association for Neuro-Oncology (EANO) guidelines for palliative care in adults with glioma. Lancet Oncol. 2017;18(6):e330-e340.
|
|
| 3) |
Stupp R, Tonn JC, Brada M, et al; ESMO Guidelines Working Group. High-grade malignant glioma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2010;21 Suppl 5:v190-3.
|
|
| 4) |
Jain R, Scarpace LM, Ellika S, et al. Imaging response criteria for recurrent gliomas treated with bevacizumab: role of diffusion weighted imaging as an imaging biomarker. J Neurooncol. 2010;96(3):423-31.
|
|
| 5) |
Albert FK, Forsting M, Sartor K, et al. Early postoperative magnetic resonance imaging after resection of malignant glioma: objective evaluation of residual tumor and its influence on regrowth and prognosis. Neurosurgery. 1994;34(1):45-60; discussion 60-41.
|
|
| 6) |
Galban CJ, Chenevert TL, Meyer CR, et al. Prospective analysis of parametric response map-derived MRI biomarkers: identification of early and distinct glioma response patterns not predicted by standard radiographic assessment. Clin Cancer Res. 2011;17(14):4751-60.
|
|
| 7) |
Tsuyuguchi N, Takami T, Sunada I, et al. Methionine positron emission tomography for differentiation of recurrent brain tumor and radiation necrosis after stereotactic radiosurgery--in malignant glioma. Ann Nucl Med. 2004;18(4):291-6.
|
|
| 8) |
Nihashi T, Dahabreh IJ, Terasawa T. Diagnostic accuracy of PET for recurrent glioma diagnosis: a meta-analysis. AJNR Am J Neuroradiol. 2013;34(5):944-50.
|
|
| 9) |
van den Bent MJ, Brandes AA, Taphoorn MJ, et al. Adjuvant procarbazine, lomustine, and vincristine chemotherapy in newly diagnosed anaplastic oligodendroglioma: long-term follow-up of EORTC brain tumor group study 26951. J Clin Oncol. 31(3):344-50.
|
|
| 10) |
Stupp R, Mason WP, van den Bent MJ, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med. 2005;352(10):987-96.
|
|
| 11) |
Wick W, Platten M, Meisner C, et al. Temozolomide chemotherapy alone versus radiotherapy alone for malignant astrocytoma in the elderly: the NOA-08 randomised, phase 3 trial. Lancet Oncol. 2012;13(7):707-15.
|
|
| 12) |
Cairncross G, Wang M, Shaw E, et al. Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma: long-term results of RTOG 9402. J Clin Oncol. 2013;31(3):337-43.
|
|
| 13) |
Cairncross JG, Wang M, Jenkins RB, et al. Benefit from procarbazine, lomustine, and vincristine in oligodendroglial tumors is associated with mutation of IDH. J Clin Oncol. 2014;32(8):783-90.
|
|
| 14) |
Chinot OL, Wick W, Mason W, et al. Bevacizumab plus radiotherapy-temozolomide for newly diagnosed glioblastoma. N Engl J Med. 2014;370(8):709-22.
|
|
| 15) |
Gilbert MR, Dignam JJ, Armstrong TS, et al. A randomized trial of bevacizumab for newly diagnosed glioblastoma. N Engl J Med. 2014;370(8):699-708.
|
|
| 16) |
Nagane M, Nishikawa R, Narita Y, et al. Phase II study of single-agent bevacizumab in Japanese patients with recurrent malignant glioma. Jpn J Clin Oncol. 2012;42(10):887-95.
|
|
| 17) |
Raizer JJ, Grimm S, Chamberlain MC, et al. A phase 2 trial of single-agent bevacizumab given in an every-3-week schedule for patients with recurrent high-grade gliomas. Cancer. 2010;116(22):5297-305.
|
|
| 18) |
Daras M, Cone C, Peters KB. Tumor progression and transformation of low-grade glial tumors associated with pregnancy. J Neurooncol. 2014;116(1):113-7.
|
|

|

|

|
| 課題4:臨床症状への対応
|

|
| |
CQ6 神経症状(てんかん、高次機能障害など)への対応はどうするか?
|

|
| |
推奨
1.てんかんの既往を有する患者には、抗てんかん薬投与を推奨する。(推奨度1A)
2.てんかん発作の既往が無い患者には、周術期など臨床上有益と判断される場合を除き、予防的な抗てんかん薬を投与しないことを推奨する。(推奨度1B)
3.認知障害を有する患者に対する統合的なリハビリテーションを推奨する。(推奨度1B)
4.腫瘍に関連した神経心理的症状に対する治療には神経心理専門医との協議を提案する。(推奨度2C)
|
|

|
| |
解説
|
| |
GradeII・III神経膠腫に対する診療の目的として、生存期間の延長のみならず、神経症状を改善しQOLを保つこと、しかもこれらを長期的にコントロールすることが重視されている。
神経症状の原因には、腫瘍そのものと、治療の有害事象によるものがある。そして、これらに影響する因子は腫瘍の種類、局在、合併症など多岐にわたる。てんかん発作はGradeII・III神経膠腫の75%で発生すると報告されているが1)、他の症状、高次機能障害、全身倦怠感などの出現頻度は明らかではない。
治療によるてんかん発作の頻度減少と消失の評価は、Engelのてんかん外科手術後の転機評価に準じて行われることもある2)。認知機能、精神心理学的障害、易疲労性などの客観的な評価方法と治療効果判定法については、実臨床に有用・簡便かつ安定した評価方法が確立されていないため、治療効果の解釈が困難な点がある。QOLの評価法として各種腫瘍の臨床試験でもっとも広く用いられているのは、EORC quality of life questionnaire C30 (EORTC QLQ-C30)で、これは30項目の全般的評価からなり、(a)5つの機能スケール、(b) 3つの症状スケール、(c) 6つの個別項目が含まれている。さらに脳腫瘍患者のための補足としてBN20が用いられ、(d) 4つの基盤スケール(視力障害、運動障害、コミュニケーション障害、将来不安)、(e) 7つの症状項目(てんかん、膀胱直腸障害、下肢脱力、頭痛、傾眠、髪の脱失、掻痒感)が設定されている3)。QOLの評価は病気の時相、心理学的状態、年齢や社会経済学的状況などからも影響を受ける4)。今後、脳腫瘍患者でどのような評価がもっとも良いのかを議論する必要があり、介入によってどの症状や項目がどの時点で改善されるかを明らかにしていく必要がある。したがって現時点では高レベルのエビデンスは乏しく今後の臨床試験に期待しなければならないが、臨床的にQOLに対して直接的影響が大きいてんかん発作の制御と、認知障害・精神心理学的異常の改善について推奨と解説を作成した。
|

|
| |
| 文献 |
| 1) |
Van Breemen MSM, Wilms EB, Vecht CJ. Epilepsy in patients with brain tumours: Epidemiology, mechanisms, and management. Lancet Neurol. 2007; 6(5): 421-30.
|
|
| 2) |
Engel J Jr, Wiebe S, French J, et al. Practice parameter; temporal lobe and localized neocortical resections for epilepsy: report of the Quality Standards Subcommittee of the American Academy of Neurology, in association with the American Epilepsy Society and the American Association of Neurological Surgeons. Neurology. 2003; 60(4): 538-47.
|
|
| 3) |
Chaw R, Lao N, Popovic M, et al. Comparison of the EORTC QLQ-BN20 and the FACT-Br quality of life questionnaires for patients with primary brain cancers: a literature review. Support Care Cancer. 2014;22(9):2593-8.
|
|
| 4) |
Giovagnoli AR, Meneses RF, Silvani A, et al. Quality of life and brain tumors: what beyond the clinical burden? J Neurol 2014; 261: 894-904.
|
|

|
| |
1. てんかん
|
| |
てんかんはGradeII・III神経膠腫の初発症状として、あるいは経過中においても起こりうる。発作型は単純部分発作(意識保持焦点発作)・複雑部分発作(意識減損焦点発作)、全般性強直間代発作、または部分発作の二次性全般化発作(焦点起始両側強直間代発作)のいずれもみられる。薬剤抵抗性てんかんは、心理社会的ハンディキャップの原因となることが多く、てんかん発作のコントロールは神経学的機能、QOLの改善をもたらす1)。
神経膠腫患者のてんかん発症メカニズムには、多くの因子が複合的に関与していると考えられ、完全には解明されていない1)。てんかん発作と神経膠腫の増大は病態メカニズムに共通点が多い。神経細胞のシナプス前小胞体から放出されるグルタミン酸が細胞外に過剰に存在することが、発作性脱分極電位の生成のみならず、興奮毒性神経細胞死にも関与し、同時にグルタミン酸受容体の活性化は腫瘍の増大を促進すると考えられている。一方、GABA受容体は神経興奮を抑制すると同時に、腫瘍増大も抑制すると考えられている。
てんかんの治療は、(1)腫瘍によるてんかん発作の既往を有する患者に対する治療と、(2)てんかん発作の既往が無い患者に対する発作発現の予防とに分けて考える。
1) 発作の既往を有する患者に対する治療
抗てんかん薬および腫瘍自体に対する治療(放射線治療、外科的摘出術、テモゾロミド)の効果について研究されている。
抗てんかん薬は新規薬剤の上市により、選択肢が多くなった。レベチラセタムとプレガバリン各単剤投与のランダム化比較試験の結果、1年後にそれぞれ65%と75%の患者のてんかん発作が消失した2)。他に、手術後24時間以内にフェニトインからレベチラセタムに変更する群と、フェニトイン続行群とのランダム化比較試験が行われた。この試験は登録が少なく中止されたが、前者は87%、後者は75%でてんかん発作が消失した。フェニトインに毒性が高かった3)。レベチラセタムは部分発作、部分発作の二次性全般化、強直間代発作(併用)に効能効果が認められており、肝臓の酵素誘導がなく他の薬剤との相互作用がない。このため部分発作の患者には、レベチラセタム単剤が初期投与の選択候補といえる。通常1000mg/日を2回分割で単独投与され、3000mg/日まで増量可能である。重篤な毒性はほとんどなく、安全性は高いが、5~10%の患者に被刺激性上昇や激昂症状が出現するとされ、注意が必要である。欧米では、ペランパネル、レベチラセタムを用いた複数の臨床試験が実施または計画されている。(註:プレガバリン:本邦ではてんかんに保険適用外である)放射線治療のてんかん発作抑制効果については、大規模比較試験は行われていない。LGG (Grade IIのみ)の初回治療放射線治療の生存延長効果について調査したランダム化比較試験(EORTC 22845試験)において、腫瘍が2年間進行しなかった患者のサブグループ解析が行われ、放射線治療を受けた患者の25%、受けなかった患者の41%が治療後1年時点にてんかん発作を有していた(P=0.033)4)。薬剤抵抗性発作を有するGrade II・III神経膠腫の後方視的研究では、放射線治療の3カ月後に発作減少72%、1年後には発作減少76%、消失32%だった5)。一方、手術摘出の発作制御効果について、20論文の患者合計773例について分析が行われた。発作消失は30~100%であり、全摘出 (OR 3.41, 95% CI:2.36-4.93)が有意に発作制御効果を示していた6)。さらに、Grade II神経膠腫に対するテモゾロミド単独治療の小規模な第II相試験では、てんかん発作の既往を有する患者の53%が改善したと報告されている7)。
2) てんかん既往が無い患者への予防
脳腫瘍患者のてんかん発症に対して旧世代の薬(フェニトイン、バルプロ酸、フェノバルビタール)の予防効果にする前向きの臨床試験が1980年代からおこなわれた。これらの報告のメタアナリシスでは、抗てんかん薬の効果について明確なエビデンスは得られず、有害事象は投与群に多かったため、発作予防効果を期待しての使用は推奨されていない8)。しかし、脳腫瘍患者の開頭術後の痙攣抑制効果を研究した、プラセボ対照ランダム化試験のメタアナリシスでは、術後1週間以内に限ってフェニトイン投与群で有意に発作発現が抑制されたが、長期的には有意な抑制効果は無かった9)。新規抗てんかん薬の発作発現抑制について、複数の臨床試験が実施または計画されているが、エビデンスは未だ無い。現在のところ、てんかん既往が無い患者への発作予防効果を期待する抗てんかん薬の使用は、周術期を除いて推奨されていない。周術期の抗てんかん薬の投与に明確な基準はなく、個々の患者の病態に合わせて投与の必要性が判断される。
|

|
| |
システマティックレビュー結果
|
| |
このCQに応えるため、2000年1月~2019年10月の文献を対象に下記の検索式による文献検索を2019年11月に行った。
|

|
| |
| # |
検索式 |
文献数 |
| #1 |
glioma[tiab]
|
44,077 |
| #2 |
epilepsy[MeSH]
|
108,921 |
| #3 |
seizure[MeSH] |
61,667 |
| #4 |
#2 OR #3 |
157,395 |
| #5 |
#1 AND #4 |
599 |
| #6 |
Filters: Clinical Trial, Review, Human |
129 |
| #7 |
Filter: “2000/01/01[PDAT]: 22019/10/31” |
119 |
| #8 |
Abstract search |
9 |
|
| |
以上の検索式より、一次スクリーニングとして119の文献を抽出し、最終的に下記に示した9の文献を抽出した。
|

|
| |
| 文献 |
| 1) |
Rudà R, Soffietti R. What is new in the management of epilepsy in gliomas? Curr Treat Options Neurol. 2015;17(6):351.
|
|
| 2) |
Rossetti AO, Jeckelmann S, Novy J, et al. Levetiracetam and pregabalin for antiepileptic monotherapy in patients with primary brain tumors. A phase II randomized study. Neuro Oncol. 2014; 16(4): 584-8.
|
|
| 3) |
Lim DA, Tarapore P, Chang E, et al. Safety and feasibility of switching from phenytoin to levetiracetam monotherapy for glioma-related seizure control following craniotomy: a randomized phase II pilot study. J Neurooncol. 2009; 93(3): 349-54.
|
|
| 4) |
van den Bent MJ, Afra D, de Witte O, et al. Long-term efficacy of early versus delayed radiotherapy for low-grade astrocytoma and oligodendrogliomas in adults: the EORTC 22845 randomised trial. Lancet 2005; 366(9490):985-90.
|
|
| 5) |
Rudà R, Magliola U, Bertero L, et al. Seizure control followi\ng radiotherapy in patients with diffuse gliomas: a retrospective study. Neuro Oncol. 2013; 15(12): 1739-49.
|
|
| 6) |
Englot DJ, Berger MS, Barbaro NM, et al. Predictors of seizure freedom after resection of supratentorial low-grade gliomas. J Neurosurg. 2011; 115(2): 240-4.
|
|
| 7) |
Brada M, Viviers L, Abson C, et al. Phase II study of primary temozolomide chemotherapy in patients with WHO Grade II gliomas. Ann Oncol. 2003; 14(12): 1715-21.
|
|
| 8) |
Tremont-Lukats IW, Ratilal BO, Armstrong T, et al. Antiepileptic drugs for preventing seizures in people with brain tumors (Review). Cochrane Database Syst Rev. 2008;(2):CD004424
|
|
| 9) |
Joiner EF, Youngerman BE, Hudson TS, et al. Effectiveness of perioperative antiepileptic drug prophylaxis for early and late seizures following oncologic neurosurgery: a meta-analysis. J Neurosurg. 2018; 130(4):1274-82.
|
|

|
| |
2. 認知障害、精神心理的異常など
|
| |
脳腫瘍患者においては多様な原因で認知機能の低下が起こり得る。患者の年齢と腫瘍の部位や広がりに加えて、治療に関連して手術侵襲、局所放射線治療、薬剤の影響が挙げられる。GradeII・III神経膠腫では初期治療終了時には正常対象に比べて認知機能の低下が起こっていることが報告されている1-3)。Mini Mental State Examination(MMSE)を用いた検討ではLGG4,5)あるいは anaplastic glioma6)で放射線治療に化学療法を加えても治療群間に差はなく、多くの患者で治療後再発がなければ時間経過とともに改善が認められている。High-risk LGGでテモゾロミド単独と放射線治療群にランダム化した(EORTC22033-26033試験)患者群でのMMSE及び健康関連QOLの比較でも3年目の結果に差は認められなかった7)。また成人テント上LGGで局所放射線治療後の認知機能を詳細な認知機能検査を用いて評価した研究では2,8)3年ほどの間では低下は認められず、時間経過に沿った改善点もあることが報告されている。しかし、DouwらはLGGにおいて平均6年の調査期間では放射線治療の有無で明らかな認知機能の低下の差がなかった群で、平均12年の長期にわたる追跡調査を行った9)。65例で解析ができ、放射線治療群では注意機能などの認知機能が有意に放射線無施行群より低下していることを示した。これは非ランダム化試験であるためバイアスを含んでいる可能性はあるが、現時点では最も長期に観察が行えている研究である。Cochrane Reviewでは放射線治療による影響は長期にはあるだろうとしたが、エビデンスレベルがまだ低いことが問題とされた10)。他方、これらの研究では比較的状態がよく(KPS 60~70%以上)、長時間の神経心理検査に耐えうる患者が対象となっていることも考慮する必要がある。
薬剤治療に関してはドネペジルが単アームの第II相試験11)で放射線治療後6カ月以上経過した脳腫瘍患者において(多くがglioma)認知機能の改善に有効とされた。しかし引き続き行われた198例の脳腫瘍(GradeII・III神経膠腫は32%)でのランダム化比較試験では12)、介入群、対照群ともに改善傾向があり、認知機能試験全体として両者の間に有意差は認められなかった。しかし認識記憶と手先の巧緻性についは、ドネペジル群で改善の可能性が示された。また、治療前の複合的認知機能尺度が悪い群では、ドネペジル群は対照群より複合的認知機能尺度、即時再生、遅延再生、注意、視覚運動性機能、手先の巧緻性の成績が良かった。
また、認知機能以外に、易疲労性やうつ症状、これらとも関連したQOLの低下が日常生活上問題になる。易疲労性や精神的な障害に対して、薬剤での介入試験が行われ、単アーム試験やベースラインとの比較では有効とされたmethylphenidate(リタリン)13)、modafinil14)などの薬剤があるが、ランダム化比較試験では有効性が証明された薬剤はなく15,16)、本邦ではいずれも精神心理症状には適応外の薬剤である。現時点での薬剤の有効性については明らかではないが、うつ症状以外にも不安や性格変化、せん妄などの症状を呈することがあり、精神腫瘍科医や緩和ケア専門医にコンサルトして患者や家族の苦痛の軽減を図るべきである。
これらの薬剤治療と異なり、各種のリハビリテーションは認知障害や精神心理的障害への有効性がいくつかの臨床試験で証明されている17-19)。Gehringらは17)140例のGradeII・III神経膠腫の患者をランダム化して6週にわたる、2時間の認知機能訓練とコンピューターを用いた自宅学習を含むプログラムを作成し、対照群(waiting-list group)より、訓練終了6ヶ月経過時点での注意機能や言語記憶などでの優越性と疲労感の軽減を報告した。またKhanらは19)非ランダム化比較試験で104例のglioma患者を統合的多分野にわたるリハビリテーションでの介入群と対照群に分け、介入群では短期では運動性や社会心理的な改善が得られ、長期間の観察でも一部の改善が持続することを示した。他方、Boeleらは20)うつ症状に対してインターネットを用いた自己介入による問題解決療法の有効性をランダム化比較試験で検討したが、うつ症状の軽減は証明できず、副次評価項目である易疲労感の改善のみが得られた。この自己学習を用いた方法では脳腫瘍患者では途中脱落が他部位のがん患者よりも多いことも問題点として挙げられた。
|

|
| |
システマティックレビュー結果
|
| |
このCQに応えるため、2000年1月~2019年10月の文献を対象に下記の検索式による文献検索を2019年12月に行った。
|

|
| |
| # |
検索式 |
文献数 |
| #1 |
glioma[tiab]
|
55,399 |
| #2 |
#1 NOT glioblastoma*
|
36,313 |
| #3 |
#2 NOT child* OR pediatric OR congenital |
33,176 |
| #4 |
“quality of life”[tiab] |
278,176 |
| #5 |
#3 AND #4 |
681 |
| #6 |
#5 Filters: clinical trial, “2000/01/01[PDAT]: 22019/10/31” |
30 |
| #7 |
Abstract screening |
20 |
| #8 |
#3 and cognitive[tiab] |
501 |
| #9 |
#8 Filters: clinical trial, “2000/01/01[PDAT]: 22019/10/31” |
25 |
| #10 |
Abstract screening |
20 |
| #11 |
# AND #10 |
33 |
| #12 |
Full text screening |
17 |
| #13 |
Hand search added 3 |
20 |
|
| |
以上の検索式より、一次スクリーニングとして33の文献を抽出し、最終的に下記に示した20の文献を抽出した。
|

|

|
| |
| 文献 |
| 1) |
Taylor BV, Buckner JC, Cascino TL, et al. Effects of radiation and chemotherapy on cognitive function in patients with high-grade glioma. J Clin Oncol. 1998;16(6):2195-201.
|
|
| 2) |
Laack NN, Brown PD, Ivnik RJ, et al. Cognitive function after radiotherapy for supratentorial low-grade glioma: a North Central Cancer Treatment Group prospective study. Int J Radiat Oncol Biol Phys. 2005;63(4):1175-83.
|
|
| 3) |
Correa DD, Shi W, Thaler HT, et al. Longitudinal cognitive follow-up in low-grade gliomas. J Neurooncol. 2008;86(3):321-7.
|
|
| 4) |
Brown PD, Buckner JC, O'Fallon JR, et al. Effects of radiotherapy on cognitive function in patients with low-grade glioma measured by the folstein mini-mental state examination. J Clin Oncol. 2003;21(13):2519-24.
|
|
| 5) |
Prabhu RS, Won M, Shaw EG, et al. Effect of the addition of chemotherapy to radiotherapy on cognitive function in patients with low-grade glioma: secondary analysis of RTOG 98-02. J Clin Oncol. 2014;32(6):535-41.
|
|
| 6) |
Wang M, Cairncross G, Shaw E, et al. Cognition and quality of life after chemotherapy plus radiotherapy (RT) vs. RT for pure and mixed anaplastic oligodendrogliomas: radiation therapy oncology group trial 9402. Int J Radiat Oncol Biol Phys. 2010;77(3):662-9.
|
|
| 7) |
Reijneveld JC, Taphoorn MJ, Coens C et al. Health-related quality of life in patients with high-risk low-grade glioma (EORTC 22033-26033): a randomised, open-label, phase 3 intergroup study. Lancet Oncol. 2016; 17(11):1533-42.
|
|
| 8) |
Yavas C, Zorlu F, Ozyigit G, et al. Prospective assessment of health-related quality of life in patients with low-grade glioma: a single-center experience. Support Care Cancer. 2012;20(8):1859-68.
|
|
| 9) |
Douw L, Klein M, Fagel SS, et al. Cognitive and radiological effects of radiotherapy in patients with low-grade glioma: long-term follow-up. Lancet Neurol. 2009;8(9):810-8.
|
|
| 10) |
Lawrie TA, Gillespie D, Dowswell T, et al. Long-term neurocognitive and other side effects of radiotherapy, with or without chemotherapy for glioma. Cochrane Database Syst Rev. 2019;8(8):CD013047
|
|
| 11) |
Shaw EG, Rosdhal R, D'Agostino RB Jr, et al. Phase II study of donepezil in irradiated brain tumor patients: effect on cognitive function, mood, and quality of life. J Clin Oncol. 2006;24(9):1415-20.
|
|
| 12) |
Rapp SR, Case LD, Peiffer A, et al. Donepezil for Irradiated Brain Tumor Survivors: A Phase III Randomized Placebo-Controlled Clinical Trial. J Clin Oncol. 2015;33(15):1653-9.
|
|
| 13) |
Meyers CA, Weitzner MA, Valentine AD, et al. Methylphenidate therapy improves cognition, mood, and function of brain tumor patients. J Clin Oncol. 1998;16(7):2522-7.
|
|
| 14) |
Gehring K, Patwardhan SY, Collins R, et al. A randomized trial on the efficacy of methylphenidate and modafinil for improving cognitive functioning and symptoms in patients with a primary brain tumor. J Neurooncol. 2012;107(1):165-74.
|
|
| 15) |
Boele FW, Douw L, de Groot M, et al. The effect of modafinil on fatigue, cognitive functioning, and mood in primary brain tumor patients: a multicenter randomized controlled trial. Neuro Oncol. 2013;15(10):1420-8.
|
|
| 16) |
Lee EQ, Muzikansky A, Drappatz J, et al. A randomized, placebo-controlled pilot trial of armodafinil for fatigue in patients with gliomas undergoing radiotherapy. Neuro Oncol. 2016;18(6):849-54.
|
|
| 17) |
Gehring K, Sitskoorn MM, Gundy CM, et al. Cognitive rehabilitation in patients with gliomas: a randomized, controlled trial. J Clin Oncol. 2009;27(22):3712-22.
|
|
| 18) |
Zucchella C, Capone A, Codella V, et al. Cognitive rehabilitation for early post-surgery inpatients affected by primary brain tumor: a randomized, controlled trial. J Neurooncol. 2013;114(1):93-100.
|
|
| 19) |
Khan F, Amatya B, Drummond K, et al. Effectiveness of integrated multidisciplinary rehabilitation in primary brain cancer survivors in an Australian community cohort: a controlled clinical trial. J Rehabil Med. 2014;46(8):754-60.
|
|
| 20) |
Boele FW, Klein M, Verdonck-de Leeuw IM, et al; Dutch Society for Neuro-Oncology (LWNO). Internet-based guided self-help for glioma patients with depressive symptoms: a randomized controlled trial. J Neurooncol. 2018;137(1):191-203.
|
|

|

|

|
| 課題5:再発時の治療
|

|
| |
CQ7:再発時の治療はどのように行うのか?
|

|
| |
1.手術
|
| |
推奨
症例によって再発GradeII・III神経膠腫に対して再手術をしてもよい。(推奨度2C)
|
|

|
| |
2.放射線治療
|
| |
推奨
再発GradeII・III神経膠腫治療において、未照射の場合は放射線照射を行うことを推奨する。(推奨1B)
付記:放射線治療歴のある場合は、放射線照射を慎重に考慮してもよい。(推奨度1C)
|
|

|
| |
3.化学療法
|
| |
推奨
再発GradeII・III神経膠腫に対して全身・局所化学療法を考慮してもよい。(推奨度1C)
|
|

|
| |
1.手術
|
| |
GradeII・III神経膠腫が画像上増大した場合、腫瘍の増大・悪性転化の他、放射線壊死を起こしている可能性があり、診断のための手術が行われる。GradeII神経膠腫が初回再発でGradeIII・IV神経膠腫と診断されるいわゆる悪性転化の割合は40~70%と報告されている1)。
Ramakrishnaらは、初回組織診断でGradeII神経膠腫と診断された52例について報告し、初回再発までの期間中央値は6.2カ月で、2回目の再発までの期間は2.7カ月で、全生存期間は13.0カ月であったと報告している2)。予後因子として再発後の悪性転化が重要であり、摘出率と再発時のKPS<80%が予後因子であるとしている。
Ohnoらは Grade II・III 神経膠腫はIDH1/2変異の有無にかかわらず悪性転化をきたすが3)、悪性転化までの期間はIDH1/2変異例では50.1カ月、IDH1/2野生型例で13.4カ月と、IDH変異例が有意に長いことを報告している4)。
再発GradeII・III神経膠腫に対する再摘出術は、腫瘍によって生じている圧迫症状軽減のみならず、ステロイド投与量の減量や併用する追加療法の効果を高める意義が指摘されている。しかし、腫瘍は限局した摘出可能な部位にある全身状態の良い患者に適応があると思われている。術後は、可能であれば残存腫瘍細胞コントロールのために化学療法も選択肢となる5)。
再手術の利点は、即時の症状緩和が期待でき、同時に組織診断が得られることにある。しかし、GradeII・III神経膠腫再発時の再手術単独の治療成績報告はほとんどない。
そのなかで、再手術に関するひとつの無作為比較試験が報告されている。それは、悪性神経膠腫再発時に手術時をしてカルムスチン徐放性ポリマーとプラセボポリマーを留置する比較試験である6)。平均生存期間中央値は、31週と23週であった。つまり、カルムスチン徐放性ポリマー群が良好な傾向を示した。
他の報告等では、術後に放射線や化学療法を追加しているので、再手術自体の効果判定が困難であった7)。
|

|
| |
システマティックレビュー結果
|
| |
このCQに応えるため、2000年1月~2019年10月の文献を対象に下記の検索式による文献検索を2019年11月に行った。
|

|
| |
| # |
検索式 |
文献数 |
| #1 |
Recurrent glioma and surgery [MeSH Terms]
|
819 |
| #2 |
Recurrent glioblastoma and surgery [MeSH Terms]
|
291 |
| #3 |
Recurrent glioma and surgery [MeSH Terms] |
157 |
|
| |
以上の検索式より、一次スクリーニングとして819の文献を抽出し、最終的に下記に示した7の文献を抽出した。
|

|

|
| |
| 文献 |
| 1) |
Smith JS, Chang EF, Lamborn KR, et al. Role of extent of resection in the long-term outcome of low-grade hemispheric gliomas. J Clin Oncol. 2008;26(8):1338-45.
|
|
| 2) |
Ramakrishna R, Hebb A, Barber J, et al. Outcomes in Reoperated Low-grade Gliomas. Neurosurgery. 2015;77(2):175-84; discussion 84.
|
|
| 3) |
Ohno M, Narita Y, Miyakita Y, et al. Histopathological malignant progression of Grade II and III gliomas correlated with IDH1/2 mutation status. Brain Tumor Pathol. 2012; 29(4): 183-91.
|
|
| 4) |
Ohno M, Narita Y, Miyakita Y, et al. Secondary glioblastomas with IDH1/2 mutations have longer glioma history from preceding lower-Grade gliomas. Brain Tumor Pathol. 2013; 30(4): 224-32.
|
|
| 5) |
Nieder C, Adam M, Molls M, Grosu AL. Therapeutic options for recurrent high-grade glioma in adult patients: recent advances. Crit Rev Oncol Hematol. 2006;60(3):181-93.
|
|
| 6) |
Brem H, Piantadosi S, Burger PC, et al. Placebo-controlled trial of safety and efficacy of intraoperative controlled delivery by biodegradable polymers of chemotherapy for recurrent gliomas. Lancet. 1995;345(8956):1008-12.
|
|
| 7) |
Chaichana KL, Zadnik P, Weingart JD, et al. Multiple resections for patients with glioblastoma: prolonging survival. J Neurosurg. 2013;118(4):812-20.
|
|

|
| |
2.放射線治療
|
| |
GradeII神経膠腫で初回手術後に照射を行わずに経過観察して再発した場合は放射線治療を行うことが勧められる。放射線治療の項目で述べたように、EORTC22845試験では、術後早期のearly RT vs. 再発後のnon-early (delayed) RTが比較された。PFSは5.3・3.4年と有意差が見られたものの(p<0.0001)、OSはそれぞれ7.2・7.4年と有意差が見られなかった1)。
GradeII神経膠腫の放射線治療後の再発例に対する放射線再照射の報告もある。CombsらはGradeII神経膠腫に対し60 Gy放射線治療後の再発63例に対し1回線量2 Gyで36 Gyの再照射を行い再照射後の無増悪生存期間中央値12カ月、生存期間中央値23カ月で、重篤な有害事象の発現はなく有効な治療選択肢と報告している2)。
再発症例に対する再照射後の生存期間中央値は、膠芽腫は34~47週,退形成神経膠腫は、52~105週と報告された2)。この傾向は他の報告と比較しても大きな違いはない。最初の診断からの生存期間は、膠芽腫は18~27カ月、退形成神経膠腫は54カ月であった3,4)。30~45 Gyの通常照射方法では、重篤な副作用は認められなかった。放射線壊死は、全症例の約6%に出現し、計算上18カ月後までの発症頻度は約26%と報告された5)。分割定位放射線治療と通常照射治療の生存期間は同様であった。定位放射線治療の生存期間に関しては、良好な治療成績は報告されていない5-7)。これらの報告では、0-22%の再手術の追加が報告されている。小線源療法(Brachythearpy)は、他の照射方法と実質的な差はないが、比較的高い再手術率(約44%)が報告されている。腫瘍は一般的に放射線治療後20~27週で再び再発し、比較的高線量を照射しても十分な局所コントロールは得られなかった7)。
|

|
| |
システマティックレビュー結果
|
| |
このCQに応えるため、2000年1月~2019年10月の文献を対象に下記の検索式による文献検索を2019年11月に行った。
|

|
| |
| # |
検索式 |
文献数 |
| #1 |
Recurrent glioma and re-irradiation [MeSH Terms]
|
57 |
| #2 |
Recurrent glioblastoma and re-irradiation [MeSH Terms]
|
13 |
| #3 |
#1+#2 |
57 |
|
| |
以上の検索式より、一次スクリーニングとして57の文献を抽出し、最終的に記下記に示した7の文献を抽出した。
|

|

|
| |
| 文献 |
| 1) |
van den Bent MJ, Afra D, de Witte O, et al. Long-term efficacy of early versus delayed radiotherapy for low-grade astrocytoma and oligodendroglioma in adults: the EORTC 22845 randomised trial. Lancet. 2005;366(9490):985-90.
|
|
| 2) |
Combs SE, Ahmadi R, Schulz-Ertner D, et al. the role of fractionated stereotactic re-irradiation. J Neurooncol. 2005:71(3):319-23.
|
|
| 3) |
Nieder C, Grosu AL, Molls M. A comparison of treatment results for recurrent malignant gliomas. Cancer Treat Rev. 2000;26(6): 397-409.
|
|
| 4) |
Nieder C, Nestle U, Niewald M, et al. Hyperfrac-tionated reirradiation for malignant glioma. Front Radiat Ther Oncol. 1999;33:150-7.
|
|
| 5) |
Shaw E, Scott C, Souhami L, et al. Radiosurgery for the treatment of previously irradiated recurrent primary brain tumors and brain metastases. Int J Radiat Oncol Biol Phys. 1996;34(3):647–54.
|
|
| 6) |
Chamberlain MC, Barba D, Kormanik P, et al. Stereotactic radio-surgery for recurrent gliomas. Cancer. 1994;74(4):1342-7.
|
|
| 7) |
Shrieve DC, Alexander E, Wen PY. Comparison of stereotactic radio-surgery and brachytherapy in the treatment of recurrent glioblastoma multiforme. Neurosurgery. 1995;36(2):275-84.
|
|

|
| |
3.化学療法
|
| |
1) テモゾロミド
Grade II神経膠腫の多くは再発時にGrade III・IV神経膠腫に相当する腫瘍に進行して再発するため、悪性神経膠腫に対する治療として化学療法がおこなわれる。
テモゾロミド(TMZ)は初発Grade II神経膠腫や再発Grade II神経膠腫に対しても有効性が示されており、再発時に使用される1-2)。
欧米での多施設共同臨床試験として、TMZ使用経験のない再発悪性神経膠腫に対してTMZの有効性を検討する第II相試験が施行された3)。162例の初回再発(前治療としてTMZは未使用)の悪性神経膠腫を登録した。TMZは、1日150~200㎎/㎡の本薬を5日間連続投与し、28日を1サイクルとして繰り返し施行した(5-day on/ 23-day off)。6ケ月無増悪生存割合は、46%(95% CI: 38-54)であった。無病生存期間中央値は5.4ケ月であり、12ケ月無増悪生存割合は24%であった。生存期間中央値は、13.6ケ月で、6ケ月と12ケ月の生存割合は、75%と56%であった。奏効率は、35%(完全奏効率8%、部分奏効率27%、不変26%)。毒性は許容範囲であった。
同薬の本邦患者への有効性を検討するためTMZ未治療の成人退形成性星細胞腫(星細胞腫Grade III)初回再発患者32例に対して上記投与法による国内第II相試験が行われた。6ケ月での無増悪生存割合は40.6%、無増悪生存期間中央値は4.1カ月であった。TMZ未治療の再発悪性神経膠腫に対して5-day on/ 23-day off投与法は本邦においても安全に遂行可能であり、優れた忍容性を持つことが判明した4)。
再発悪性神経膠腫は、TMZの再治療に対しても高い治療反応性を示す。RESCUE試験では、120例の再発悪性神経膠腫に対して、TMZ50 mg/m2を毎日連続投与した。再発Grade III神経膠腫のサブグループでは、6ケ月無増悪生存期間は35.7%、1年生存期間は60.7%であった。治療効果は、前治療期間や再発までの無増悪生存期間などによると思われた。良好な効果を示したのは、TMZを6サイクル施行終了前に早期に再発したグループと2ケ月以上の治療効果期間を示したグループであった。再発悪性神経膠腫は、様々なタイプが混在しているので、組織や遺伝子タイプを考慮すべきと思われる5)。TMZ投与後に再発した場合は、他の薬剤を考慮することが必要である。
TMZが現れるまでは、ニトロソウレア剤(ACNU, BCNU, CCNUなど)、PCV療法(PCZ+lomustine+VCR)などが一般的に使用されてきた6)。
[注意]
lomustine: (CCNU):国内未承認
カルムスチン(carmustine,: BCNU):注射薬は国内未承認
|

|
| |
システマティックレビュー結果
|
| |
このCQに応えるため、2000年1月~2019年10月の文献を対象に下記の検索式による文献検索を2019年11月に行った。
|

|
| |
| # |
検索式 |
文献数 |
| #1 |
Recurrent glioma and temozolomiden [MeSH Terms]
|
477 |
| #2 |
Recurrent glioblastoma and temozolomide [MeSH Terms]
|
267 |
| #3 |
#1+#2 |
477 |
|
| |
以上の検索式より、一次スクリーニングとして477の文献を抽出し、最終的に下記に示した6の文献を抽出した。
|

|

|
| |
| 文献 |
| 1) |
Kesari S, Schiff D, Drappatz J, et al. Phase II study of protracted daily temozolomide for low-grade gliomas in adults. Clin Cancer Res. 2009;15(1):330-7.
|
|
| 2) |
Houillier C, Wang X, Kaloshi G, et al. IDH1 or IDH2 mutations predict longer survival and response to temozolomide in low-grade gliomas. Neurology. 2010;75(17):1560-6.
|
|
| 3) |
Yung WK, Prados MD, Yaya-Tur R, et al. Multicenter phase II trial of temozolomide in patients with anaplastic astrocytoma or anaplastic oligoastrocytoma at first relapse. Temodal Brain Tumor Group. J Clin Oncol. 1999;17(9):2762-71.
|
|
| 4) |
西川 亮, 渋井壮一郎, 丸野元彦, et al. 初回再発の退形成性星細胞腫患者に対するTemozolomide単剤投与の有効性および安全性の検討 多施設共同第II相試験. 癌と化学療法. 2006; 33(9): 1279-85.
|
|
| 5) |
Perry JR, Belanger K, Mason WP, et al. Phase II trial of continuous dose-intense temozolomide in recurrent malignant glioma: RESCUE study. J Clin Oncol. 2010;28(12):2051-7.
|
|
| 6) |
Easaw JC, Mason WP, Perry J, et al. Canadian recommendations for the treatment of recurrent or progressive glioblastoma multiforme. Curr Oncol. 2011;18(3):e126-e136.
|
|

|

|
| |
2) ニムスチン(ACNU)
|
| |
海外において再発膠芽腫に対する再発例に対して報告はあるが、概して有効性はあまり示唆されていない1,2)。再発Grade IIIに関しては、本邦において悪性神経膠腫として、以下の報告がある。
TMZの効果増強や抵抗性を克服するためにニトロソウレア剤との併用が報告されている。海外ではBCNUやCCNUとのTMZ併用療法は報告されている。日本ではACNUとの併用療法が報告されている3)。TMZ (150 mg/m2 for 5days) (day 1,2,3,4,5)とACNU(40 mg/m2)(day14)を4週間ごとに投与される。全登録患者は49例であり、Grade III神経膠腫は9例であった。第I相より、推奨用量(RD)は、ACNU(40 mg/m2)となった。第II相40例を解析すると、6カ月PFSは25%, 1年生存割合は49%であった。Grade 3 以上の副作用は、31%であった。無増悪生存期間に対する明らかな影響はなさそうであるが、1年生存期間に対しては延長効果の可能性が示唆された。サイクル数が重なると骨髄抑制が強くなる傾向が認められた。
|

|
| |
システマティックレビュー結果
|
| |
このCQに応えるため、2000年1月~2019年10月の文献を対象に下記の検索式による文献検索を2019年11月に行った。
|

|
| |
| # |
検索式 |
文献数 |
| #1 |
Recurrent glioma and ACNU/nimustine [MeSH Terms]
|
33 |
| #2 |
Recurrent glioblastoma and ACNU/nimustine [MeSH Terms]
|
14 |
| #3 |
#1-#2 |
33 |
|
| |
以上の検索式より、一次スクリーニングとして33の文献を抽出し、最終的に下記に示した3の文献を抽出した。
|

|

|
| |
| 文献 |
| 1) |
Happold C, Roth P, Wick W, et al. ACNU-based chemotherapy for recurrent glioma in the temozolomide era. J Neurooncol. 2009; 92(1): 45-8.
|
|
| 2) |
Wick W, Puduvalli VK, Chamberlain MC, et al. Phase III study of enzastaurin compared with lomustine in the treatment of recurrent intracranial glioblastoma. J Clin Oncol. 2010; 28(7): 1168-74.
|
|
| 3) |
Aoki T, Arakawa Y, Ueba T, et al. Phase I/II Study of Temozolomide Plus Nimustine Chemotherapy for Recurrent Malignant Gliomas: Kyoto Neuro-oncology Group.Neurol Med Chir (Tokyo). 2017 ;57(1):17-27. Epub 2016 Oct 11
|
|

|

|
| |
3) カルムスチン徐放性ポリマー
|
| |
再発悪性神経膠腫の治療におけるカルムスチン徐放性ポリマーの効果を評価するために、ランダム化比較試験が行われた。27施設において、術前に再発悪性神経膠腫と判断された222例が登録された。カルムスチン徐放性ポリマー留置を受けた110例における全生存期間中央値は31週であり、偽薬留置を受けた112人の23週より有意な延長を認めた (HR = 0.67, p = 0.006)。また、再発膠芽腫に限ればカルムスチン徐放性ポリマー留置例の6カ月生存割合は73%で、偽薬群の32%に比べて有意差を認めた (p = 0.02)1)。
Cochrane Database Reviewではカルムスチン徐放性ポリマーは再発症例では効果が乏しいとしており(引用元不明)、Perryらのメタ解析でも、再発患者の一部でメリットが得られるかもしれないが、その予後因子はよくわかっていないという結論である2)。Chowdharyらは、再発のGrade III・IV神経膠腫をあわせて対象とした25の研究を検討し、再発を確認した手術からの生存期間はカルムスチン徐放性ポリマー留置群の方がごく僅かに長い傾向があり、カルムスチン徐放性ポリマー使用で9.7カ月、未使用で8.6カ月、1年生存割合はカルムスチン徐放性ポリマー使用で37%、未使用で34%、TMZ併用で63%であった3)。
以上より、カルムスチン徐放性ポリマーを留置することはGrade III神経膠腫再発例に対して選択肢となり得る。
|

|
| |
システマティックレビュー結果
|
| |
このCQに応えるため、2000年1月~2019年10月の文献を対象に下記の検索式による文献検索を2019年11月に行った。
|

|
| |
| # |
検索式 |
文献数 |
| #1 |
Recurrent glioma and carmustine wafer [abstract]
|
37 |
| #2 |
Recurrent glioblastoma and carmustine wafer [abstract]
|
39 |
| #3 |
#1+#2 |
56 |
|
| |
以上の検索式より、一次スクリーニングとして56の文献を抽出し、最終的に下記に示した3の文献を抽出した。
|

|
<

|
| |
| 文献 |
| 1) |
Brem H, Piantadosi S, Burger PC, et al. Placebo-controlled trial of safety and efficacy of intraoperative controlled delivery by biodegradable polymers of chemotherapy for recurrent gliomas. The Polymer-brain Tumor Treatment Group. Lancet. 1995; 345(8956): 1008-12.
|
|
| 2) |
Perry J, Chambers A, Spithoff K,et al. Gliadel wafers in the treatment of malignant glioma: a systematic review. Curr Oncol. 2007;14(5):189-94.
|
|
| 3) |
Chowdhary SA, Ryken T, Newton HB. Survival outcomes and safety of carmustine wafers in the treatment of high-grade gliomas: a meta-analysis. J Neurooncol. 2015;122(2):367-82.
|
|

|
| |
4) ベバシズマブ
|
| |
悪性神経膠腫は大部分が血管内皮成長因子(vascular endothelial growth factor:VEGF)を発現しているため、VEGFに対するヒト化モノクロナール抗体であるベバシズマブは腫瘍血管増殖を選択的に阻害し、膠芽腫の治療薬となる可能性が示されていた1,2)。
再発Grade IVとIIIの神経膠腫32例(Grade IV:23例、Grade III:9例)に対してベバシズマブ (10 mg/kg, 2週間毎)とイリノテカン(125~340 mg/m2)を投与した第II相試験の研究では画像的に縮小を示したのは、63%(20/32: Grade IV 14/23、Grade III 6/9)、無増悪生存期間中央値は23週 (Grade IV 20週、Grade III 30週)、6ケ月無増悪生存割合は38%、6ケ月生存割合は72%であった。副作用も認容範囲で、効果も確認できた2)。再発膠芽腫に対するベバシズマブ単独あるいはベバシズマブ + イリノテカン併用によるBRAIN試験では、6カ月無増悪生存割合はそれぞれ 42.6%・50.3%で、奏効率は28.2%・37.8%、再発後の生存期間中央値は9.2カ月・8.7カ月と報告された3)。ベバシズマブ単独とイリノテカン併用の治療効果には差が無かった。
本邦では再発悪性神経膠腫に対するベバシズマブ単独療法の有効性・安全性を検討することを目的として、多施設共同第II相試験が開始された。Stuppレジメンでの治療後の初回再発を中心とした悪性神経膠腫を対象として、ベバシズマブ10 mg/kgを2週間隔で病勢進行まで投与した。主要評価項目は再発膠芽腫での6カ月無増悪生存割合、副次評価項目は再発膠芽腫及び全症例に対する6カ月無増悪生存割合、奏効割合、全生存期間、安全性とした。病変評価はMacdonald基準を用いた。2009年8月~2010年7月に31例(初回病理診断: 膠芽腫29例、Grade III 神経膠腫2例)が登録された。膠芽腫患者中初回再発17例、再々発12例であった。再発膠芽腫29例の6カ月無増悪生存割合は33.9% (90%CI:19.2-48.5)、無増悪生存期間中央値3.3カ月(95%CI:2.8-6.0)、奏効割合27.6%、1年生存割合34.5% (90%CI:20.0-49.0)、全生存期間10.5カ月(95%CI:8.2-12.4)であった。全32例中7例(24.1%)で6カ月以上の効果が確認された。ベバシズマブ投与回数中央値は6回であった。主な有害事象は尿蛋白(41.9%)、高血圧(32. 3%)、下痢(25.8%)であり、Grade 3以上の有害事象は41.9%に発現した。治療を要した高血圧は6例(19.4%)に観察され、ベバシズマブとの因果関係が否定できない重篤な有害事象は4例(12.9%、虫垂炎、深部静脈血栓症、心不全、痙攣)に認められた。投与中止に至った有害事象は脳出血(Grade 1)と好中球減少(Grade 2)の2例(6.5%)であった。これらの結果より、ベバシズマブ単独療法は、本邦においても忍容性が高く、膠芽腫再発を含めた再発悪性神経膠腫に対する有望な治療法の一つであると思われる4)。
1p/19q共欠失のないGrade II・III神経膠腫の再発に対して、しばしばベバシズマブが使われてきた。比較試験は行われていなかったが、2018年TMZ単独群とTMZ+ベバシズマブ併用療法群の比較第II相試験の結果が報告された5)。当該施設にて1p/19q共欠失を認めないGrade II・III神経膠腫において放射線治療後の初回再発例を登録した。前化学療法は中止から6ケ月経過していれば登録可となっている。TMZ200㎎/m2を5日間、4週間毎で最大12サイクル施行する。ベバシズマブ10 mg/m2を2週間ごとに再発するまで投与する。155例を登録し、年齢中央値44歳、解析した124例中88例(70%)はIDH変異があった。12ケ月生存割合は、TMZは61%、TMZ+ベバシズマブは55%であった。奏効率としてTMZは42%、TMZ+ベバシズマブは49%であった。IDH1変異型とIDH野生型では、生存期間は、15ケ月と10.7ケ月(p=0.001)であり、無増悪生存期間は、6.7ケ月と5.1ケ月(p=0.056)であった。高次機能には有意差はなかった。つまり、1p/19q共欠失のないGrade II・III再発神経膠腫に対して、IDH変異状態に関わらず、TMZにベバシズマブを追加することは、生存期間、無増悪生存期間や高次機能に対して有意な上乗せ効果は認められなかった6) 。
|

|
| |
システマティックレビュー結果
|
| |
このCQに応えるため、2000年1月〜2019年10月の文献を対象に下記の検索式による文献検索を2019年11月に行った。
|

|
| |
| # |
検索式 |
文献数 |
| #1 |
Recurrent glioma and bevacizumab [MeSH Terms]
|
492 |
| #2 |
Recurrent glioblastoma and bevacizumab [MeSH Terms]
|
391 |
| #3 |
#1+#2 |
6 |
|
| |
以上の検索式より、一次スクリーニングとして492の文献を抽出し、最終的に下記に示した6の文献を抽出した。
|

|

|
| |
| 文献 |
| 1) |
Vredenburgh JJ, Desjardins A, Herndon JE, et al. Bevacizumab plus irinotecan in recurrent glioblastoma multiforme. J Clin Oncol. 2007; 25(30): 4722-9.
|
|
| 2) |
Vredenburgh JJ, Desjardins A, Herndon JE, et al. Phase II trial of bevacizumab and irinotecan in recurrent malignant glioma. Clin Cancer Res. 2007; 13(4): 1253-9.
|
|
| 3) |
Friedman HS, Prados MD, Wen PY, et al. Bevacizumab alone and in combination with irinotecan in recurrent glioblastoma. J Clin Oncol. 2009; 27(28): 4733-40.
|
|
| 4) |
Nagane M, Nishikawa R, Narita Y, et al. Phase II study of single-agent bevacizumab in Japanese patients with recurrent malignant glioma. Jpn J Clin Oncol. 2012;42(10):887-95.
|
|
| 5) |
van den Bent MJ, Klein M, Smits M, et al. Final results of the EORTC Brain Tumor Group randomized phase II TAVAREC trial on temozolomide with or without bevacizumab in 1st recurrence grade II/III glioma without 1p/19q co-deletion. J Clin Oncol. 2017;35(15 Suppl):2009-2009.
|
|
| 6) |
van den Bent MJ, Klein M, Smits M, et al. Bevacizumab and temozolomide in patients with first recurrence of WHO grade II and III glioma, without 1p/19q co-deletion (TAVAREC): a randomised controlled phase 2 EORTC trial. Lancet Oncol. 2008;19(9):1170-9.
|
|

|
| |
5) プラチナ製剤
|
| |
成人再発Grade III神経膠腫のみを対象とした報告は極めて少なく、殆どが再発Grade IVと併せた報告である。現在、日本で他のがん治療に使用されているプラチナ製剤にシスプラチン、カルボプラチン、ネダプラチン、オキサリプラチンがあるが、ヒトでの抗脳腫瘍効果を検討したものはシスプラチンとカルボプラチンである。
Yungらは、1991年に再発悪性神経膠腫に対してカルボプラチン単剤の治療の有効性を報告した。30例の再発悪性神経膠腫に対して、カルボプラチン400~450 mg/m2を4週おきに投与した。奏効割合は14%、無増悪生存期間中央値は26週であった。軽微な血小板減少と顆粒球減少は観察されたが、重篤な合併症はなかった。Grade 3以上の骨髄抑制は約10%程度であった1)。
再発悪性神経膠腫に対するカルボプラチンとエトポシドによる併用化学療法を使用した第II相試験は2件の報告がある。Jeremicらは38例の再発悪性神経膠腫に対してカルボプラチン300 mg/m2(3日間)、エトポシド100 mg/m2 (5日間)を4週間毎に投与した。奏効割合21%、無増悪生存期間中央値は42.5週であった。Grade3以上の白血球減少は37%、血小板減少は42%に観察された2)。また、Franceschiらは再発膠芽腫25例と再発退形成性星細胞腫5例、計30例に対して、放射線治療後に4週ごとに、3日間連続して1日あたりカルボプラチン100 mg/m2とエトポシド120 mg/m2を投与した。6カ月無増悪生存割合が33.3%、無増悪生存期間中央値は4カ月、全生存期間中央値は10カ月であった。Grade3/4の好中球減少を30例中13例(32.5%)に認めた3)。
本邦でもAokiらにより、低用量のICE療法(イホスファミド、カルボプラチン、エトポシド)の再発膠芽腫に対して第II相試験が行われている。1999年7月~2005年3月の39例の再発膠芽腫が登録された。イホスファミド ( 1000 g/m2/日, 第1、2、3治療日 ), カルボプラチン( 110 mg/m2/日, 第1治療日), エトポシド( 100 mg/m2/日, 第1、2、3治療日)を6週間ごとに投与する化学療法を行った。Grade3/4の血液学的毒性は8%。臨床検査値の異常は12%に出現した。奏効割合25%、無増悪生存期間中央値は17週、6カ月、12カ月無増悪生存割合はそれぞれ39% と11%であった4)。
本邦でも再発悪性神経膠腫28例(Grade IVが14例、Grade IIIが14例)に対しカルボプラチン(300 mg/m2)をday 1、エトポシド(60 mg/m2)をday 1-5に投与した第II相試験で、再発Grade III神経膠腫でCR 0例、PR 5例、SD 6例、再発から死亡までの中央値が24.6カ月、全生存中央値が54.1カ月と比較的良好であった5)。
薬剤の脳移行性改善薬であるRMP-7は日本未承認薬であるが、これとカルボプラチンを併用した研究は比較的質が高い。再発神経膠腫121例(中央病理でGrade IVが87例、Grade IIIが34例)が参加した二重盲検ランダム化比較試験の結論はRMP-7で上乗せ効果を認めないというものだったが、サブグループ解析で再発Grade III神経膠腫のカルボプラチンのみの投与群で無増悪期間中央値が8.6週、生存期間中央値は24.7週だった6)。主要評価項目ではないため結論は導けないが、これはランダム割り付けされた再発Grade III神経膠腫に対するカルボプラチン単独の希少な治療成績となる。
プラチナ製剤を含んだ化学療法は再発膠芽腫、再発悪性神経膠腫に一定の治療効果を示しているが、プロトコール構成薬剤が本邦では神経膠腫に対して適応がないこと、入院治療が必要になる場合が稀ならず存在することなどが、今後の対応課題である。
[注意]
carboplatin(カルボプラチン):適応外使用
etoposide(エトポシド):適応外使用
ifosphamide(イホスファミド):適応外使用
|

|
| |
システマティックレビュー結果
|
| |
このCQに応えるため、2000年1月~2019年10月の文献を対象に下記の検索式による文献検索を2019年11月に行った。
|

|
| |
| # |
検索式 |
文献数 |
| #1 |
Recurrent glioma and carboplatin [MeSH Terms]
|
85 |
| #2 |
Recurrent glioma and cisplatin [MeSH Terms]
|
61 |
| #3 |
Recurrent glioblastoma and carboplatin [MeSH Terms] |
34 |
| #4 |
Recurrent glioblastoma and carboplatin [MeSH Terms] |
20 |
| #5 |
#1-#4 |
141 |
|
| |
以上の検索式より、一次スクリーニングとして141の文献を抽出し、最終的に下記に示した6の文献を抽出した。
|

|

|
| |
| 文献 |
| 1) |
Yung WK, Mechtler L, Gleason MJ. Intravenous carboplatin for recurrent malignant glioma: a phase II study. J Clin Oncol. 1991; 9(5): 860-4.
|
|
| 2) |
Jeremic B, Grujicic D, Jevremovic S, et al. Carboplatin and etoposide chemotherapy regimen for recurrent malignant glioma: a phase II study. J Clin Oncol. 1992; 10(7): 1074-7.
|
|
| 3) |
Franceschi E, Cavallo G, Scopece L, et al. Phase II trial of carboplatin and etoposide for patients with recurrent high-grade glioma. Br J Cancer. 2004; 91(6): 1038-44.
|
|
| 4) |
Aoki T, Mizutani T, Nojima K, et al. Phase II study of ifosfamide, carboplatin, and etoposide in patients with a first recurrence of glioblastoma multiforme. J Neurosurg. 2010; 112(1): 50-6.
|
|
| 5) |
Watanabe K, Kanaya H, Fujiyama Y, et al. Combination chemotherapy using carboplatin (JM-8) and etoposide (JET therapy) for recurrent malignant gliomas: a phase II study. Acta Neurochir (Wien). 2002;144(12):1265-70.
|
|
| 6) |
Prados MD, Schold SC, Fine HA, et al. A randomized, double-blind, placebo-controlled, phase 2 study of RMP-7 in combination with carboplatin administered intravenously for the treatment of recurrent malignant glioma. Neuro Oncol. 2003 ;5(2):96-103.
|
|

|

|

|
|

|
| |

|
|

|
|

|
|

|
|

| | |



