
|
| 成人転移性脳腫瘍 改訂のポイント
|

|
| |
● |
本ガイドラインの作成は「Minds 診療ガイドライン作成の手引き2014」に準拠していないが、推奨の強さの提示方法についてはユーザーが理解しやすいよう便宜的に「Minds 診療ガイドライン作成の手引き2014」と同様の推奨度の記載に変更した。 |
| |
● |
CQ1-a 単発あるいは少数個の転移性脳腫瘍の治療はどう選択するのか? |
| |
|
• |
推奨1 推奨度を「2B」に改めた。 |
| |
|
• |
推奨2 「腫瘍摘出術+全脳照射」を「腫瘍摘出術+放射線治療」に改めた。 |
| |
|
• |
推奨3 「全脳照射に加えて定位放射線照射」を「薬物療法に高感受性とされる腫瘍を除き、厳重なフォローアップを前提に定位放射線照射(STI)」に変更した。 |
| |
|
• |
推奨4、6を整理・吸収して、合計4個の推奨にまとめた。 |
| |
● |
CQ 1-b 多数個の転移性脳腫瘍の治療はどう選択するのか? |
| |
|
• |
推奨4「腫瘍摘出術」を「腫瘍摘出術+放射線治療」に改めた。 |
| |
● |
CQ 3 再発の転移性脳腫瘍の治療はどう選択するのか? |
| |
|
• |
推奨2 「新規脳内病変」を「新規脳内病変あるいは局所再発病変」に改めた。 |
|

|

|
| 成人転移性脳腫瘍 総論
|

|
| |
1 本ガイドラインの目的
|

|
| |
|
固形がんの転移性脳腫瘍,髄膜がん腫症,頭蓋骨転移に罹患している個々の成人症例において,適切な治療方針を検討するうえで必要となる重要な臨床事項を臨床的疑問(clinical question:CQ)として提示し,本ガイドライン作成時点でのエビデンスに基づく推奨事項を述べる。 |
|

|
| |
2 対象患者
|

|
| |
|
固形がんの転移性脳腫瘍,髄膜がん腫症,頭蓋骨転移に罹患している成人患者。 |
|
| |
3 利用対象者
|

|
|
|

|
| |
4 転移性脳腫瘍の概括
|

|
| |
| |
1. |
転移性脳腫瘍の現状
症候性の転移性脳腫瘍はがん患者の8~10%に発生すると報告され1,2),剖検データによる頭蓋内転移の頻度は16~26%である3-5)。我が国における罹患者数について正確なデータはないが,年間数万人以上と推計されており,原発性の中枢神経系腫瘍よりもはるかに多いと見積もられている5-7)。
転移性脳腫瘍は全人的な生活の質(quality of life:QOL)と生存期間に強い影響を与える8,9)。臨床腫瘍学の目覚ましい進歩により患者の生存期間が延長するにつれ,遅発性合併症としての転移性脳腫瘍の罹患率は増大している10)。一方では,MRIなど診断技術の開発や定位放射線照射(stereotactic irradiation:STI)など治療法の進歩が広く普及しつつある。このような背景とともに,転移性脳腫瘍の治療方針は放射線治療を基盤とするものから,最近では集学的治療の視点から広く考察されるようになり,予後分類システム,外科的摘出術とSTIの比較,治療に伴う認知機能の低下など,さらに多くの臨床課題が検討されるようになっている。
転移性脳腫瘍の治療方針は,脳転移の数や大きさ,がん種ごとの生物学的特徴,全身状態や治療歴など多様な患者背景と,各施設で適用できる治療手段などを考慮する必要がある。個々の患者情報を整理し,またバイアスを最小とするために,複数の診療科や多職種によるカンファレンス(キャンサーボード)など,少なくとも脳神経外科,原発巣を担当する診療科,放射線治療科の合議による治療方針の決定が望ましい。本ガイドラインは,成人の固形がんの転移性脳腫瘍,髄膜がん腫症,頭蓋骨転移について,これらの治療方針の議論の出発点となり,より適切な判断を行うために臨床医と患者を支援するものである。なお,脊髄転移,脊椎転移,造血器腫瘍の脳転移は除いている。
転移性脳腫瘍の77~87%はテント上,15~25%はテント下に発生する5,11,12)。血行性に転移するため,特に小動脈にがん細胞が塞栓して転移が始まると考えられている5)。剖検と画像診断の結果などから,単発は32~53%,多発は47~68%と報告されている4,5,11,12)。転移の個数が治療成績に影響することから,治療戦略を検討する研究では転移の個数が重要な因子となり,転移の個数によって対象を限定して研究が実施されてきた。少数個では,1990年のPatchellらのランダム化比較試験から始まり,それ以降もエビデンスレベルが高い研究が単発で4件,1~3個で2件,1~4個で1件報告されている13-19)。一方,多数個の転移については,後方視的な研究が多いが,近年いくつかのランダム化比較試験が報告されている20,21)。また,STIを受けた患者の追跡調査によると,単発では13%,2~3個では34%,4~5個では100%に新規病変が出現したという報告がある22)。また,定位手術的照射(stereotactic radiosurgery:SRS)で治療された117例の前方視的研究では,新規病変が出現するまでの中央値は転移の個数が1~2個では14.3カ月,3個以上では4.3カ月であったと報告されている23)。ただし,これらの研究では,画像診断による個数の評価の限界24),個数の評価にCTのみも容認する場合があるなどさまざまな条件下で実施されていること,またそれらの条件に変遷があることに注意が必要である。
本ガイドラインでは,治療方針の検討にあたっては単発と多発と二分するよりも,単発,少数個,多数個の3群に分けたうえでエビデンスを整理することが妥当と考えた。最近の臨床研究の傾向も踏まえ,1と2個の間,および4と5個の間に暫定的な2カ所の境界を採用し,表1のマトリックスに示される推奨を解説する。
|

|
| |
|
| 表1 本ガイドラインで採用した転移の個数による各治療法の推奨度
|
| 治療法 |
腫瘍摘出術 |
定位放射線照射 |
全脳照射 |
薬物療法 |
| 単発 |
推奨度1B |
推奨度1B |
推奨度2B |
症状がない場合推奨度2C |
| 少数個(2~4個) |
推奨度2B |
推奨度1B |
推奨度2B |
| 多数個(5個以上) |
推奨度2C |
推奨2C |
推奨度1A |
|
|

|
| |
2. |
神経学的機能障害および症状と生命予後への影響
転移性脳腫瘍や髄膜がん腫症によって出現する神経学的障害には,巣症状,てんかん発作,頭蓋内圧亢進症状,高次脳機能障害と精神症状がある。髄膜がん腫症では,これらに加えて髄膜刺激症状,脳神経症状,肩/後頸/背部痛,頭痛を呈する。これらはいずれも患者の日常生活の活動性,全身状態(performance status:PS)を著しく低下させる。一般に,転移性脳腫瘍や髄膜がん腫症は,診断後の生存期間中央値はおよそ3カ月程度である25,26)。
このように,転移性脳腫瘍や髄膜がん腫症は,神経学的機能障害による全人的機能の低下や,ときに原発巣に対する治療の中断を余儀なくされることがあるため,他の臓器への転移とは異なる対応が必要である27)。原発巣および脳病変以外の遠隔転移に対する治療の必要性と切迫性,転移性脳腫瘍を除いた状況を仮定して予想される余命,転移性脳腫瘍による神経症状のQOLへの影響と進行の予測,重要臓器の機能障害などについて,速やかな情報収集とともに,原発巣を担当する診療科との協議が必須である。これらの総合的な検討をもとに,転移性脳腫瘍による生命予後への影響がそれ以外による影響と比較して同等以上であれば,原則として転移性脳腫瘍の治療が優先される。これは,転移性脳腫瘍の治療が,人格の保護,不可逆的な脳機能障害の回避,PSの改善につながることを前提としているからに他ならない。転移性脳腫瘍を持つ患者の死因は,中枢神経死,他臓器病変の進行,または治療関連死に分けられる。したがって,転移性脳腫瘍に対する治療の重要な目的は,中枢神経死と神経学的機能障害を減らす,あるいは遅らせることである。臨床研究においては,これらを評価項目とすべきであるが,実際の臨床では中枢神経死と他臓器病変の進行による死亡を鑑別することは,しばしば困難である。
|

|
| |
3. |
原発巣の違いによる病態の差異
(1)転移性脳腫瘍の頻度
転移性脳腫瘍の半数は肺がんから,2番目に乳がんから発生するとされる。がん種別には,小細胞肺がんの40%以上,非小細胞肺がんの17~25%,乳がんの1.4~5%の患者に転移性脳腫瘍を認める1)。また,悪性黒色腫から発生する転移性脳腫瘍の頻度も高く,進行例では30%以上と報告されている28)。臨床的には単発は前立腺がん,消化器がん,腎細胞がんに多く,多発は小細胞肺がん,乳がん,悪性黒色腫,非小細胞肺がんの順に多く発見される12)。がんの既往を持たない患者に症候性の転移性脳腫瘍が発見される頻度は5~40%までさまざまであり,転移性脳腫瘍の3~15%では,詳細な全身検索を実施しても原発巣が不明であったと報告されている12)。
転移性脳腫瘍発生のリスク因子は,原発巣によって異なる。肺がんでは小細胞肺がん,乳がんではサブタイプの一つであるトリプルネガティブ乳がん(ホルモン受容体およびHER2がともに陰性),悪性黒色腫では頭頸部発生と原発部の潰瘍形成が有意なリスク因子とされ,これらについては全身的には進行がんではなくとも脳転移が発生することがある5,29-31)〔注釈:乳がんのサブタイプとは,エストロゲン受容体(estrogen receptor:ER)とプロゲステロン受容体(progesterone receptor:PgR),HER2,Ki-67などによって定義された分類である〕。
転移性脳腫瘍による症状は,がん種や組織型による違いよりも,転移部位と周囲の脳浮腫の程度に依存する。肺がん,悪性黒色腫,乳がん,腎細胞がん,甲状腺がん,絨毛がん,肝細胞がんは,脳内出血をきたしやすく卒中様の発症もみられる32,33)。
(2)髄膜がん腫症の頻度
髄膜がん腫症は,がん細胞が軟膜やくも膜に広がりをもって浸潤あるいは播種をきたした病態であり,がん患者の4~15%に発生するとされ,増加傾向にある34)。患者数では,肺がんと乳がんが多くを占めており,次に欧米では悪性黒色腫が多く,我が国では消化器がんが多い34,35)。がん種別の発生では,悪性黒色腫からが最も頻度が高い。髄膜がん腫症を発症してからの生存期間は乳がんが最も長く,悪性黒色腫が最も短い36)。髄膜への転移は血行性,リンパ行性,あるいは直接的に波及して浸潤する。転移性脳腫瘍の治療中に髄膜がん腫症を発症することがあり,悪性黒色腫や後頭蓋窩の転移の場合に多いとされる37)。
(3)治療の概要とがん種別の感受性
①腫瘍摘出術
術前画像診断や術中モニタリングの発達,低侵襲手術の普及によって,腫瘍摘出術が原因となる死亡は減少している。ただし,腫瘍摘出術の成績をがん種別に比較した報告はない。分割切除(ピースミール)の摘出法は,一括切除(en-block摘出)またはSRSと比較して,術後の髄膜がん腫症が多い37,38)。悪性黒色腫,肺がん,乳がんでは術後に播種を起こしやすく,特に悪性黒色腫は術後早期に播種をきたす危険性が高い37)。
②放射線治療
STIが発達したことによって,手術侵襲を避け,短期間で完遂する放射線治療が普及した。歴史的には,全脳照射は50年以上にわたって中心的治療であり,エビデンスレベルの高い研究も多い。全脳照射の適応は,腫瘍摘出術またはSTIの適応がない場合,腫瘍摘出術またはSTI治療後の補助療法(アジュバント),5個以上の多発腫瘍の場合などである。
有害事象は数週間程度で発症する急性反応,1~6カ月の早期反応,6カ月以降の晩期障害に分けられ,長期の経過観察では白質障害が50~90%に出現するという報告がある39)。この白質障害がすべて認知機能障害,QOLの低下と結びつくわけではないが,海馬に従属する認知機能障害の他に,脳組織の炎症による認知機能の障害とその予防法に関する知見が蓄積されつつある40)。また,転移性脳腫瘍患者の認知機能障害には多数の因子が関与しており,腫瘍,治療(放射線,抗がん薬,抗てんかん薬など),患者背景(年齢,糖尿病の合併など)の条件に影響される41)。Meyersらは,ランダム化比較試験の副次評価項目としての解析により,認知機能の低下は転移性脳腫瘍の大きさに比例するとした42)。また,別のランダム化比較試験の副次評価項目の報告では,被検者の減少により12カ月までの分析に留まるが,腫瘍摘出術またはSRS後に補助療法として全脳照射を受けた群では複数の健康関連QOL指標の一時的な低下が認められている43)。このように転移性脳腫瘍の患者の認知機能障害・QOLに関する研究は,生命予後や全身状態による制約を受ける。
放射線壊死はSRS後の数カ月~3年間に7~50%に出現すると報告されている44)。臨床的に問題となる症例は1~6%とされ,一般にはステロイドの投与が行われるが,外科的治療が必要になる場合もある44-46)。放射線感受性は腎細胞がん,悪性黒色腫,肉腫では低く,小細胞肺がん,胚細胞腫では高い。その他のがん種は中間と考えられている(表2)47,48)。なお,放射線感受性が低いがん種に対しても,STIが有効な場合がある47)。予防的全脳照射の有効性が証明されているのは小細胞肺がんのみである49)。
|

|
| |
|
| 表2 がん種による放射線感受性
|
| 高 |
小細胞肺がん,胚細胞腫瘍 |
| 中 |
乳がん,非小細胞肺がんなど |
| 低 |
悪性黒色腫,腎細胞がん,肉腫 |
|
|

|
| |
|
③薬物療法
一般に中枢神経系は血液脳関門によって守られているため,水溶性薬剤や分子量の大きい抗体薬などはこれを通過しにくい。また,転移性脳腫瘍そのものによる薬剤耐性も重要な問題である50)。しかし,分子標的治療薬の開発をはじめとして,がんの全身薬物療法が急速に進歩しているなか,転移性脳腫瘍を対象とする新たな薬物療法への期待も高い。中枢神経症状の有無,それぞれの腫瘍の薬物療法への感受性,薬剤の血液脳関門通過性などを総合的に判断し,有効な治療法の一つとして選択される機会が増えている50)。一方,全身投与された薬物による中枢神経毒性については,放射線障害と同様に急性期および晩期の障害がそれぞれ認識されており,病態とリスク因子の研究が行われている51)。
④ベストサポーティブケア
腫瘍摘出術,放射線治療,薬物療法は,ある程度のリスクを受け入れながら積極的な治療的介入を行うことにより,根治,延命,症状緩和や機能の改善を目指すものである。これに対して,ベストサポーティブケア(best supportive care:BSC)では,病変に対する直接の治療は終了し,症状緩和と看取りなどにケアと支援の重点を置く。ときに患者の家族もBSCの対象となる。キャンサーボードなどで原発巣と中枢神経系の病変,全身状態を正確に評価したうえで,積極的治療のリスクが期待される効果を上回ると判断される場合,中枢神経の病態がすでに不可逆的で重篤な状態であると判断される場合,また患者自身の希望も考慮して選択される。神経学的症状の緩和方法には,ステロイドや抗てんかん薬などの投薬,多職種による神経学機能障害の援助が含まれる27)。
|

|
| |
4. |
リスク因子と生存期間の予測
放射線治療や外科的治療の技術革新,そして薬物療法の進歩により,転移性脳腫瘍の治療を原発巣の特性や患者の臨床的な背景に基づいて個別化すべきであるという認識が広まっている。同時に,転移性脳腫瘍の患者の予後因子は非常に多岐にわたり,単純な方針では個々の適応判断には対応できないことも認識されている。さらに,治療方針の決定には,患者の将来の生存期間,生活像,全身治療の可能性,施設ごとに選択可能な治療モダリティを十分に把握する必要がある。
このような背景のもと,1997年Gasparらは,Radiation Therapy Oncology Group(RTOG)臨床試験に登録された1,200例のデータの後方視的解析をもとに,予後因子として recursive partitioning analysis(RPA)指標を発表した9)。その後,この指標は多数の患者群で検証され,臨床研究における層別化因子として使用されてきた(表3)52)。しかし,RPA指標には,原発巣による分類がない,転移の個数が考慮されていない,最近の分子標的治療薬をはじめとする全身薬物療法の進歩に対応していないという弱点があった。
|

|
| |
|
| 表3 Recursive partitioning analysis(RPA)(文献9,52より作成)
|
| クラス |
患者の特徴 |
生存期間中央値(月) |
オリジナル
1979~1993年9) |
Review
1997~2008年52) |
| Ⅰ |
次のすべて
KPS 70%以上
65歳未満
原発巣がコントロールされている
頭蓋外転移なし |
7.1 |
15~29 |
| Ⅱ |
KPS 70%以上かつクラスⅠに該当しない |
4.2 |
5.5~11 |
| Ⅲ |
KPS 60%以下 |
2.3 |
1.4~9 |
|
| KPS:Karnofsky performance status
|
|

|
| |
|
2008年Sperdutoらにより,4件のRTOG臨床研究データの多変量解析の結果から,graded prognostic assessment(GPA)が発表された(表4)53)。これは有意なリスク因子の重要度によって点数化し,合計点グループごとに生存期間を提示する方法である。その後,GPAは転移性脳腫瘍の個数を加味し,原発巣ごとに分けた診断別指標に発展した。診断別GPAでは,乳がん,肺がん(小細胞および非小細胞),消化器がん,悪性黒色腫,腎細胞がんの各疾患別に評価因子とスコアの割り付けが決められており,それぞれ生存期間を予測できる(表5)54)。GPAの他にも複数の予後予測スコアが提唱され,現在も検証が続けられるとともに,臨床試験の患者層別化因子として使用されている。各指標に用いられるKarnofsky performance status(KPS)については表6を参照いただきたい。
|

|
| |
|
| 表4 オリジナルのGraded prognostic assessment(GPA)のスコア因子(文献53より改変)
|
| スコア因子 |
| 年齢 |
| KPS |
| 中枢神経系への転移の個数 |
| 頭蓋外への転移 |
|
|

|
| |
|
| 表5 診断別GPAのスコア因子(文献54より作成)
|
| 診 断 |
スコア因子 |
| 小細胞肺がんと非小細胞肺がん |
年齢,KPS,頭蓋外への転移,脳転移の個数, EGFR/ALK遺伝子 status |
| 悪性黒色腫 |
KPS,脳転移の個数, BRAF遺伝子 status |
| 乳がん |
KPS,サブタイプ,脳転移の個数, 年齢 |
| 腎細胞がん |
KPS,脳転移の個数, 頭蓋外への転移,Hb |
| 消化器がん |
KPS, 年齢, 頭蓋外への転移, 脳転移の個数 |
|
|

|
| |
|
| 表6 Karnofsky performance status(KPS)
|
| KPS |
状 態 |
| 100%
| 正常。自他覚症状がない。 |
| 90 |
通常の活動ができる。軽度の自他覚症状がある。 |
| 80 |
通常の活動に努力が要る。中等度の自他覚症状がある。 |
| 70 |
自分の身の回りのことはできる。通常の活動や活動的な作業はできない。 |
| 60 |
時に介助が必要だが,自分でやりたいことの大部分はできる。 |
| 50 |
かなりの介助と頻回の医療ケアが必要。 |
| 40 |
活動にかなりの障害があり,特別なケアや介助が必要。 |
| 30 |
高度に活動が障害され,入院が必要。死が迫った状態ではない。 |
| 20 |
非常に重篤で入院が必要。死が迫った状態ではない。 |
| 10 |
死が迫っており,死に至る経過が急速に進行している。 |
|
出典:Karnofsky DA, et al. Cancer. 1948;1(4):634-56.
(National Cancer Institute – Common Toxicity Criteria (NCI-CTC Version 2.0, April 30, 1999) 日本語訳JCOG版-第2版より引用。JCOGホームページ https://jcog.jp/ )
|
|

|
| |
|
さらに,上記の群間比較から,患者ごとの生命予後を算出する方法として,リスク因子の合計点をノモグラムでプロットし,推定余命へ換算する方式が種々提案されている55,56)。複数のがん種を含む場合と,原発がんに特異的なノモグラムを作成する場合がある(注釈:ノモグラムとは二次元の図表であり,既知のスコアから作成した直線上の目盛りを結ぶことにより,関数計算の解を求めることができる)。
前記のRPAとGPAは,RTOGによる臨床試験の多数のデータの後方視的解析に基づいてリスク因子と生存期間を推定したものである。対象は全脳照射を受けた肺がんや乳がんの症例が多く,したがって,あくまで全脳照射を前提とした臨床の参考とすべきであり,STIが普及した日本の実情とは異なる可能性を念頭に置く必要がある。また,GPAのスコアは腫瘍摘出術後の生存期間とは関連したが,3カ月後の生存割合,合併症やPSの改善とは関連しなかったとの報告もある57)。同様にノモグラムも後方視的に解析された評価であり,その治療体系はデータを収集した時期によって異なることにも注意が必要である。がんの全身療法や医療技術の急速な進歩を踏まえて,これらの予後予測は常に改訂されなければならない。
一方,髄膜がん腫症には,このような多数症例のデータを解析した指標は発表されていない。生存期間の延長に寄与する因子は,乳がんであること,PSが良好であること,原病の診断から髄膜がん腫症の診断まで1年以上経過していること,髄注化学療法の治療歴があること,などの報告がある35)。
|

|
| |
5. |
治療前評価と治療効果判定
(1)治療前画像診断
神経学的症状が急激に発生した場合,緊急の単純CTで頭蓋内出血,急性水頭症,脳ヘルニアなどの正確な状況を把握しなければならない。鑑別診断,治療適応の判断,またSTIの標的同定には,腫瘍自体の数や性質について,CTよりもMRIの感度が優れている58)。特に後頭蓋窩病変や髄膜がん腫症ではMRIによる診断が望ましい。日本医学放射線学会編「画像診断ガイドライン2016年版」によると,造影MRIによる画像診断を推奨している59)。通常量の造影剤では不明確な症例や単発の転移では,造影剤を2倍量使用することが望ましいとされるが,他の撮像条件には規定はない。米国神経放射線学会(ASNR)の「MRI画像診断ガイドライン」では,脳病変には切片厚5 mm以下,切片間2.5 mm以下,必要に応じてより薄いスライス厚にしてもよいとされている60)。
一方,STIの際には,頭部を固定後に,より薄いスライス厚(1~3 mm厚)で3D撮影を行う。SRS単独では脳内の遠隔再発のリスクが高いことが明らかとなり,そのため可能な限り小病変を検出して治療標的とする試みがなされている。ただし,STIでは腫瘍体積の合計が生命予後や局所コントロールにおける有意な因子であるものの,転移の個数は重要な因子ではないとの報告がある61)。
通常の診断用MRI画像と高分解能MRIで高用量の造影剤を用いた画像を比較した研究では,40%で新たに病変が発見されており,初回の病変数が多いほど新病変の頻度も高かった24)。一方,転移性脳腫瘍の検出を目的として1.5テスラMRI画像を用いた136例の前方視的研究では,造影剤の3倍量投与は偽陽性が増加するため,すべての症例に有用ではなく,通常量の造影剤では診断が未確定の症例や単発と診断された症例に限って推奨している62)。このように,小さい病変や造影されにくい病変は,MRIでも検出しきれない可能性を念頭に置くことが必要である。
FDGポジトロン断層法(2-[18F]-fluoro-2-deoxy-D-glucose positron emission tomography:FDG-PET)検査は,転移性脳腫瘍と脳とのコントラストが得られないため,転移性脳腫瘍の診断には適していない63)。また,播種性病変を疑う症例では,造影前後のFLAIR画像とT1強調画像で小脳の矢状断および大脳の冠状断に注目すると,造影FLAIRで脳溝内の造影病変が明らかになる場合がある64)。
(2)治療前全身評価
原発巣がコントロールされているか,頭蓋外の重要臓器への転移の有無,その他の背景を確認するために,腫瘍マーカーを含む血液検査,循環器系検査,および一般的な身体所見による評価を行う。原発巣や他臓器への転移の評価にはFDG-PETが勧められ,これが実施困難な場合には体幹部の造影CTおよび骨シンチグラフィが勧められる65)。ただし,原発巣のステージによってはFDG-PETが不要とされる65)。治療方針の決定には,転移性脳腫瘍が制御されたと仮定して,その他の臓器,全身病態の評価による予後の推定が必須である。
(3)治療効果判定
従来は生存期間と画像上の局所・脳内遠隔の制御が治療効果の判定指標とされることが多かったが,近年では神経学的症候,認知機能を含む高次脳機能,PS,QOLも治療効果の指標として重視される傾向にある43)。手術摘出度の評価には,組織炎症と残存腫瘍の見極めのため,術後72時間以内の造影検査が推奨される。CTよりも造影MRIが空間分解能において優れている59,60)。
①画像評価
局所の再発,遠隔再発,治療による浮腫などを観察するため,治療直後,1カ月後,その後は3カ月ごとに1年後まで,神経学的診察とMRI診断が継続して行われることが多いが,必要に応じて間隔を短縮する。1年後からは,脳を含む全身状態を参考に間隔を判断する。
効果判定にはresponse evaluation criteria in solid tumors(RECIST)評価法,WHO評価法,Macdonald評価法,体積測定,その他が用いられてきた66-68)。なかでもRECIST法は,固形がんの治療効果を評価するために開発され,腫瘍医にはなじみのある評価法である。主な判定基準は,完全奏効〔complete response:CR(画像上で全標的病変の消失)〕,部分奏効〔partial response:PR(長径の和が30%以上減少)〕,進行〔progressive disease:PD(最小の長径の和と比較して20%以上増加)〕,安定〔stable disease:SD(PRには縮小が不十分かつPDには増大が不十分)〕である。より客観的にCR,PRを評価確定するには4週間以上の間隔で,またSDの確定には6~8週以上の間隔で再検査する。一方,髄膜がん腫症の画像評価は困難なことがあり,髄液所見,神経学的臨床所見を総合して判断する。
②放射線壊死の診断
STIの数カ月~約1年後に出現する放射線壊死と局所再発との鑑別は重要な課題である。出現時期,神経症状,通常の造影MRIの所見などからは鑑別困難である。CT灌流画像,MRI灌流画像,MRスペクトロスコピー,拡散係数画像(apparent diffusion coefficient map:ADC map),単フォトン放射断層撮影装置(single photon emission computed tomography:SPECT),陽電子放射断層撮影(PET)などが用いられるが,いずれも感度と特異性をさらに向上させる必要がある69)。
③生存期間
転移性脳腫瘍の診断後から死亡までの生存期間をデータとすることが多い。前述のように,中枢神経死と他臓器の障害による死亡とを分けることが理想であるが,がん末期の場合には,その鑑別はしばしば困難である。
|

|
| |
5 診療アルゴリズム
|

|
| |
|
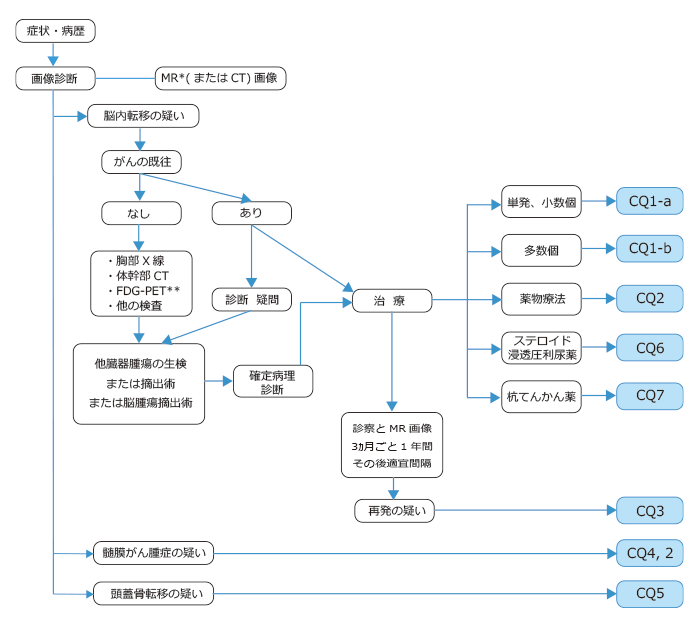
|
| |
|
*T2強調、FLAIR、造影T1強調、拡散強調画像で評価することが望ましい。
**原発巣が特定できないときなど
|

|
| |
6 CQと推奨の一覧
|

|
| |
|
| Clinical Question |
推奨 |
推奨度 |
| 単発・少数個 |
| CQ1-a |
単発あるいは少数個の転移性脳腫瘍の治療はどう選択するのか? |
推奨1 全脳照射を行うことを提案する。
|
2B |
推奨2 KPSの良い患者、あるいは機能予後の改善が期待される患者で全摘出可能な腫瘍では,腫瘍摘出術+放射線治療を行うことを推奨する。
・単発の場合
・少数個の場合 |
1B
2B |
推奨3 3cm以下の腫瘍に対しては,薬物療法に高感受性とされる腫瘍を除き,厳重なフォローアップを前提に定位放射線照射(STI)治療を行うことを推奨する。
・単発の場合
・少数個の場合 |
1B
1B |
| 推奨4 腫瘍の薬物療法感受性によっては,薬物療法を行うことを提案する。(本章CQ2参照) |
2B |
| 多数個 |
| CQ1-b |
多数個の転移性脳腫瘍の治療はどう選択するのか? |
推奨1 全脳照射を行うことを提案する。
|
1A |
| 推奨2 全脳照射にSTIを加えることを提案する。 |
2C |
| 推奨3 腫瘍の薬物療法感受性によっては,薬物療法を行うことを提案する。(本章CQ2参照) |
2B |
| 推奨4 機能予後あるいは生命予後の改善が期待される場合には,腫瘍摘出術+放射線治療を行うことを提案する。 |
2C |
| 推奨5 腫瘍の個数,体積の合計,照射回数を十分に考慮し,厳重なフォローアップを前提にSTI単独治療を行うことを提案する。 |
2C |
| 薬物療法 |
| CQ2 |
転移性脳腫瘍の治療のなかで薬物療法(分子標的治療薬を含む)はどう選択するのか? |
推奨1 症候性または近い将来に脳局所治療を必要とする転移性脳腫瘍では,原則として放射線治療または腫瘍摘出術を優先することを推奨する。 |
1C |
| 推奨2 薬物療法に高感受性とされる腫瘍では,全身薬物療法を単独,または転移性脳腫瘍への局所治療と並行して行うことを提案する。 |
2B |
| 推奨3 推奨2に該当しない固形腫瘍では,頭蓋外に明らかながん病変があり,かつ転移性脳腫瘍による症状がない場合には,転移性脳腫瘍および頭蓋外病変への効果を期待して全身薬物療法を優先することを提案する。 |
2C |
| 推奨4 髄膜がん腫症では,それぞれの腫瘍の薬物療法感受性を根拠として全身薬物療法または抗がん薬の髄腔内投与を行うことを提案する。 |
2C |
| 再発例への治療 |
| CQ3 |
再発の転移性脳腫瘍の治療はどう選択するのか? |
推奨1 全脳照射が行われていない症例に関しては,全脳照射の追加を提案する。
|
2C |
| 推奨2 定位放射線照射(STI)後の長径3 cm以下の新規脳内病変あるいは局所再発病変に対し,STIを提案する。 |
2C |
| 推奨3 全脳照射後の長径3 cm以下の再発に対し,STIを提案する。 |
2C |
| 推奨4 腫瘍の種類によっては薬物療法を提案する。(本章CQ2参照) |
2C |
| 推奨5 機能予後あるいは生命予後の改善が期待される場合には,摘出術を提案する。 |
2C |
| 髄膜がん腫症 |
| CQ4 |
髄膜がん腫症に対する治療はどう選択するのか? |
推奨1 腫瘍の広がりおよび粗大病変の存在に応じて,放射線治療を提案する。 |
2C |
| 推奨2 腫瘍の種類によっては,薬物療法を提案する。 |
2C |
| 推奨3 髄膜がん腫症に伴う水頭症には,髄液シャントあるいはドレナージを行ってよい。 |
2C |
| 頭蓋骨転移 |
| CQ5 |
頭蓋骨転移に対する治療はどう選択するのか? |
推奨1 症候性または近い将来に局所治療を必要とする頭蓋骨転移には,放射線治療を推奨する。 |
1B |
| 推奨2 薬物療法に高感受性とされる腫瘍では,薬物療法を単独あるいは放射線治療と組み合わせて行うことを提案する。 |
2C |
| 推奨3 全身の転移性骨腫瘍を有する患者に対して,あるいは骨関連事象(SRE)のリスクが高い頭蓋骨転移の場合,SREの発現を軽減するために,ビスホスホネート製剤(ゾレドロン酸)またはヒト型抗RANKL(NFκB活性化受容体リガンド)モノクローナル抗体薬(デノスマブ)の投与を推奨する。 |
1B |
| 推奨4 外科治療は,脳神経症状の早急な解除,静脈洞閉塞の回避,整容,または病理診断を目的に,厳格な適応判断のもとに行うよう提案する。 |
2C |
| ステロイド・浸透圧利尿薬 |
| CQ6 |
転移性脳腫瘍に対するステロイドや浸透圧利尿薬はどう使用するのか? |
神経症状を呈する腫瘍周辺の浮腫に対しては,ステロイドや浸透圧利尿薬の使用を推奨する。 |
1B |
| 抗てんかん薬 |
| CQ7 |
転移性脳腫瘍に対する抗てんかん薬はどう使用するのか? |
推奨1 てんかん発作の既往がある場合に,使用することを推奨する。 |
1C |
| 推奨2 てんかん発作の既往のない場合は,腫瘍摘出術および定位放射線照射の周術期などを除き,予防的な抗てんかん薬は使用しないことを提案する。 |
2C |
| 推奨3 抗てんかん薬を使用する場合は,抗がん薬を含めた他剤との薬物相互作用に注意することを推奨する。 |
1C |
|
| 注:全てのCQにおける推奨レベルのWG委員による投票結果は全会一致であった。
|
|

|
| |
7 ガイドライン統括委員会
|

|
| |
|
ガイドライン統括委員会
本ガイドラインの作成にあたり,特定非営利活動法人 日本脳腫瘍学会脳腫瘍診療ガイドライン拡大委員会はガイドライン統括委員会の役割を果たしている。日本脳腫瘍学会脳腫瘍診療ガイドライン拡大委員会の構成委員と所属は共通項目参照。
|

|
| |
8 成人転移性脳腫瘍ガイドライン改訂ワーキンググループ(第3版作成時)
|

|
| |
|
| (五十音順)
|
| 氏 名 |
所属機関/専門分野 |
作成上の役割 |
| 青山 英史 |
北海道大学大学院医学研究院 放射線治療学教室/放射線治療科 |
委員 |
| 安藤 雄一 |
名古屋大学医学部附属病院 化学療法部/腫瘍内科 |
委員 |
| 園田 順彦 |
山形大学医学部 脳神経外科/脳神経外科 |
委員長 |
| 中洲 敏 |
社会医療法人誠光会草津総合病院 脳腫瘍治療科/脳神経外科 |
委員 |
| 中洲 庸子 |
滋賀医科大学 脳神経外科/脳神経外科 |
委員 |
| 宮北 康二 |
国立がん研究センター中央病院 脳脊髄腫瘍科/脳脊髄腫瘍科 |
委員 |
| 若林 俊彦 |
名古屋大学大学院医学系研究科 脳神経外科/脳神経外科 |
委員 |
|
|

|
| |
9 文献検索
|

|
| |
|
今回の改訂では,第2版の作成時に検索をした期限以降の2018年1月〜2021年8月時点のMEDLINE,Cochrane Libraryにて,brain metastases×clinical study or clinical trialを検索式として検索を行った。これら機械的文献検索以外に委員によるハンドサーチでの重要文献の追加も適宜行った。渉猟し得た転移性脳腫瘍に関する論文のなかで,各CQに対して,エビデンスのある,または臨床的重要な情報を提供すると考えられた論文を抽出した。
|

|
| |
|
| 文献 |
| 1) |
Schouten LJ, Rutten J, Huveneers HA, et al. Incidence of brain metastases in a cohort of patients with carcinoma of the breast, colon, kidney, and lung and melanoma. Cancer. 2002;94(10):2698-705.[PMID:12173339]
|
|
| 2) |
Barnholtz-Sloan JS, Sloan AE, Davis FG, et al. Incidence proportions of brain metastases in patients diagnosed(1973 to 2001) in the Metropolitan Detroit Cancer Surveillance System. J Clin Oncol. 2004;22(14):2865-72.[PMID:15254054]
|
|
| 3) |
Aronson SM, Garcia JH, Aronson BE. Metastatic neoplasms of the brain:Their frequency in relation to age. Cancer. 1964;17(5):558-63.[PMID:14159805]
|
|
| 4) |
Posner JB, Chernik NL. Intracranial metastases from systemic cancer. Adv Neurol. 1978;19:579-92.[PMID:570349]
|
|
| 5) |
Takakura K, Sano K, Hojo S, et al. A Pathology of metastases affecting the central nervous system. In Metastatic tumors of the central nervous system. Takakura K, Sano K, Hojo S, et al, eds. Igaku-Shoin, 1982, pp5-111.
|
|
| 6) |
Nakasu Y, Mitsuya K. Multidisciplinary management of brain metastases. Gan To Kagaku Ryoho. 2010;37(2):204-10. Japanese.[PMID:20154474]
|
|
| 7) |
Shibui S. The present status and trend of brain tumors based on the data of the Brain Tumor Registry of Japan. Brain Nerve. 2012;64(3):286-90. Japanese.[PMID:22402723]
|
|
| 8) |
Mehta MP, Shapiro WR, Glantz MJ, et al. Lead-in phase to randomized trial of motexafin gadolinium and whole-brain radiation for patients with brain metastases:centralized assessment of magnetic resonance imaging, neurocognitive, and neurologic end points. J Clin Oncol. 2002;20(16):3445-53.[PMID:12177105]
|
|
| 9) |
Gaspar L, Scott C, Rotman M, et al. Recursive partitioning analysis(RPA) of prognostic factors in three Radiation Therapy Oncology Group(RTOG) brain metastases trials. Int J Radiat Oncol Biol Phys. 1997;37(4):745-51.[PMID:9128946]
|
|
| 10) |
Carden CP, Agarwal R, Saran F, et al. Eligibility of patients with brain metastases for phase I trials:time for a rethink? Lancet Oncol. 2008;9(10):1012-7.[PMID:19071257]
|
|
| 11) |
Delattre JY, Krol G, Thaler HT, et al. Distribution of brain metastases. Arch Neurol. 1988;45(7):741-4.[PMID:3390029]
|
|
| 12) |
Nussbaum ES, Djalilian HR, Cho KH, et al. Brain metastases. Histology, multiplicity, surgery, and survival. Cancer. 1996;78(8):1781-8.[PMID:8859192]
|
|
| 13) |
Patchell RA, Tibbs PA, Walsh JW, et al. A randomized trial of surgery in the treatment of single metastases to the brain. N Engl J Med. 1990;322(8):494-500.[PMID:2405271]
|
|
| 14) |
Vecht CJ, Haaxma-Reiche H, Noordijk EM, et al. Treatment of single brain metastasis:radiotherapy alone or combined with neurosurgery? Ann Neurol. 1993;33(6):583-90.[PMID:8498838]
|
|
| 15) |
Mintz AH, Kestle J, Rathbone MP, et al. A randomized trial to assess the efficacy of surgery in addition to radiotherapy in patients with a single cerebral metastasis. Cancer. 1996;78(7):1470-6.[PMID:8839553]
|
|
| 16) |
Andrews DW, Scott CB, Sperduto PW, et al. Whole brain radiation therapy with or without stereotactic radiosurgery boost for patients with one to three brain metastases:phase III results of the RTOG 9508 randomised trial. Lancet. 2004;363(9422):1665-72.[PMID:15158627]
|
|
| 17) |
Aoyama H, Shirato H, Tago M, et al. Stereotactic radiosurgery plus whole-brain radiation therapy vs stereotactic radiosurgery alone for treatment of brain metastases:a randomized controlled trial. JAMA. 2006;295(21):2483-91.[PMID:16757720]
|
|
| 18) |
Muacevic A, Wowra B, Siefert A, et al. Microsurgery plus whole brain irradiation versus Gamma Knife surgery alone for treatment of single metastases to the brain:a randomized controlled multicentre phase III trial. J Neurooncol. 2008;87(3):299-307.[PMID:18157648]
|
|
| 19) |
Kocher M, Soffietti R, Abacioglu U, et al. Adjuvant whole-brain radiotherapy versus observation after radiosurgery or surgical resection of one to three cerebral metastases:results of the EORTC 22952-26001 study. J Clin Oncol. 2011;29(2):134-41.[PMID:21041710]
|
|
| 20) |
Yamamoto M, Serizawa T, Shuto T, et al. Stereotactic radiosurgery for patients with multiple brain metastases(JLGK0901):a multi-institutional prospective observational study. Lancet Oncol. 2014;15(4):387-95. [PMID:24621620]
|
|
| 21) |
Mulvenna P, Nankivell M, Barton R, et al. Dexamethasone and supportive care with or without whole brain radiotherapy in treating patients with non-small cell lung cancer with brain metastases unsuitable for resection or stereotactic radiotherapy(QUARTZ):results from a phase 3, non-inferiority, randomised trial. Lancet. 2016;388(10055):2004-14.[PMID:27604504]
|
|
| 22) |
Kihlström L, Karlsson B, Lindquist C. Gamma Knife surgery for cerebral metastases. Implications for survival based on 16 years experience. Stereotact Funct Neurosurg. 1993;61 Suppl 1:45-50.[PMID:8115755]
|
|
| 23) |
Sheehan JP, Yen CP, Nguyen J, et al. Timing and risk factors for new brain metastasis formation in patients initially treated only with Gamma Knife surgery. Clinical article. J Neurosurg. 2011;114(3):763-8.[PMID:20225924]
|
|
| 24) |
Hanssens P, Karlsson B, Yeo TT, et al. Detection of brain micrometastases by high-resolution stereotactic magnetic resonance imaging and its impact on the timing of and risk for distant recurrences. J Neurosurg. 2011;115(3):499-504.[PMID:21639696]
|
|
| 25) |
Zimm S, Wampler GL, Stablein D, et al. Intracerebral metastases in solid-tumor patients:natural history and results of treatment. Cancer. 1981;48(2):384-94.[PMID:7237407]
|
|
| 26) |
Sause WT, Crowley J, Eyre HJ, et al. Whole brain irradiation and intrathecal methotrexate in the treatment of solid tumor leptomeingeal metastases--a Southwest Oncology Group study. J Neurooncol. 1988;6(2):107-12.[PMID:3225633]
|
|
| 27) |
Nguyen TD, Abrey LE. Brain metastases:old problem, new strategies. Hematol Oncol Clin North Am. 2007;21(2):369-88.[PMID:17512454]
|
|
| 28) |
Long GV, Menzies AM, Nagrial AM, et al. Prognostic and clinicopathologic associations of oncogenic BRAF in metastatic melanoma. J Clin Oncol. 2011;29(10):1239-46.[PMID:21343559]
|
|
| 29) |
Quan AL, Videtic GM, Suh JH. Brain metastases in small cell lung cancer. Oncology(Williston Park). 2004;18(8):961-72.[PMID:15328892]
|
|
| 30) |
Sperduto PW, Kased N, Roberge D, et al. The effect of tumor subtype on the time from primary diagnosis to deveopment of brain metastases and survival in patients with breast cancer. J Neurooncol. 2013;112(3):467-72.[PMID:23462853]
|
|
| 31) |
Zakrzewski J, Geraghty LN, Rose AE, et al. Clinical variables and primary tumor characteristics predictive of the development of melanoma brain metastases and post-brain metastases survival. Cancer. 2011;117(8):1711-20.[PMID:21472718]
|
|
| 32) |
Choi HJ, Cho BC, Sohn JH, et al. Brain metastases from hepatocellular carcinoma:prognostic factors and outcome:brain metastasis from HCC. J Neurooncol. 2009;91(3):307-13.[PMID:18949445]
|
|
| 33) |
Velander AJ, DeAngelis LM, Navi BB. Intracranial hemorrhage in patients with cancer. Curr Atheroscler Rep. 2012;14(4):373-81.[PMID:22528522]
|
|
| 34) |
Chamberlain MC. Leptomeningeal metastases:a review of evaluation and treatment. J Neurooncol. 1998;37(3):271-84.[PMID:9524085]
|
|
| 35) |
Waki F, Ando M, Takashima A, et al. Prognostic factors and clinical outcomes in patients with leptomeningeal metastasis from solid tumors. J Neurooncol. 2009;93(2):205-12.[PMID:19043775]
|
|
| 36) |
Wasserstrom WR, Glass JP, Posner JB. Diagnosis and treatment of leptomeningeal metastases from solid tumors:experience with 90 patients. Cancer. 1982;49(4):759-72.[PMID:6895713]
|
|
| 37) |
Suki D, Hatiboglu MA, Patel AJ, et al. Comparative risk of leptomeningeal dissemination of cancer after surgery or stereotactic radiosurgery for a single supratentorial solid tumor metastasis. Neurosurgery. 2009;64(4):664-74.[PMID:19197219]
|
|
| 38) |
Ahn JH, Lee SH, Kim S, et al. Risk for leptomeningeal seeding after resection for brain metastases:implication of tumor location with mode of resection. J Neurosurg. 2012;116(5):984-93.[PMID:22339161]
|
|
| 39) |
Johannesen TB, Lien HH, Hole KH, et al. Radiological and clinical assessment of long-term brain tumour survivors after radiotherapy. Radiotherapy Oncol. 2003;69(2):169-76.[PMID:14643954]
|
|
| 40) |
Greene-Schloesser D, Robbins ME, Peiffer AM, et al. Radiation-induced brain injury:A review. Front Oncol. 2012;2:73.[PMID:22833841]
|
|
| 41) |
Khuntia D, Brown P, Li J, et al. Whole-brain radiotherapy in the management of brain metastasis. J Clin Oncol. 2006;24(8):1295-304.[PMID:16525185]
|
|
| 42) |
Meyers CA, Smith JA, Bezjak A, et al. Neurocognitive function and progression in patients with brain metastases treated with whole-brain radiation and motexafin gadolinium:results of a randomized phase III trial. J Clin Oncol. 2004;22(1):157-65.[PMID:14701778]
|
|
| 43) |
Soffietti R, Kocher M, Abacioglu UM, et al. A European Organisation for Research and Treatment of Cancer phase III trial of adjuvant whole-brain radiotherapy versus observation in patients with one to three brain metastases from solid tumors after surgical resection or radiosurgery:quality-of-life results. J Clin Oncol. 2013;31(1):65-72.[PMID:23213105]
|
|
| 44) |
Minniti G, Clarke E, Lanzetta G, et al. Stereotactic radiosurgery for brain metastases:analysis of outcome and risk of brain radionecrosis. Radiat Oncol. 2011;6:48.[PMID:21575163]
|
|
| 45) |
Wiggenraad R, Verbeek-de Kanter A, Kal HB, et al. Dose-effect relation in stereotactic radiotherapy for brain metastases. A systematic review. Radiother Oncol. 2011;98(3):292-7.[PMID:21316787]
|
|
| 46) |
Stockham AL, Tievsky AL, Koyfman SA, et al. Conventional MRI does not reliably distinguish radiation necrosis from tumor recurrence after stereotactic radiosurgery. J Neurooncol. 2012;109(1):149-58.[PMID:22638727]
|
|
| 47) |
Brown PD, Brown CA, Pollock BE, et al. Stereotactic radiosurgery for patients with“radioresistant”brain metastases. Neurosurgery. 2002;51(3):656-65.[PMID:12188943]
|
|
| 48) |
Meyners T, Heisterkamp C, Kueter JD, et al. Prognostic factors for outcomes after whole-brain irradiation of brain metastases from relatively radioresistant tumors:a retrospective analysis. BMC Cancer. 2010;10:582.[PMID:20977700]
|
|
| 49) |
Slotman B, Faivre-Finn C, Kramer G, et al;EORTC Radiation Oncology Group and Lung Cancer Group. Prophylactic cranial irradiation in extensive small-cell lung cancer. N Engl J Med. 2007;357(7):664-72.[PMID:17699816]
|
|
| 50) |
Drappatz J, Wen PY. Chemotherapy and targeted molecular therapies for brain metastases. Expert Rev Neurother. 2006;6(10):1465-79.[PMID:17078787]
|
|
| 51) |
Soussain C, Ricard D, Fike JR, et al. CNS complications of radiotherapy and chemotherapy. Lancet. 2009;374(9701):1639-51.[PMID:19897130]
|
|
| 52) |
Nieder C, Mehta MP. Prognostic indices for brain metastases--usefulness and challenges. Radiat Oncol. 2009;4:10.[PMID:19261187]
|
|
| 53) |
Sperduto PW, Berkey B, Gaspar LE, et al. A new prognostic index and comparison to three other indices for patients with brain metastases:an analysis of 1,960 patients in the RTOG database. Int J Radiat Oncol Biol Phys. 2008;70(2):510-4.[PMID:17931798]
|
|
| 54) |
Sperduto PW, Mesko S, Li J, et al. Survival in Patients With Brain Metastases: Summary Report on the Updated Diagnosis-Specific Graded Prognostic Assessment and Definition of the Eligibility Quotient. J Clin Oncol. 2020;38(32):3773-84.[PMID:32931399]
|
|
| 55) |
Barnholtz-Sloan JS, Yu C, Sloan AE, et al. A nomogram for individualized estimation of survival among patients with brain metastasis. Neuro Oncol. 2012;14(7):910-8.[PMID:22544733]
|
|
| 56) |
Ahn HK, Lee S, Park YH, et al. Prediction of outcomes for patients with brain parenchymal metastases from breast cancer(BC):a new BC-specific prognostic model and a nomogram. Neuro Oncol. 2012;14(8):1105-13.[PMID:22693244]
|
|
| 57) |
Jakola AS, Gulati S, Nerland US, et al. Surgical resection of brain metastases:the prognostic value of the graded prognostic assessment score. J Neurooncol. 2011;105(3):573-81.[PMID:21660540]
|
|
| 58) |
Seute T, Leffers P, ten Velde GP, et al. Detection of brain metastases from small cell lung cancer:consequences of changing imaging techniques(CT versus MRI). Cancer. 2008;112(8):1827-34.[PMID:18311784]
|
|
| 59) |
日本医学放射線学会編.画像診断ガイドライン2016年版.金原出版,2016,pp90-1.
|
|
| 60) |
ACR-ASNR Practice guideline for performing and interpreting magnetic resonance imaging(MRI) of the brain.
|
|
| 61) |
Likhacheva A, Pinnix CC, Parikh NR, et al. Predictors of survival in contemporary practice after initial radiosurgery for brain metastases. Int J Radiat Oncol Biol Phys. 2013;85(3):656-61.[PMID:22898384]
|
|
| 62) |
Sze G, Johnson C, Kawamura Y, et al. Comparison of single-and triple-dose contrast material in the MR screening of brain metastases. AJNR Am J Neuroradiol. 1998;19(5):821-8.[PMID:9613494]
|
|
| 63) |
Hendriks LE, Bootsma GP, de Ruysscher DK, et al. Screening for brain metastases in patients with stage III non-small cell lung cancer:Is there additive value of magnetic resonance imaging above a contrast-enhanced computed tomography of the brain? Lung Cancer. 2013;80(3):293-7.[PMID:23518381]
|
|
| 64) |
Tsuchiya K, Katase S, Yoshino A, et al. FLAIR MR imaging for diagnosing intracranial meningeal carcinomatosis. AJR Am J Roentgenol. 2001;176(6):1585-8.[PMID:11373237]
|
|
| 65) |
Silvestri GA, Gonzalez AV, Jantz MA, et al. Methods for staging non-small cell lung cancer:Diagnosis and management of lung cancer, 3rd ed:American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2013;143(5 Suppl):e211S-50S.[PMID:23649440]
|
|
| 66) |
Therasse P, Arbuck SG, Eisenhauer EA, et al. New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada. J Natl Cancer Inst. 2000;92(3):205-16.[PMID:10655437]
|
|
| 67) |
Jaffe CC. Measures of response:RECIST, WHO, and new alternatives. J Clin Oncol. 2006;24(20):3245-51.[PMID:16829648]
|
|
| 68) |
Macdonald DR, Cascino TL, Schold SC Jr, et al. Response criteria for phase II studies of supratentorial malignant glioma. J Clin Oncol. 1990;8(7):1277-80.[PMID:2358840]
|
|
| 69) |
Mitsuya K, Nakasu Y, Horiguchi S, et al. Perfusion weighted magnetic resonance imaging to distinguish the recurrence of metastatic brain tumors from radiation necrosis after stereotactic radiosurgery. J Neurooncol. 2010;99(1):81-8.[PMID:20058049]
|
|

|
|
| |
略語一覧
|

|
| |
|
| AAN |
American Academy of Neurology |
米国神経学会 |
| ADC map |
apparent diffusion coefficient map |
拡散係数画像 |
| BSC |
best supportive care |
|
| CR |
complete response |
完全奏効 |
| CYP |
Cytochrome P450 |
シトクロムP450 |
| EGFR |
epidermal growth factor receptor |
上皮成長因子受容体 |
| EORTC |
European Organization for Research and Treatment of Cancer |
|
| ER |
estrogen receptor |
エストロゲン受容体 |
| FDG-PET |
2-[18F]-fluoro-2-deoxy-D-glucose positron emission tomography |
FDGポジトロン断層法 |
| GPA |
Graded prognostic assessment |
|
| HRQOL |
health-related quality of life |
|
| HVL-R |
Hopkins Verbal Learning Test-Revised |
|
| IMRT |
intensity modulated radiation therapy |
強度変調放射線治療 |
| JCOG |
Japan Clinical Oncology Group |
日本臨床腫瘍研究グループ |
| KPS |
Karnofsky Performance Status |
|
| MMSE |
Mini Mental State Examination |
|
| MRI |
magnetic resonance imaging |
|
| MTX |
methotrexate |
メトトレキサート |
| NCCTG |
North Central Cancer Treatment Group |
|
| PD |
progressive disease |
進行 |
| PET |
positron emission tomography |
陽電子放射断層撮影 |
| PgR |
progesterone receptor |
プロゲステロン受容体 |
| PR |
partial response |
部分奏効 |
| PS |
performance status |
|
| QOL |
quality of life |
生活の質 |
| RANKL |
Receptor activator of nuclear factor-kappa B ligand |
NF κ B活性化受容体リガンド |
| RECIST |
Response evaluation criteria in solid tumors |
|
| RPA |
Recursive partitioning analysis |
|
| RTOG |
Radiation Therapy Oncology Group |
|
| SD |
stable disease |
安定 |
| SPECT |
single photon emission computed tomography |
単フォトン放射断層撮影装置 |
| SRE |
skeletal related events |
骨関連事象 |
| SRS |
stereotactic radiosurgery |
定位手術的照射 |
| STI |
stereotactic irradiation |
定位放射線照射 |
| T-DM1 |
trastuzumab emtansine |
トラスツズマブ エムタンシン |
| VEGF |
vascular endothelial growth factor |
血管内皮細胞増殖因子 |
| WHO |
World Health Organization |
世界保健機関 |
|
|

|
| |
単発・少数個
|

|
| |
|
CQ 1-a 単発あるいは少数個の転移性脳腫瘍の治療はどう選択するのか?
|

|
| |
|
推奨1
全脳照射を行うことを提案する。(推奨度2B)
|
|

|
| |
|
推奨2
KPSの良い患者、あるいは機能予後の改善が期待される患者で全摘出可能な腫瘍では,腫瘍摘出術+放射線治療を行うことを推奨する。
・単発の場合(推奨度1B)
・少数個の場合(推奨度2B)
|
|

|
| |
|
推奨3
3 cm以下の腫瘍に対しては,薬物療法に高感受性とされる腫瘍を除き、厳重なフォローアップを前提に定位放射線照射(STI)治療を行うことを推奨する。
・単発の場合(推奨度1B)
・少数個の場合(推奨度1B)
|
|

|
| |
|
推奨4
腫瘍の薬物療法感受性によっては,薬物療法を行うことを提案する。(本章CQ2参照)(推奨度2B)
|
|

|
| |
多数個
|

|
| |
|
CQ 1-b 多数個の転移性脳腫瘍の治療はどう選択するのか?
|

|
| |
|
推奨1
全脳照射を行うことを推奨する。(推奨度1A)
|
|

|
| |
|
推奨2
全脳照射にSTIを加えることを提案する。(推奨度2C)
|
|

|
| |
|
推奨3
腫瘍の薬物療法感受性によっては,薬物療法を行うことを提案する。(本章CQ2参照)(推奨度2B)
|
|

|
| |
|
推奨4
機能予後あるいは生命予後の改善が期待される場合には,腫瘍摘出術++放射線治療を行うことを提案する。(推奨度2C)
|
|

|
| |
|
推奨5
腫瘍の個数,体積の合計,照射回数を十分に考慮し,厳重なフォローアップを前提にSTI単独治療を行うことを提案する。(推奨度2C)
|
|

|
| |
|
解説
|
| |
|
定位放射線照射(stereotactic irradiation:STI)の普及に伴い,転移性脳腫瘍の臨床研究は,単発もしくは少数個(2~4個)と多数個(5個以上)に分けて行われるようになった。しかしながら,MRI撮像方法(スライス厚,造影剤の使用量)によって,転移個数の判定が異なる場合がある点に注意が必要である。
転移性脳腫瘍の治療において,全脳照射は歴史的に標準治療として確立されたものである。2000年代前半までは,主に全脳照射に腫瘍摘出術やSTIなどの局所照射を加える意義を検証するという観点でランダム化比較試験が行われてきた1-4)(いずれもレベルⅠb)。2006年に,我が国から4個以下(3 cm以下)で全身状態が良好な症例を対象としたSTI単独治療とSTI+全脳照射の併用治療のランダム化比較試験(JROSG 99-1)が報告され,全脳照射を加えなくても生存期間に差は認めないことが証明された5)(レベルⅠb)。一方,STI単独治療が行われた場合には,局所の腫瘍再発率や頭蓋内の遠隔部再発率が全脳照射を併用した群より有意に上昇することも示された5)。さらに,2011年にはEuropean Organization for Research and Treatment of Cancer(EORTC)から(EORTC 22952-26001試験),2016年にはBrownら(NCCTG N0574試験)が,3個以下の脳転移を対象として,STI単独治療とSTI+全脳照射(EORTCはSTIと手術摘出を含む)のランダム化比較試験を報告した。その結果も我が国で行われたものと同様であり,局所治療後の全脳照射の追加による生存期間の延長は認められていない6,7)(レベルⅠb)。一方,2016年の小規模なランダム化比較試験(59例)の報告では,単発転移に対して2年生存期間および中枢神経死の割合は,術後摘出腔に対するSTIよりも全脳照射のほうが優れていた8)。
全脳照射を施行することの患者のQOLや認知機能に与える影響については,議論をされているところである。しかし、腫瘍制御のために全脳照射が最適な場合があり、その適応は、患者の状態・腫瘍・他の治療法選択の余地など複雑な背景、慢性期障害の軽減への配慮を条件として判断されるべきである。我が国とEORTCの研究では,Karnofsky performance status(KPS)を指標としたQOLを維持する期間には差がなかった5,6)(いずれもレベルⅠb)。認知機能については,4カ月の時点での記銘力(Hopkins Verbal Learning Test-Revised:HVL-R)が全脳照射群で有意に低下したとする報告と,逆に照射後2年頃までは全脳照射による腫瘍再発予防効果によって認知機能(Mini Mental State Examination:MMSE)が維持されるとする報告がある8—10)(いずれもレベルⅠb)。他に腫瘍制御率と認知機能温存率の相関性を示した別の報告もある11)(レベルⅠb)。
このような議論をもとに,前述のNCCTG N0574試験は,認知機能の評価を主要評価項目としてSTI単独治療とSTI+全脳照射を比較した7)。2016年の報告では,照射後3カ月目のQOLおよび認知機能はSTI単独治療群で有意に良好で,12カ月目での認知機能にも有意差があった(レベルⅠb)。一方,標準治療とされてきた全脳照射について,手術やSTIが適応にならない非小細胞肺がん脳転移患者に対するbest supportive care(BSC)とのランダム化比較試験が2016年に報告された(QUARTZ試験)12)。60歳未満などのサブグループ解析で全脳照射の有効性が示唆されたが,全体ではBSCと比較して全生存期間やQOLでの差が認められなかった(レベルⅠb)。したがって,治療法と治療タイミングは各症例・原発巣の状態に応じた個別の選択が,さらに重要になると考えられる。
また、最近、全脳照射による慢性期の記銘力障害を抑制する目的で、強度変調放射線治療(intensity modulated radiation therapy:IMRT)を用いた海馬回避全脳照射のランダム化第III相試験1件、第II相試験2件が報告された。記銘力低下の抑制効果があり、海馬領域への再発は容認できる発生率(4〜9%)だった13-15)(レベル IIaとⅠb)。この課題についてはさらに数件のランダム化第III相試験が進行中である。
これらのことを踏まえ,これまで論文報告されたランダム化比較試験の結果をもとに各治療法を以下に概説する。なお,以下の研究はいずれも放射線治療の感受性が高い小細胞肺がんや悪性リンパ腫,胚細胞腫瘍からの脳転移,また小児例が除外された研究である点にも注意されたい。
[注意]
IMRTは適応外使用
|

|
| |
|
1.単数あるいは少数(2~4個)の転移性脳腫瘍
|
| |
|
(1)全脳照射単独群と腫瘍摘出術+全脳照射群の比較
単発の転移性脳腫瘍を対象とした全脳照射単独群と腫瘍摘出術+全脳照射群のランダム化比較試験は3つある。
1990年にPatchellらは,KPS 70%以上の48例に対して全脳照射単独群(36 Gy/12回)と腫瘍摘出術+全脳照射群の比較試験を行った1)(レベルⅠb)。その結果,生存期間中央値は腫瘍摘出術+全脳照射群の40週に対して全脳照射単独群では15週であり,腫瘍摘出術+全脳照射群で有意に生存期間中央値の延長を認めた。また,局所再発率は全脳照射単独群の52%に対して腫瘍摘出術+全脳照射群では20%と優れており,治療後のKPSも腫瘍摘出術+全脳照射群で優っていた。
続いて,1993年にVechtらも,WHOスケール2(日中の50%以上離床している)よりも状態の良い63例を対象とする全脳照射単独群と腫瘍摘出術+全脳照射群の試験結果を報告した2)(レベルⅠb)。その結果,生存期間中央値は全脳照射単独群の6カ月に対して腫瘍摘出術+全脳照射群では10カ月であり,腫瘍摘出術+全脳照射群が生存期間で有意に上回っていた。また,原発巣がコントロールされている場合の腫瘍摘出術+全脳照射群の生存期間中央値は12カ月であることから,腫瘍摘出術を加えることの有効性は原発巣がコントロールされている場合に特に顕著であった。
これに対して,1996年に米国のMintzらは,KPS 50%以上の84例を対象とした同様の試験を報告した3)(レベルⅠb)。生存期間中央値は全脳照射単独群6.3カ月,腫瘍摘出術+全脳照射群5.6カ月であり,生存期間の延長は示されなかった。その理由として,対象集団のKPSが低かったこと,原発巣がコントロールされていない患者が多く含まれていたために頭蓋外病変が重要な予後因子であったことが考えられている。
(2)腫瘍摘出術単独群と腫瘍摘出術+全脳照射群の比較
単発の転移性脳腫瘍を対象とした腫瘍摘出術単独群と腫瘍摘出術+全脳照射群のランダム化比較試験は2つある。
1998年にPatchellらは,腫瘍摘出術単独群と腫瘍摘出術+全脳照射群(50.4 Gy/28回)を比較した95例の試験結果を報告している16)(レベルⅠb)。全生存期間に有意差は認められなかったが,脳内の局所再発率が腫瘍摘出術+全脳照射群の18%に対して,腫瘍摘出術単独群では70%と有意に多かった。
また,2011年に報告されたEORTC 22952-26001試験では,1~3個の転移性脳腫瘍を有する症例を対象に,STI単独群もしくは腫瘍摘出術単独群に対して,それらに全脳照射を追加した群の比較を行っている6)(レベルⅠb)。全体347例のうち279例(81%)は単発の転移性脳腫瘍であった。その結果,STI単独群もしくは腫瘍摘出術単独群と比較して,全脳照射の追加により術後2年時の局所再発率は59%から27%,新規病変の出現は42%から23%にいずれも有意に減少していた。しかしながら,全脳照射の追加による全生存期間の延長効果は認められなかった。また,試験登録時の転移個数別のサブグループ解析は示されていない。2013年に本試験の健康関連QOLに関する研究結果が報告されており,STI単独群もしくは腫瘍摘出術単独群と比較して,それらに全脳照射を追加した群ではHRQOLの複数の指標で一時的な低下が認められていた17)(レベルⅠb)。
単施設の後方視的研究ではあるが,Bindalらが3個までの転移性脳腫瘍の全摘出術を受けた患者と,リスク因子を対応させた単発の転移性脳腫瘍の患者をそれぞれ26例抽出して比較した18)(レベルⅢ)。全例で摘出術後に全脳照射(30 Gy/10回)が行われていた。全症例の46%が悪性黒色腫であった点に注意が必要であるが,生存期間と局所コントロールには有意差がなかった。
(3)全脳照射単独群とSTI+全脳照射併用群の比較
少数個の転移性脳腫瘍を対象とした全脳照射単独群とSTI+全脳照射併用群のランダム化比較試験は2件ある。そのうち1つは患者集積が不良であり結論を得るに至らなかった。
RTOGによって行われた研究(RTOG 9508試験)では,総登録数331例のうち,186例(56%)が単発性であった。全331例を用いた両治療群間の生存期間に有意差は認めなかったが,単発のみを扱ったサブグループ解析において,生存期間中央値は全脳照射単独群とSTI+全脳照射併用群でそれぞれ4.9カ月,6.5カ月であり,STI+全脳照射併用群で有意に良好であった19)(レベルⅠb)。
(4)STI単独群とSTI+全脳照射併用群の比較
単発もしくは少数個の転移性脳腫瘍を対象としたSTI単独群とSTI+全脳照射併用群を比較したランダム化比較試験は4件ある。
このうち,4個以下の転移性脳腫瘍を対象として我が国で行われた研究(JROSG 99-1試験)では,総登録数132例のうち単発の転移性脳腫瘍は68例であったが,単発例のみのサブグループ解析は行われていない5)(レベルⅠb)。全体の生存期間中央値はSTI単独群で8.0カ月,STI+全脳照射併用群で7.5カ月であり有意差は認められなかった。
前述のEORTC 22952-26001試験では,脳腫瘍摘出術もしくはSTIの後,全脳照射と経過観察が比較されている6)(レベルⅠb)。単発の転移性脳腫瘍のみのサブグループ解析は示されていないが,局所治療(脳腫瘍摘出術もしくはSTI)のみの群と,それに全脳照射を加えた群の全生存期間中央値はそれぞれ10.7カ月と10.9カ月であり,やはり両群間に有意差を認めなかった。しかし,転移性脳腫瘍が死因となった割合は局所治療のみの群では44%であり,全脳照射併用群の28%よりも有意に高かった。
一方,MD Anderson Cancer Centerで行われた試験は3個以下の転移性脳腫瘍を対象としており,総登録数58例のうち単発の転移性脳腫瘍は33例であった。しかし,STI+全脳照射併用群で認知機能低下が認められたため途中で中止となっており,単発例のみの解析も行われていない9)(レベルⅠb)。
2016年に報告された,3個以下の脳転移に対するNCCTG N0574試験でも,登録者数213例で全生存期間中央値はSTI単独治療群10.4カ月,全脳照射併用群7.4カ月と有意差はなかった。また年齢,全身転移の状況,脳転移の個数による差も認められなかった7)(レベルⅠb)。
また,頭蓋内の腫瘍制御については,上記4件の試験すべてにおいて,STI(あるいは腫瘍摘出術)を行った局所および頭蓋内遠隔部再発の制御は,全脳照射併用群で有意に優れていたと報告されている。
2015年に報告された,JROSG 99-1試験の二次解析で,非小細胞肺がんの88例のうちDS-GPA値2.5-4.0の群では生存期間の有意な延長が全脳照射併用群で認められた(生存期間中央値はSTI+全脳照射併用16.7カ月vs.STI単独10.6カ月)20)(レベルⅠb)。一方,NCCTG N0574試験を除く3件のランダム化比較試験について2015年のメタアナリシスでは,全生存期間は2つの治療群で差がなかったものの,50歳以下の患者ではSTI単独治療でも遠隔転移をきたす確率は高くなく,この年齢群ではSTI単独治療群の生存期間が延長していた21)(レベルⅠa)。生存期間に関して全脳照射を追加して益のあるサブグループに関しては,まだ議論を重ねる必要があると考えられる。
これらの結果と前述の認知機能に対する全脳照射の影響を踏まえて厳重なフォローアップが行えることを前提に,少数個で腫瘍サイズが大きくない場合にはSTI単独治療を推奨できると結論づけられる。
(5)STI単独群と腫瘍摘出術+全脳照射群の比較
2008年にMuacevicらが報告したSTI単独群と腫瘍摘出術+全脳照射群のランダム化比較試験は,患者登録が進まず途中で中止となっている22)(レベルⅠb)。STI単独群31例と腫瘍摘出術+全脳照射群33例の解析では,生存期間,中枢神経死に差は認められなかった。STIは低侵襲であり治療期間も短いこと,局所制御率も高いことから,遠隔部の再発に対する救済的なSTIの効果について,さらなる評価を必要としている。
(6)STI+全脳照射併用群と腫瘍摘出術+全脳照射群の比較
STI+全脳照射併用群と腫瘍摘出術+全脳照射群のランダム化比較試験については,2011年にRoosらより報告されているが,この試験も患者登録が進まず途中で中止となっている23)(レベルⅠb)。一方,後方視的研究では,STI+全脳照射併用群と腫瘍摘出術+全脳照射群に生存期間の差が認められていない。Radesらは,1~3個の転移性脳腫瘍に対して52例ずつのマッチドペア分析を報告している。その結果,単変量解析ではSTI+全脳照射併用群が1年後の生存割合,頭蓋内および局所の制御割合において腫瘍摘出術+全脳照射群よりも優れていたが,多変量解析では生存割合に有意差は認められなかった24)(レベルⅢ)。
(7) 摘出術後の放射線治療
2017年に日本臨床腫瘍研究グループ(Japan Clinical Oncology Group:JCOG)から腫瘍摘出術+全脳照射群と腫瘍摘出術+STI群とのランダム化比較試験(JCOG 0504試験)の結果が公表された25)。この試験は4個以下の転移性脳腫瘍に対して実施され,他の研究と同様に全生存期間に有意差はなく,全脳照射に対するSRSの非劣性が証明された。この試験でも脳内無増悪生存期間は全脳照射群で優れていたが,MMSE評価およびPSに有意差は検出されなかった。摘出術単独と術後腔SRSとを比較したランダム化第III相試験では、生存期間中央値は同等、局所制御はSRS群が良好だった26)(レベル1b)。一方、摘出腔へのSTIと術後全脳照射との成績を比較した後方視的研究8件のメタアナリシスでは、局所制御と生存期間中央値は同等、STI群は白質変化が少ないが、播種性病変・放射線壊死が多かった27)(レベルIII)。また、術後STIの治療成績50件のメタアナリシスでは、臨床的feasibilityが証明された28)(レベルIIa)。
(8) STIと全脳照射の併用
単発・少数個の転移性脳腫瘍を対象としたSTI単独群とSTI+全脳照射併用群を比較したランダム化第III相試験5件のメタアナリシスが報告された。生存期間中央値は両治療で同等、頭蓋内コントロールはSTI+全脳照射併用群で良好だが、高次機能は全脳照射群で低下していた29)(レベルIa)。
|

|
| |
|
2.多数個の転移性脳腫瘍
|
| |
|
多発個の転移性脳腫瘍に対する標準治療は歴史的に全脳照射である。放射線治療と対症療法(ステロイド内服)を比較したランダム化比較試験は,1971年のHortonらの報告がある30)(レベルⅠb)。本試験の結果,対症療法(ステロイド内服)のみの群と全脳照射群の生存期間中央値は,それぞれ10週と14週であった。これ以降,標準治療を全脳照射と据えてさまざまな臨床試験が行われてきた。2016年に報告された前述のQUARTZ試験は,非小細胞肺がんからの脳転移に対して,摘出術やSRSの適応がない患者534例を対象とし,BSCのみと全脳照射のランダム化比較試験である12)。5個以上の病変を有する患者が32.6%を占め,この群では全脳照射のほうがHR=1.37(95%CI:1.01-1.86)で生存期間の延長を示した(レベルⅠb)。
全脳照射のスケジュールが治療成績に及ぼす影響については,複数のランダム化比較試験で検討されてきた。それらのスケジュールには,20 Gy/4~5回,30 Gy/15回,30 Gy/10回,40 Gy/20回などが含まれる4,31-34)(いずれもレベルⅠb)。スケジュール間で生存期間の有意差は示されていないが,頭蓋内腫瘍制御は20 Gy/4~5回と40 Gy/20回を比較した2件のランダム化比較試験において40 Gy/20回が有意に優れていた4,24)(いずれもレベルⅠb)。神経機能障害については,加速過分割54.4 Gy/34回と30 Gy/10回では差はなかったと報告されている35)(レベルⅠb)。
4または5個以上の転移性脳腫瘍を対象として腫瘍摘出術の意義を検証した研究は報告されておらず,単施設の後方視的研究が数件報告されているのみである。単発・多発の転移性脳腫瘍に対する腫瘍摘出術の効果を後方視的に検討したPaekらの報告では,多発転移か単発転移であるかは手術後の生存期間に有意な影響を与えず,RPAクラスⅠのみが有意な因子であった36)(レベルⅢ)。この研究では,76例が多発の転移性脳腫瘍であったが転移個数は記載されていない。また,Iwadateらの単発・多発の転移性脳腫瘍138例の解析では,全摘・亜全摘以上の症例において単発転移と多発転移の間に生存期間の有意差は認められなった37)(レベルⅢ)。
JLGK 0901試験は我が国の多施設による非ランダム化介入試験で,10個以下の転移病変に対するSRS単独治療を行い,治療後生存期間を比較して2014年に発表された38)。対象は病変の最大長径3 cm未満,最大体積10 mL未満,合計体積15 mL以下として,1,194例が登録された。治療後72%に全身薬物療法が行われ,13%で局所再発,58%で脳内新規病変が出現しており,その77%に対して救済治療が行われた。結果は,病変1個の群で全生存期間が有意に長く(13.9カ月),2~4個と5~10個の群間(各10.8カ月)には差がなかった(レベルⅡa)。この試験の結果,合計体積15 mL以下の10個以下の病変に対してSRS単独治療と,その後の注意深い経過観察および救済治療が推奨され,選択肢の一つとなった。
|

|
| |
|
| 文献 |
| 1) |
Patchell RA, Tibbs PA, Walsh JW, et al. A randomized trial of surgery in the treatment of single metastases to the brain. N Engl J Med. 1990;322(8):494-500.[PMID:2405271](レベルⅠb)
|
|
| 2) |
Vecht CJ, Haaxma-Reiche H, Noordijk EM, et al. Treatment of single brain metastasis:radiotherapy alone or combined with neurosurgery? Ann Neurol. 1993;33(6):583-90.[PMID:8498838](レベルⅠb)
|
|
| 3) |
Mintz AH, Kestle J, Rathbone MP, et al. A randomized trial to assess the efficacy of surgery in addition to radiotherapy in patients with a single cerebral metastasis. Cancer. 1996;78(7):1470-6.[PMID:8839553](レベルⅠb)
|
|
| 4) |
Davey P, Hoegler D, Ennis M, et al. A phase III study of accelerated versus conventional hypofractionated whole brain irradiation in patients of good performance status with brain metastases not suitable for surgical excision. Radiother Oncol. 2008;88(2):173-6.[PMID:18555546](レベルⅠb)
|
|
| 5) |
Aoyama H, Shirato H, Tago M, et al. Stereotactic radiosurgery plus whole-brain radiation therapy vs stereotactic radiosurgery alone for treatment of brain metastases:a randomized controlled trial. JAMA. 2006;295(21):2483-91.[PMID:16757720](レベルⅠb)
|
|
| 6) |
Kocher M, Soffietti R, Abacioglu U, et al. Adjuvant whole-brain radiotherapy versus observation after radiosurgery or surgical resection of one to three cerebral metastases:results of the EORTC 22952-26001 study. J Clin Oncol. 2011;29(2):134-41.[PMID:21041710](レベルⅠb)
|
|
| 7) |
Brown PD, Jaeckle K, Ballman KV, et al. Effect of radiosurgery alone vs radiosurgery with whole brain radiation therapy on cognitive function in patients with 1 to 3 brain metastases:a randomized clinical trial. JAMA. 2016;316(4):401-9.[PMID:27458945](レベルⅠb)
|
|
| 8) |
Kępka L, Tyc-Szczepaniak D, Bujko K, et al. Stereotactic radiotherapy of the tumor bed compared to whole brain radiotherapy after surgery of single brain metastasis:Results from a randomized trial. Radiother Oncol. 2016;121(2):217-24.[PMID:27793446](レベルⅠb)
|
|
| 9) |
Chang EL, Wefel JS, Hess KR, et al. Neurocognition in patients with brain metastases treated with radiosurgery or radiosurgery plus whole-brain irradiation:a randomised controlled trial. Lancet Oncol. 2009;10(11):1037-44.[PMID:19801201](レベルⅠb)
|
|
| 10) |
Aoyama H, Tago M, Kato N, et al. Neurocognitive function of patients with brain metastasis who received either whole brain radiotherapy plus stereotactic radiosurgery or radiosurgery alone. Int J Radiat Oncol Biol Phys. 2007;68(5):1388-95.[PMID:17674975](レベルⅠb)
|
|
| 11) |
Meyers CA, Smith JA, Bezjak A, et al. Neurocognitive function and progression in patients with brain metastases treated with whole-brain radiation and motexafin gadolinium:results of a randomized phase III trial. J Clin Oncol. 2004;22(1):157—65.[PMID:14701778](レベルⅠb)
|
|
| 12) |
Mulvenna P, Nankivell M, Barton R, et al. Dexamethasone and supportive care with or without whole brain radiotherapy in treating patients with non-small cell lung cancer with brain metastases unsuitable for resection or stereotactic radiotherapy(QUARTZ):results from a phase 3, non-inferiority, randomised trial. Lancet. 2016;388(10055):2004-14.[PMID:27604504](レベルⅠb)
|
|
| 13) |
Gondi V, Pugh SL, Tome WA, et al. Preservation of memory with conformal avoidance of the hippocampal neural stem-cell compartment during whole-brain radiotherapy for brain metastases (RTOG 0933): a phase II multi-institutional trial. J Clin Oncol Clin Oncol. 2014;32(34):3810-3816(レベルIIa)doi:10.1200/JCO.2014.57.2909
|
|
| 14) |
Brown PD, Gondi V, Pugh S, et al. Hippocampal avoidance during whole-brain radiotherapy plus memantine for patients with brain metastases: phase III trial NRG Oncology CC001. J Clin Oncol. 2020;38:1019-1029(レベルIb)doi:10.1200/JCO.19.02767
|
|
| 15) |
Yang WC, Chen YF, Yang CC, et al. Hippocampal avoidance whole-brain radiotherapy without memantine in preserving neurocognitive function for brain metastases: a phase II blinded randomized trial. Neuro-Oncol. 2021;23(3):478-486(レベルIb) doi:10.1093/neuonc/noaa193
|
|
| 16) |
Patchell RA, Tibbs PA, Regine WF, et al. Postoperative radiotherapy in the treatment of single metastases to the brain:a randomized trial. JAMA. 1998;280(17):1485-9.[PMID:9809728](レベルⅠb)
|
|
| 17) |
Soffietti R, Kocher M, Abacioglu U, et al. A European Organisation for Research and Treatment of Cancer phase III trial of adjuvant whole-brain radiotherapy versus observation in patients with one to three brain metastases from solid tumors after surgical resection or radiosurgery:quality-of-life results. J Clin Oncol. 2013;31(1):65-72.[PMID:23213105](レベルⅠb)
|
|
| 18) |
Bindal RK, Sawaya R, Leavens ME, et al. Surgical treatment of multiple brain metastases. J Neurosurg. 1993;79(2):210-6.[PMID:8331402](レベルⅢ)
|
|
| 19) |
Andrews DW, Scott CB, Sperduto PW, et al. Whole brain radiation therapy with or without stereotactic radiosurgery boost for patients with one to three brain metastases:phase III results of the RTOG 9508 randomised trial. Lancet. 2004;363(9422):1665-72.[PMID:15158627](レベルⅠb)
|
|
| 20) |
Aoyama H, Tago M, Shirato H;Japanese Radiation Oncology Study Group 99-1(JROSG 99-1) Investigators. Stereotactic radiosurgery with or without whole-brain radiotherapy for brain metastases:secondary analysis of the JROSG 99-1 randomized clinical trial. JAMA Oncol. 2015;1(4):457-64.[PMID:26181254](レベルⅠb)
|
|
| 21) |
Sahgal A, Aoyama H, Kocher M, et al. Phase 3 trials of stereotactic radiosurgery with or without whole-brain radiation therapy for 1 to 4 brain metastases:individual patient data meta-analysis. Int J Radiat Oncol Biol Phys. 2015;91(4):710-7.[PMID:25752382](レベルⅠa)
|
|
| 22) |
Muacevic A, Wowra B, Siefert A, et al. Microsurgery plus whole brain irradiation versus Gamma Knife surgery alone for treatment of single metastases to the brain:a randomized controlled multicenter phase III trial. J Neurooncol. 2008;87(3):299-307.[PMID:18157648](レベルⅠb)
|
|
| 23) |
Roos DE, Smith JG, Stephens SW. Radiosurgery versus surgery, both with adjuvant whole brain radiotherapy, for solitary brain metastases:a randomised controlled trial. Clin Oncol R Coll Radiol. 2011;23(9):646-51.[PMID:21592754](レベルⅠb)
|
|
| 24) |
Rades D, Kueter JD, Veninga T, et al. Whole brain radiotherapy plus stereotactic radiosurgery(WBRT+SRS) versus surgery plus whole brain radiotherapy(OP+WBRT) for 1-3 brain metastases:results of a matched pair analysis. Eur J Cancer. 2009;45(3):400-4.[PMID:19062269](レベルⅢ)
|
|
| 25) |
Kayama T, Sato S, Sakurada K, et al;Japan Clinical Oncology Group. Effects of surgery with salvage stereotactic radiosurgery versus surgery with whole-brain radiation therapy in patients with one to four brain metastases (JCOG0504):A phase III, noninferiority, randomized controlled trial. J Clin Oncol. 2018:JCO2018786186. [PMID:29924704](レベルⅠb)
|
|
| 26) |
Mahajan A, Ahmed S, McAleer MF, et al. Post-operative stereotactic radiosurgery versus observation for completely resected brain metastases: a single-centre randomised, controlled, phase 3 trial. Lancet Oncol. 2017;18(8):1040-1048 レベルIb)doi:10.1016/S1470-2045(17)30414-X
|
|
| 27) |
Lamba N, Muskens IS, DiRisio AC, et al. Stereotactic radiosurgery versus whole-brain radiotherapy after intracranial metastasis resection: a systematic review and meta-analysis. Rad Oncol. 2017;12:106(レベルIII)doi:10.1186/s13014-017-0840-x
|
|
| 28) |
Akanda ZZ, Hong W, Nahavandi S, et al. Post-operative stereotactic radiosurgery following excision of brain metastases: a systematic review and meta-analysis. Radiother Oncol. 2020;142:27-35 (レベルIIa)doi:10.1016/j.radonc.2019.08.024
|
|
| 29) |
Tsao MN, Xu W, Wong RKS, et al. Whole brain radiotherapy for the treatment of newly diagnosed multiple brain metastases. Cochrane Database of Systematic Reviews. 2018; Issue 1 Art. No.:CD003869, [PMID:29365347](レベルIa)
doi:10.1002/14651858.CD003869.pub4
|
|
| 30) |
Horton J, Baxter DH, Olson KB. The management of metastases to the brain by irradiation and corticosteroids. Am J Roentgenol Radium Ther Nucl Med. 1971;111(2):334-6. [PMID:5541678](レベルⅠb)
|
|
| 31) |
Graham PH, Bucci J, Browne L. Randomized comparison of whole brain radiotherapy, 20 Gy in four daily fractions versus 40 Gy in 20 twice-daily fractions, for brain metastases. Int J Radiat Oncol Biol Phys. 2010;77(3):648-54.[PMID:19836153](レベルⅠb)
|
|
| 32) |
Kurtz JM, Gelber R, Brady LW, et al. The palliation of brain metastases in a favorable patient population:a randomized clinical trial by the Radiation Therapy Oncology Group. Int J Radiat Oncol Biol Phys. 1981;7(7):891-5.[PMID:6171553](レベルⅠb)
|
|
| 33) |
Priestman TJ, Dunn J, Brada M, et al. Final results of the Royal College of Radiologists’ trial comparing two different radiotherapy schedules in the treatment of cerebral metastases. Clin Oncol R Coll Radiol. 1996;8(5):308-15.[PMID:8934050](レベルⅠb)
|
|
| 34) |
Murray KJ, Scott C, Greenberg HM, et al. A randomized phase III study of accelerated hyperfractionation versus standard in patients with unresected brain metastases:a report of the Radiation Therapy Oncology Group(RTOG) 9104. Int J Radiat Oncol Biol Phys. 1997;39(3):571-4.[PMID:9336134](レベルⅠb)
|
|
| 35) |
Regine WF, Scott C, Murray K, et al. Neurocognitive outcome in brain metastases patients treated with accelerated-fractionation vs. accelerated-hyperfractionated radiotherapy:an analysis from Radiation Therapy Oncology Group Study 91-04. Int J Radiat Oncol Biol Phys. 2001;51(3):711-7.[PMID:11597813](レベルⅠb)
|
|
| 36) |
Paek SH, Audu PB, Sperling MR, et al. Reevaluation of surgery for the treatment of brain metastases:review of 208 patients with single or multiple brain metastases treated at one institution with modern neurosurgical techniques. Neurosurgery. 2005;56(5):1021-34.[PMID:15854250](レベルⅢ)
|
|
| 37) |
Iwadate Y, Namba H, Yamaura A. Significance of surgical resection for the treatment of multiple brain metastases. Anticancer Res. 2000;20(1B):573-7.[PMID:10769728](レベルⅢ)
|
|
| 38) |
Yamamoto M, Serizawa T, Shuto T, et al. Stereotactic radiosurgery for patients with multiple brain metastases(JLGK0901):a multi—institutional prospective observational study. Lancet Oncol. 2014;15(4):387-95.[PMID:24621620](レベルⅡa)
|
|

|
|

|

|
| |
薬物療法
|

|
| |
|
CQ2 転移性脳腫瘍の治療のなかで薬物療法(分子標的治療薬を含む)はどう選択するのか?
|

|
| |
|
推奨1
症候性または近い将来に脳局所治療を必要とする転移性脳腫瘍では,原則として放射線治療または腫瘍摘出術を優先することを推奨する。(推奨度1C)
|
|

|
| |
|
推奨2
薬物療法に高感受性とされる腫瘍では,全身薬物療法を単独,または転移性脳腫瘍への局所治療と並行して行うことを提案する。(推奨度2B)
|
|

|
| |
|
推奨3
推奨2に該当しない固形腫瘍では,頭蓋外に明らかながん病変があり,かつ転移性脳腫瘍による症状がない場合には,転移性脳腫瘍および頭蓋外病変への効果を期待して全身薬物療法を優先することを提案する。(推奨度2C)
|
|

|
| |
|
推奨4
髄膜がん腫症では,それぞれの腫瘍の薬物療法感受性を根拠として全身薬物療法または抗がん薬の髄腔内投与を行うことを提案する。(推奨度2C)
|
|

|
| |
|
解説
|
| |
|
一般に薬物療法の転移性脳腫瘍に対する局所効果は放射線治療や腫瘍摘出術と比較して劣るため,症状を有する転移性脳腫瘍では原則として放射線治療または腫瘍摘出術を優先する。近年,分子標的薬や免疫チェックポイント阻害薬の登場によって治療効果が著しく向上していることから,症状があっても軽度でありコントロールできていれば,放射線治療による障害を回避または先送りするために全身薬物療法を先行させる治療医が増えている。しかし,明らかな症状を有する患者では転移性脳腫瘍の局所治療を優先する考え方に大きな変化はない。
がん薬物療法の進歩による予後の改善とともに,転移性脳腫瘍が無症状で発見される機会が特に増えている。これら転移性脳腫瘍に対する全身薬物療法の適応は,血液脳関門による薬物分布の制限を考慮しつつも,それぞれの腫瘍の薬物療法に対する感受性を根拠として判断する。特に良好な予後が期待できる場合には,全脳照射による晩期障害の回避を目的に薬物療法を優先してもよい。
|

|
| |
|
1.脳転移を有する,薬物療法に高感受性とされる腫瘍
(頭蓋内原発を除く胚細胞腫瘍,絨毛がん,あるいは中枢神経系原発を除く悪性リンパ腫など)
|
| |
|
転移性脳腫瘍に対しても全身薬物療法は有効な治療手段であるため,全身薬物療法を単独,または転移性脳腫瘍への局所治療と並行して行う。
中枢神経系原発を除く非ホジキンリンパ腫の中枢神経系への転移は,ほとんどが髄膜がん腫症である。中枢神経系への移行が良好であるメトトレキサート(MTX)の大量全身投与(3 g/m2以上)を含む薬物療法を行う。髄膜がん腫症では抗がん薬の髄腔内投与を考慮するが,MTXやシタラビンが使用される。脳転移または髄膜がん腫症を有する20例の後方視的検討では,大量MTXとイホスファミドの全身投与により12例の完全奏効(CR)と6例の部分奏効(PR)を認めた1)(レベルⅢ)。中枢神経病変に対するリツキシマブの全身投与の意義は明らかではない。
非ホジキンリンパ腫のうち,特に中枢神経再発のリスクが高い場合には,予防的に大量MTXの全身投与または抗がん薬の髄腔内投与を行う。標準治療であるR—CHOP(リツキシマブ+シクロホスファミド+ドキソルビシン+ビンクリスチン+プレドニゾロン)療法に大量MTXを併用した65例の後方視的解析によると,中枢神経系の再発は2例(3%)に認めた2)(レベルⅢ)。また,全身薬物療法によりCRが得られた68例のうち,髄腔内投与を行わなかった39例では中枢神経系の再発を6例(15%)に認めたが,予防的にMTXとヒドロコルチゾンの髄腔内投与を行った29例では中枢神経系の再発を認めなかった3)(レベルⅡa)。
頭蓋内原発を除く胚細胞腫瘍の転移性脳腫瘍では,全身薬物療法を初回治療として単独,または脳局所の放射線治療もしくは腫瘍摘出術と併用して行う4)(レベルⅢ)。薬物療法未実施の小細胞肺がんの転移性脳腫瘍では,腫瘍縮小効果は頭蓋外病変と同等という報告と,頭蓋外病変と比較して低いという報告がある5)(レベルⅢ)。
|

|
| |
|
2.無症状の脳転移を有する,薬物療法に高感受性とはされない固形腫瘍
|
| |
|
頭蓋外に明らかながん病変があり,かつ転移性脳腫瘍による症状がない,または近い将来において脳局所治療を必要としない場合には,それぞれの腫瘍の薬物療法に対する感受性を根拠として全身薬物療法を行ってもよい。全身薬物療法によって転移性脳腫瘍および頭蓋外病変への効果が期待できるため,頭蓋外病変のコントロールによる予後の改善,全脳照射を遅らせることによる晩期障害の回避が期待できる可能性がある。髄膜がん腫症に対するMTXの髄腔内投与の有用性は十分には確立されておらず,血液毒性や薬剤性白質脳症などの副作用が問題になる。乳がん,肺がん,悪性リンパ腫を含む髄膜がん腫症52例に対してMTXまたはチオテパ(投与法未承認,適応外使用)の髄腔内投与を比較した試験では,16例(31%)で髄液細胞診は陰性となったが,いずれにおいても神経症状の改善は得られず,39例(75%)は8週以内に神経症状が増悪した6)(レベルⅠb)。
乳がんの転移性脳腫瘍または髄膜がん腫症に対して,経口フッ化ピリミジン薬であるカペシタビンの有効性を示す症例報告がある7)(レベルⅣ)。ヒト上皮成長因子受容体(human epidermal growth factor receptor type 2:HER2/neu)陽性乳がんでは,抗HER2モノクローナル抗体薬であるトラスツズマブによる予後の改善と,トラスツズマブの脳内移行が血液脳関門により不良であることから,これらの結果として転移性脳腫瘍をきたす症例が増加している。一方,ペルツズマブとトラスツズマブ エムタンシン(T-DM1)の第Ⅲ相試験のサブグループ解析では,それぞれ頭蓋内病変に対する有効性が示唆されている8,9)(いずれもレベルⅢ)。現在のところ,HER2陽性乳がんの転移性脳腫瘍の診断時において全身病変が増悪していない場合,全身薬物療法の内容は変更せずに転移性脳腫瘍への局所治療を並行して行う考え方が一般的である10)(レベルⅤ)。また,脳転移による症状がないHER2陽性乳がんの転移性脳腫瘍では,HER2および上皮成長因子受容体(epidermal growth factor receptor:EGFR)の2つのチロシンキナーゼ受容体を阻害する経口の低分子化合物ラパチニブとカペシタビンの併用療法も選択肢になる。フランスで行われた第Ⅱ相試験(LANDSCAPE試験)では,44例のうち29例(66%)で転移性脳腫瘍の縮小が認められ,病勢進行までの期間中央値は5.5カ月であった11)(レベルⅡb)。この試験には頭痛などの軽度の神経症状を有する患者が含まれており,そのうち6割で症状の改善を認めた。最近、新規HER2阻害薬tucatinib(未承認)の転移性脳腫瘍に対する有効性について,既治療のHER2陽性乳がん患者を対象にトラスツズマブとカペシタビンとの併用で実施された比較試験(HER2CLIMB試験)の探索的解析が報告されている12)。 乳がんの髄膜がん腫症に対してMTXの髄腔内投与が行われることがあるが,小規模の比較試験によると全身投与のみと比較して髄腔内投与を併用する意義は認められていない13)(レベルⅡa)。
非小細胞肺がんでは,無症状の転移性脳腫瘍を有する患者に対する初回治療としての全身薬物療法の有用性を示す報告がある。全身薬物療法を行った群と全脳照射後に全身薬物療法を行った群を比較した試験では,薬物療法による頭蓋内外の腫瘍縮小効果はほぼ同等であり,また両群間の生存期間に差を認めなかった14)(レベルⅠb)。また,無症状の転移性脳腫瘍を有する43例に対して,初回治療としてシスプラチンとペメトレキセドの併用療法を行った第Ⅱ相試験では,転移性脳腫瘍の縮小を18例(42%)に認めた15)(レベルⅡb)。また,近年では免疫チェックポイント阻害薬が標準治療に組み込まれており,単剤または化学療法との併用,抗PD-1抗体ニボルマブと抗CTLA-4抗体イピリムマブの併用で使用される。転移性脳腫瘍に対する有効性はほとんどの試験において他の転移病変と合わせて評価されており,転移性脳腫瘍への効果を直接評価した試験は乏しい。そのなかで,転移性脳腫瘍の腫瘍縮小を主要評価項目とした抗PD-1抗体ペムブロリズマブ単剤治療の第Ⅱ相試験では、腫瘍組織のPD-L1発現が1%以上であった37例のうち11例で転移性脳腫瘍の縮小を認めている16)(レベルⅠb)。一方,ドライバー遺伝子変異を有する非小細胞肺癌では,転移性脳腫瘍を有する場合であっても分子標的治療薬が積極的に選択される。EGFR遺伝子変異を有する非小細胞肺がんでは,EGFRチロシンキナーゼ阻害薬ゲフィチニブ,エルロチニブ,アファチニブによる転移性脳腫瘍や髄膜がん腫症に対する効果が報告されている17,18)(それぞれレベルⅠa,Ⅰb)。オシメルチニブは第三世代のEGFRチロシンキナーゼ阻害薬であり,従来のEGFR阻害薬に耐性となるT790M変異陽性例にも有効である。15試験のシステマティックレビューとメタアナリシスによれば,中枢神経病変に対する奏効割合は64%(195例),病勢制御割合は90%(245例)であった19)(レベルⅠa)。また,ALK融合遺伝子を有する非小細胞肺がんでも,ALKチロシンキナーゼ阻害薬クリゾチニブ,アレクチニブ,セリチニブ, ロルラチニブ,ブリグチニブによる転移性脳腫瘍に対する効果が報告されている20-24)(それぞれレベルⅣ,Ⅰb, Ⅱa,Ⅰa,Ⅰa)。特に第三世代のALK阻害薬であるロルラチニブは,一次治療としてクリゾチニブと比較した第Ⅲ相試験において転移性脳腫瘍の有無にかかわらず無増悪生存期間の延長が示されており,頭蓋内病変の奏効割合は82%,そのうち71%で完全奏効が認められた23)(レベルⅠa)。
腎細胞がんでは,免疫チェックポイント阻害薬および血管新生阻害作用を有する分子標的治療薬により治療効果が飛躍的に向上している。しかし,未治療の転移性脳腫瘍は出血きたしやすいため,無症状であっても全身治療を開始する前に局所治療を優先させるべきである25)(レベルⅤ)。 スニチニブの拡大アクセスプログラム(患者救済のために未承認薬の使用を認める制度)の対象となった患者の後方視的解析では,転移性脳腫瘍を有する324例のうち30例(9%)に腫瘍縮小を認め,無増悪生存期間中央値は5.3カ月であり,全体4,543例の奏効割合16%,無増悪生存期間中央値9.4カ月と比較すると効果が乏しいことが示唆された26)(レベルⅢ)。一方,ソラフェニブの欧州における拡大アクセスプログラムの解析では,転移性脳腫瘍を有する28例の安全性と無増悪生存期間は全体(それぞれ1,145例と1,150例)と同等であった27)(レベルⅢ)。血管新生阻害薬による治療後で転移性脳腫瘍を有する患者を対象に行われたニボルマブの第Ⅱ相試験では,未治療の頭蓋内病変の奏効割合は39例のうち4例(12% )に留まるなど,その効果は限定的であった28) (レベルⅡa)。
悪性黒色腫では,免疫チェックポイント阻害薬やBRAF阻害薬が標準治療に組み込まれるようになり、治療体系が大きく変化した。BRAF遺伝子変異(主にV600E)を有する悪性黒色腫ではBRAFキナーゼ阻害薬の転移性脳腫瘍に対する有効性が多く報告されている29)(レベルⅠa)。ニボルマブとイピリムマブの併用療法の未治療94例に対する第Ⅱ相試験では、頭蓋内病変は52例(57%)で奏効が得られている30)(レベルⅡa)。ダブラフェニブとMEK阻害薬トラメチニブとの併用療法の第Ⅱ相試験(COMBI-MB試験)では、頭蓋内病変を有する症例の58%に腫瘍縮小を認めたが、その奏効期間は中央値6.5ヶ月と短く、頭蓋外よりも頭蓋内の病変が増悪することが多かった31)(レベルⅡa)。
高分子化合物であるモノクローナル抗体薬は血液脳関門を通過しないため,通常は全身投与による転移性脳腫瘍への効果は期待できない。血管内皮細胞増殖因子(vascular endothelial growth factor:VEGF)に対するモノクローナル抗体薬であるベバシズマブは大腸がん,肺がん,乳がんに対して他の薬物療法と併用で用いられるが,転移性脳腫瘍からの出血のリスクについては慎重に判断する。しかし,転移性脳腫瘍があるという理由のみで一律に投与回避する必要はなく,非小細胞肺がんでは転移性脳腫瘍に対する有効性を示唆する報告がある32,33)(それぞれレベルⅠa,Ⅱb)。
放射線増感作用を期待して,あるいは全身薬物療法として抗がん薬を放射線治療に同時併用する治療法の有用性は確立していない。非小細胞肺がんでは,全脳照射とエルロチニブの併用によって中枢神経系病変に高い奏効割合が認められたという報告と,全脳照射+定位放射線照射とエルロチニブまたはテモゾロミドの併用によって副作用が増強し生存期間が短縮する傾向にあったという報告があり,日常臨床で放射線治療にエルロチニブを併用するだけの十分なエビデンスはない34,35)(それぞれレベルⅡb,Ⅰb)。
|

|
| |
|
| 文献 |
| 1) |
Fischer L, Korfel A, Kiewe P, et al. Systemic high-dose methotrexate plus ifosfamide is highly effective for central nervous system(CNS)involvement of lymphoma. Ann Hematol. 2009;88(2):133-9.[PMID:18679681](レベルⅢ)
|
|
| 2) |
Abramson JS, Hellmann M, Barnes JA, et al. Intravenous methotrexate as central nervous system(CNS) prophylaxis is associated with a low risk of CNS recurrence in high-risk patients with diffuse large B-cell lymphoma. Cancer. 2010;116(18):4283-90.[PMID:20564149](レベルⅢ)
|
|
| 3) |
Tomita N, Kodama F, Kanamori H, et al. Prophylactic intrathecal methotrexate and hydrocortisone reduces central nervous system recurrence and improves survival in aggressive non-hodgkin lymphoma. Cancer. 2002;95(3):576-80.[PMID:12209750](レベルⅡa)
|
|
| 4) |
Bokemeyer C, Nowak P, Haupt A, et al. Treatment of brain metastases in patients with testicular cancer. J Clin Oncol. 1997;15(4):1449-54.[PMID:9193339](レベルⅢ)
|
|
| 5) |
Seute T, Leffers P, Wilmink JT, et al. Response of asymptomatic brain metastases from small-cell lung cancer to systemic first-line chemotherapy. J Clin Oncol. 2006;24(13):2079-83.[PMID:16648509](レベルⅢ)
|
|
| 6) |
Grossman SA, Finkelstein DM, Ruckdeschel JC, et al. Randomized prospective comparison of intraventricular methotrexate and thiotepa in patients with previously untreated neoplastic meningitis. Eastern Cooperative Oncology Group. J Clin Oncol. 1993;11(3):561-9. [PMID:8445432](レベルⅠb)
|
|
| 7) |
Ekenel M, Hormigo AM, Peak S, et al. Capecitabine therapy of central nervous system metastases from breast cancer. J Neurooncol. 2007;85(2):223-7.[PMID:17611719](レベルⅣ)
|
|
| 8) |
Swain SM, Baselga J, Miles D, et al. Incidence of central nervous system metastases in patients with HER2-positive metastatic breast cancer treated with pertuzumab, trastuzumab, and docetaxel:results from the randomized phase III study CLEOPATRA. Ann Oncol. 2014;25(6):1116-21.[PMID:24685829](レベルⅢ)
|
|
| 9) |
Krop IE, Lin NU, Blackwell K, et al. Trastuzumab emtansine(T—DM1) versus lapatinib plus capecitabine in patients with HER2-positive metastatic breast cancer and central nervous system metastases:a retrospective, exploratory analysis in EMILIA. Ann Oncol. 2015;26(1):113-9.[PMID:25355722](レベルⅢ)
|
|
| 10) |
Ramakrishna N, Temin S, Chandarlapaty S, et al. Recommendations on disease management for patients with advanced human epidermal growth factor receptor 2-positive breast cancer and brain metastases:American Society of Clinical Oncology clinical practice guideline. J Clin Oncol. 2014;32(19):2100-8.[PMID:24799487](レベルⅤ)
|
|
| 11) |
Bachelot T, Romieu G, Campone M, et al. Lapatinib plus capecitabine in patients with previously untreated brain metastases from HER2-positive metastatic breast cancer(LANDSCAPE):a single-group phase 2 study. Lancet Oncol. 2013;14(1):64-71.[PMID:23122784](レベルⅡb)
|
|
| 12) |
Lin NU, Borges V, Anders C, et al. Intracranial efficacy and survival with tucatinib plus trastuzumab and capecitabine for previously treated HER2-positive breast cancer with brain metastases in the HER2CLIMB Trial. J Clin Oncol. 2020;38(23):2610-2619. [PMID: 32468955](レベルⅠb)
|
|
| 13) |
Boogerd W, van den Bent MJ, Koehler PJ, et al. The relevance of intraventricular chemotherapy for leptomeningeal metastasis in breast cancer:a randomised study. Eur J Cancer. 2004;40(18):2726-33.[PMID:15571954](レベルⅡa)
|
|
| 14) |
Lee DH, Han JY, Kim HT, et al. Primary chemotherapy for newly diagnosed nonsmall cell lung cancer patients with synchronous brain metastases compared with whole-brain radiotherapy administered first:result of a randomized pilot study. Cancer. 2008;113(1):143-9.[PMID:18459180](レベルⅠb)
|
|
| 15) |
Barlesi F, Gervais R, Lena H, et al. Pemetrexed and cisplatin as first-line chemotherapy for advanced non-small-cell lung cancer(NSCLC) with asymptomatic inoperable brain metastases:a multicenter phase II trial(GFPC 07-01). Ann Oncol. 2011;22(11):2466-70.[PMID:21321089](レベルⅡb)
|
|
| 16) |
Goldberg SB, Schalper KA, Gettinger SN, et al. Pembrolizumab for management of patients with NSCLC and brain metastases: long-term results and biomarker analysis from a non-randomised, open-label, phase 2 trial. Lancet Oncol. 2020 May;21(5):655-663. [PMID: 32251621](レベルⅠb)
|
|
| 17) |
Jamal-Hanjani M, Spicer J. Epidermal growth factor receptor tyrosine kinase inhibitors in the treatment of epidermal growth factor receptor-mutant non-small cell lung cancer metastatic to the brain. Clin Cancer Res. 2012;18(4):938-44.[PMID:22167408](レベルⅠa)
|
|
| 18) |
Schuler M, Wu YL, Hirsh V, et al. First-line afatinib versus chemotherapy in patients with non-small cell lung cancer and common epidermal growth factor gene mutations and brain metastases. J Thor Oncol. 2016;11(3):380-90.[PMID:26823294](レベルⅠb)
|
|
| 19) |
Erickson AW, Brastianos PK, Das S. Assessment of effectiveness and safety of osimertinib for patients with intracranial metastatic disease: a systematic review and meta-analysis. JAMA Netw Open. 2020 Mar 2;3(3):e201617.[PMID: 32211870](レベルⅠa)
|
|
| 20) |
Costa DB, Shaw AT, Ou SHI, et al. Clinical experience with crizotinib in patients with advanced ALK-rearranged non-small-cell lung cancer and brain metastases. J Clin Oncol. 2015;33(17):1881-8.[PMID:25624436](レベルⅣ)
|
|
| 21) |
Peters S, Camidge DR, Shaw AT, et al. Alectinib versus crizotinib in untreated ALK-positive non-small-cell lung cancer. N Engl J Med. 2017 Aug 31;377(9):829-838. [PMID: 28586279](レベルⅠb)
|
|
| 22) |
Kim DW, Mehra R, Tan DSW, et al. Activity and safety of ceritinib in patients with ALK-rearranged non-small-cell lung cancer(ASCEND-1):updated results from the multicentre, open-label, phase 1 trial. Lancet Oncol. 2016;17(4):452-63.[PMID:26973324](レベルⅡa) |
|
| 23) |
Shaw AT, Bauer TM, de Marinis F, et al. First-line lorlatinib or crizotinib in advanced ALK-positive lung cancer. N Engl J Med. 2020 Nov 19;383(21):2018-2029. [PMID: 33207094](レベルⅠa)
|
|
| 24) |
Camidge DR, Kim HR, Ahn MJ, et al: Brigatinib versus crizotinib in ALK-positive non–small-cell lung cancer. N Engl J Med 379:2027-39, 2018.[PMID: 30280657](レベルⅠa)
|
|
| 25) |
Atkins MB. Overview of the treatment of renal cell carcinoma. In: UpToDate, Richie JP (Ed), UpToDate, Waltham, MA. (Accessed on August 23, 2021.) (レベルⅤ)
|
|
| 26) |
Gore ME, Szczylik C, Porta C, et al. Final results from the large sunitinib global expanded-access trial in metastatic renal cell carcinoma. Br J Cancer. 2015;113(1):12-9.[PMID:26086878](レベルⅢ)
|
|
| 27) |
Beck J, Procopio G, Bajetta E, et al. Final results of the European Advanced Renal Cell Carcinoma Sorafenib(EU-ARCCS) expanded-access study:a large open-label study in diverse community settings. Ann Oncol. 2011;22(8):1812-23.[PMID:21324953](レベルⅢ)
|
|
| 28) |
Flippot R, Dalban C, Laguerre B, et al: Safety and efficacy of nivolumab in brain metastases from renal cell carcinoma: results of the GETUG-AFU 26 NIVOREN multicenter phase II study. J Clin Oncol 37:2008-2016, 2019.[PMID:31194611](レベルⅡa)
|
|
| 29) |
Rulli E, Legramandi L, Salvati L, Mandala M, et al. The impact of targeted therapies and immunotherapy in melanoma brain metastases: a systematic review and meta-analysis. Cancer. 2019;125(21):3776-3789.[PMID: 31287564](レベルⅠa)
|
|
| 30) |
Tawbi HA, Forsyth PA, Algazi A, et al: Combined nivolumab and ipilimumab in melanoma metastatic to the brain. N Engl J Med 379:722-730, 2018. [PMID: 30134131](レベルⅡa)
|
|
| 31) |
Davies MA, Saiag P, Robert C, et al. Dabrafenib plus trametinib in patients with BRAFV600-mutant melanoma brain metastases (COMBI-MB): a multicentre, multicohort, open-label, phase 2 trial. Lancet Oncol 18:863-873, 2017. [PMID: 28592387](レベルⅡa)
|
|
| 32) |
Besse B, Lasserre SF, Compton P, et al. Bevacizumab safety in patients with central nervous system metastases. Clin Cancer Res. 2010;16(1):269-78.[PMID:20028762](レベルⅠa)
|
|
| 33) |
Besse B, Le Moulec S, Mazières J, et al. Bevacizumab in patients with nonsquamous non-small cell lung cancer and asymptomatic, untreated brain metastases(BRAIN):a nonrandomized, phase II study. Clin Cancer Res. 2015;21(8):1896-903.[PMID:25614446](レベルⅡb) |
|
| 34) |
Welsh JW, Komaki R, Amini A, et al. Phase II trial of erlotinib plus concurrent whole-brain radiation therapy for patients with brain metastases from non-small-cell lung cancer. J Clin Oncol. 2013;31(7):895-902.[PMID:23341526](レベルⅡb)
|
|
| 35) |
Sperduto PW, Wang M, Robins HI, et al. A phase 3 trial of whole brain radiation therapy and stereotactic radiosurgery alone versus WBRT and SRS with temozolomide or erlotinib for non-small cell lung cancer and 1 to 3 brain metastases:Radiation Therapy Oncology Group 0320. Int J Radiat Oncol Biol Phys. 2013;85(5):1312-8.[PMID:23391814](レベルⅠb)
|
|

|
| |
再発例への治療
|

|
| |
|
CQ3 再発の転移性脳腫瘍の治療はどう選択するのか?
|

|
| |
|
推奨1
全脳照射が行われていない症例に関しては,全脳照射の追加を提案する。(推奨度2C)
|
|

|
| |
|
推奨2
定位放射線照射(STI)後の長径3 cm以下の新規脳内病変あるいは局所再発病変に対し,STIを提案する。(推奨度2C)
|
|

|
| |
|
推奨3
全脳照射後の長径3 cm以下の再発に対し,STIを提案する。(推奨度2C)
|
|

|
| |
|
推奨4
腫瘍の種類によっては薬物療法を提案する。(本章CQ2参照)(推奨度2C)
|
|

|
| |
|
推奨5
機能予後あるいは生命予後の改善が期待される場合には,摘出術を提案する。(推奨度2C)
|
|

|
| |
|
解説
|
| |
|
1.定位放射線照射後の再発
|
| |
|
定位放射線照射(stereotactic irradiation:STI)後の再発に対するSTI再照射は,新規脳内病変(遠隔部位への再発)と局所再発に分けて考える必要がある。
Hanssensらは,定位手術的照射(stereotactic radiosurgery:SRS)後の患者の前方視的観察に基づき,新規の脳内病変に対してSRSを再度行った251例について解析した1)(レベルⅢ)。SRS再照射後の生存期間中央値は9.6カ月であり,新病変の出現までの中央値は7.5カ月であった。生存期間は年齢,性別,がんの種類,全脳照射の有無とは関係がなかった。単発転移は多発転移より生存期間が長く(それぞれ16カ月と8.3カ月),転移数が2~4個の患者では5個以上の患者よりも長期に生存した(それぞれ10カ月と5.8カ月)。一方,局所再発の場合の再照射についてのevidenceの高い報告は少なく,放射線壊死との鑑別や,再照射による壊死のリスクを低減するために線量の減量や分割が必要である。STI後の局所再発に対する再定位照射の治療成績についてはLoiらが2020年に11件の研究のメタアナリシスを行なっている。彼らによると再治療後1年のlocal failureが24%(95% confidence interval [19-30])でmedian pooled overall survivalが14ヶ月、放射線性壊死の頻度が13%と認容できる成績だった2)(レベルⅢ)。
全体としてSTIによる再治療後の生存期間中央値は7.5~9.6カ月,1年間の局所制御割合57~95%であり,70%以上で1年以内に新規に脳内病変が出現する1,3,4)(いずれもレベルⅢ)。Karnofsky performance status(KPS),recursive partitioning analysis(RPA)クラス,全身のがんの状況,多発であるか,が予後関連因子として報告されている。このようにSTIは再発時の治療としての高いエビデンスはないものの,比較的低いリスクで有効な治療効果が得られること,全脳照射を回避できることから腫瘍径が小さい新規の脳内病変には考慮すべき治療である。どのような症例が局所再発時に救済的なSTIの適応になるかについては今後の症例の蓄積が必要であるが,当面は全脳照射や腫瘍摘出術などが治療として適当ではない比較的小さい病変に限られるべきであろう。
STI後の再発は,しばしば全脳照射で治療される。初回治療としてSTI単独での治療群と全脳照射を加えた群とを比較した臨床研究では,STI単独群の70%以上で1年以内に脳内再発を認め,その約1/3に全脳照射が行われている5,6)(いずれもレベルⅠb)。Sneedらの多施設共同試験でも,SRS単独での治療を受けた患者268例中98例に救済治療が行われ,そのうち63例は全脳照射を含んだ治療を受けている7)(レベルⅢ)。このように全脳照射は比較的高頻度に行われているにもかかわらず,その治療成績の記載は少ない。前述のHanssensらの研究ではSRS後の再発に対して救済的な全脳照射を行った75例の平均生存は3.8カ月にすぎなかったと述べられているが,対象がより状態の悪い患者に偏っていた可能性があるとしている(レベルⅢ)。
STI後の救済的な全脳照射の治療成績や有害事象については不明な点が多く,再発時に全脳照射で治療するかSTIで再治療するかの明確な指針はない。全脳照射がよいと考えられる場合としては,腫瘍の数が多いか腫瘍体積が大きい場合,または髄腔内播種を伴う場合である。さらに患者の年齢と期待できる余命なども勘案して決めるべきである。STIの良い適応で,それが比較的容易に実施できる施設ではSTIが好まれる傾向にある。局所再発の場合には腫瘍摘出術も考慮する必要がある(「3.腫瘍摘出術」を参照)。一般に薬物療法の転移性脳腫瘍に対する局所効果は放射線治療や腫瘍摘出術と比較して劣るため,症状を有する転移性脳腫瘍では原則として放射線治療または腫瘍摘出術を優先する。
|

|
| |
|
2.全脳照射後の再発
|
| |
|
全脳照射後の再発時のSTIについては,多数の症例報告によりその有効性が示されており,生存期間中央値7.8~10.0カ月,1年の局所制御率57~91.3%,1年での遠隔転移出現率14~58%と報告されている8-13)(いずれもレベルⅢ)。SRSでは線量の減量が必要であり,腫瘍径20 mm以下で24 Gy,21~30 mmで18 Gy,31~40 mmで15 Gyが推奨されている(RTOG 90-05)14)(レベルⅡb)。Caballeroらは,多施設共同研究で全脳照射後の再発にSRS(15~20 Gy)を行った310例の結果から,がん種により予後因子が異なることを報告した8)(レベルⅢ)。乳がんでは年齢(50歳未満),腫瘍の合計の大きさ,全脳照射からSRSまでの期間が有意に生存期間と関係した。非小細胞肺がんでは転移の数,KPS(70%以上),原発巣のコントロールが関係し,悪性黒色腫では腫瘍体積の合計が関係した。STIからの生存期間中央値は全体で8.4カ月であり,単発の場合では多発より長かったが,多発の場合は個数とは関係がなかった。これら以外に,乳がんではHER2陽性患者の予後が良いことが報告されている11)(レベルⅢ)。以上の結果より,全脳照射後の3 cm以下の再発に関してはSTIによる治療が推奨され,がん種により違いはあるがKPS 70%以上で全身のコントロールができており,転移の数が少数あるいは腫瘍体積の合計が小さいものが良い適応と考えられる。
全脳照射後の再発時の全脳再照射の有効性については議論が分かれている。一般に,再照射からの生存期間中央値は2~5.2カ月と短い15-19)(いずれもレベルⅢ)。放射線治療の追加による合併症が問題になるが,10~30 Gyの照射では比較的少なく,症状の改善が期待できるため有用性があるとする意見も多い15,17-19)(いずれもレベルⅢ)。Sonらの報告では,全脳照射を行った380例のうちSTIの対象とならない多数の再発を有する患者17例に再照射を行い,そのうち80%では症状が改善している18)(レベルⅢ)。生存期間中央値は全体で5.2カ月であり,全身コントロールが良好な患者では19.8カ月,良好ではない患者では2.5カ月であった。合併症は軽微であり,症例を選択したうえでの再照射は有効であると結論している。なお,これらの症例には小細胞肺がんが6例含まれており,悪性黒色腫のような放射線抵抗性の腫瘍は含まれていない点に注意が必要である。
一方,Hazukaらは,全脳照射後の転移性脳腫瘍455例のうち44例に全脳再照射を行ったが,有効例は稀であったと報告している16)(レベルⅢ)。1例は再治療から1年以上生存したが,全体の生存期間中央値は8週であり,症状の改善も27%で認められたにすぎなかった。放射線壊死は剖検を行った8例中3例で認められており,そのうち2例では死亡原因と推定されている。Akibaらの報告では,奏効割合〔完全奏効(CR)+部分奏効(PR)〕は55%であったが,認知機能障害が32%に認められている15)(レベルⅢ)。全脳再照射は,STIなどの他の方法の適応とならない患者において,一時的な改善を得るための姑息的治療としては有用かもしれない。しかし,放射線壊死,認知機能障害,下垂体機能低下等の合併症のリスクがあるため,年齢,全身状態,腫瘍の放射線感受性などを含めて考慮する必要がある。
|

|
| |
|
3.腫瘍摘出術
|
| |
|
再発の転移性脳腫瘍に対する大規模な研究やエビデンスの高い報告はない。Kanoらは,SRS後の再発58例に腫瘍摘出術を行い,生存期間中央値は7.7カ月であったと報告している20)(レベルⅢ)。このうち術後6,12,24カ月後の生存割合はそれぞれ65,30,16%,局所制御割合はそれぞれ71,62,43%であった。単変量解析ではRPAクラス,KPS,全身のがんの状態,STIからの期間が生存割合に関連した。病理学的には55%が腫瘍の再発,残りが再発と放射線壊死の混合であった。腫瘍摘出術による死亡率は1.7%であり,重篤な合併症を6.9%に認めた。KPS中央値は術前80%,術後1カ月では90%であった。STIから腫瘍摘出術までの期間は悪性黒色腫で短く,乳がんでは長い傾向があったが,がん種による全生存期間に差は認めなかった。STI後の再増大病変には放射線壊死の場合があり,多くの場合これらの術前診断は困難である21)(レベルⅢ)。放射線壊死の場合は,一般的に摘出後の治療成績は良好である21,22)(いずれもレベルⅢ)。
Bindalらは,初回治療として腫瘍摘出術を受けた後に再発した48例(うち31例は初回治療として全脳照射も併用)に対して再手術を行い,生存期間中央値は11.5カ月であったと報告している23)(レベルⅢ)。全身のがんの広がり,4カ月未満の再発,40歳以上,乳がん,悪性黒色腫が予後不良因子であった。術後死亡はなく,5例で一過性の神経症状の悪化を認めたが,いずれも30日以内に回復している。KPSは33例に改善を認めており,11例では不変であった。
全体としてKPSやRPAクラス,全身状態が良好であることが予後因子として重要であり,さらに前治療からの期間が関連するという報告もある20,21,24,25)(いずれもレベルⅢ)。年齢や組織型に関しては一致がみられない。また,再手術後の生存期間中央値は10カ月前後である20-26)(いずれもレベルⅢ)。術後死亡率は1~2%前後,KPSは改善または不変であったという報告がある22-26)(いずれもレベルⅢ)。術後合併症の発生率は初回手術と大きく変わらず,軽度のものを含めて20%前後である。神経学的な悪化は0~6.9%と報告されており,運動野,言語野などの症候発現域で高い。
このように,STI後の局所症候性進行病変やSTIの適応とならない再発病変では,KPSが70%以上で原発巣がコントロールされている場合には,脳内の他病変の有無を考慮しながら摘出術を行うことで生命予後が改善する可能性があり,しばしばQOLの改善も期待できる。
|

|
| |
|
| 文献 |
| 1) |
Hanssens P, Karlsson B, Vashu R, et al. Salvage treatment of distant recurrent brain metastases with Gamma Knife surgery. Acta Neurochir(Wien). 2012;154(2):285-90.[PMID:22146846](レベルⅢ)
|
|
| 2) |
Loi M, Caini S, Scoccianti S, et al. Stereotactic reirradiation for local failure of brain metastases following previous radiosurgery: Systematic review and meta-analysis. Crit Rev Oncol Hematol. 2020 ; 153: 103043. doi: 10.1016/j.critrevonc.2020.103043. [PMID: 32650217] (レベルIII)
|
|
| 3) |
Kwon KY, Kong DS, Lee JI, et al. Outcome of repeated radiosurgery for recurrent metastatic brain tumors. Clin Neurol Neurosurg. 2007;109(2):132-7.[PMID:16930821](レベルⅢ)
|
|
| 4) |
Rush S, Elliott RE, Morsi A, et al. Incidence, timing, and treatment of new brain metastases after Gamma Knife surgery for limited brain disease:the case for reducing the use of whole-brain radiation therapy. J Neurosurg. 2011;115(1):37-48.[PMID:21417707](レベルⅢ)
|
|
| 5) |
Aoyama H, Shirato H, Tago M, et al. Stereotactic radiosurgery plus whole-brain radiation therapy vs stereotactic radiosurgery alone for treatment of brain metastases:a randomized controlled trial. JAMA. 2006;295(21):2483-91.[PMID:16757720](レベルⅠb)
|
|
| 6) |
Chang EL, Wefel JS, Hess KR, et al. Neurocognition in patients with brain metastases treated with radiosurgery or radiosurgery plus whole-brain irradiation:a randomised controlled trial. Lancet Oncol. 2009;10(11):1037-44.[PMID:19801201](レベルⅠb)
|
|
| 7) |
Sneed PK, Suh JH, Goetsch SJ, et al. A multi-institutional review of radiosurgery alone vs. radiosurgery with whole brain radiotherapy as the initial management of brain metastases. Int J Radiat Oncol Biol Phys. 2002;53(3):519-26.[PMID:12062592](レベルⅢ)
|
|
| 8) |
Caballero JA, Sneed PK, Lamborn KR, et al. Prognostic factors for survival in patients treated with stereotactic radiosurgery for recurrent brain metastases after prior whole brain radiotherapy. Int J Radiat Oncol Biol Phys. 2012;83(1):303-9.[PMID:22079723](レベルⅢ)
|
|
| 9) |
Chao ST, Barnett GH, Vogelbaum MA, et al. Salvage stereotactic radiosurgery effectively treats recurrences from whole-brain radiation therapy. Cancer. 2008;113(8):2198-204.[PMID:18780319](レベルⅢ)
|
|
| 10) |
Harris S, Chan MD, Lovato JF, et al. Gamma knife stereotactic radiosurgery as salvage therapy after failure of whole-brain radiotherapy in patients with small-cell lung cancer. Int J Radiat Oncol Biol Phys. 2012;83(1):e53-9.[PMID:22342297](レベルⅢ)
|
|
| 11) |
Kelly PJ, Lin NU, Claus EB, et al. Salvage stereotactic radiosurgery for breast cancer brain metastases:outcomes and prognostic factors. Cancer. 2012;118(8):2014-20.[PMID:21918959](レベルⅢ)
|
|
| 12) |
Maranzano E, Trippa F, Casale M, et al. Reirradiation of brain metastases with radiosurgery. Radiother Oncol. 2012;102(2):192-7.[PMID:21880387](レベルⅢ))
|
|
| 13) |
Noël G, Proudhom MA, Valery CA, et al. Radiosurgery for re-irradiation of brain metastasis:results in 54 patients. Radiother Oncol. 2001;60(1):61-7.[PMID:11410305](レベルⅢ)
|
|
| 14) |
Shaw E, Scott C, Souhami L, et al. Single dose radiosurgical treatment of recurrent previously irradiated primary brain tumors and brain metastases:final report of RTOG protocol 90-05. Int J Radiat Oncol Biol Phys. 2000;47(2):291-8.[PMID:10802351](レベルⅡb)
|
|
| 15) |
Akiba T, Kunieda E, Kogawa A, et al. Re-irradiation for metastatic brain tumors with whole-brain radiotherapy. Jpn J Clin Oncol. 2012;42(4):264-9.[PMID:22323551](レベルⅢ)
|
|
| 16) |
Hazuka MB, Kinzie JJ. Brain metastases:results and effects of re-irradiation. Int J Radiat Oncol Biol Phys. 1988;15(2):433-7.[PMID:2841266](レベルⅢ)
|
|
| 17) |
Sadikov E, Bezjak A, Yi QL, et al. Value of whole brain re-irradiation for brain metastases--single centre experience. Clin Oncol(R Coll Radiol). 2007;19(7):532-8.[PMID:17662582](レベルⅢ)
|
|
| 18) |
Son CH, Jimenez R, Niemierko A, et al. Outcomes after whole brain reirradiation in patients with brain metastases. Int J Radiat Oncol Biol Phys. 2012;82(2):e167-72.[PMID:21620583](レベルⅢ)
|
|
| 19) |
Wong WW, Schild SE, Sawyer TE, et al. Analysis of outcome in patients reirradiated for brain metastases. Int J Radiat Oncol Biol Phys. 1996;34(3):585-90.[PMID:8621282](レベルⅢ)
|
|
| 20) |
Kano H, Kondziolka D, Zorro O, et al. The results of resection after stereotactic radiosurgery for brain metastases. J Neurosurg. 2009;111(4):825-31.[PMID:19425892](レベルⅢ)
|
|
| 21) |
Truong MT, St Clair EG, Donahue BR, et al. Results of surgical resection for progression of brain metastases previously treated by gamma knife radiosurgery. Neurosurgery. 2006;59(1):86-97. [PMID:16823304](レベルⅢ)
|
|
| 22) |
Jagannathan J, Bourne TD, Schlesinger D, et al. Clinical and pathological characteristics of brain metastasis resected after failed radiosurgery. Neurosurgery. 2010;66(1):208-17.[PMID:20023552](レベルⅢ)
|
|
| 23) |
Bindal RK, Sawaya R, Leavens ME, et al. Reoperation for recurrent metastatic brain tumors. J Neurosurg. 1995;83(4):600-4.[PMID:7674007](レベルⅢ)
|
|
| 24) |
Vecil GG, Suki D, Maldaun MV, et al. Resection of brain metastases previously treated with stereotactic radiosurgery. J Neurosurg. 2005;102(2):209-15.[PMID:15739546](レベルⅢ)
|
|
| 25) |
Al-Zabin M, Ullrich WO, Brawanski A, et al. Recurrent brain metastases from lung cancer:the impact of reoperation. Acta Neurochir(Wien). 2010;152(11):1887-92.[PMID:20617447](レベルⅢ)
|
|
| 26) |
Arbit E, Wroński M, Burt M, et al. The treatment of patients with recurrent brain metastases. A retrospective analysis of 109 patients with nonsmall cell lung cancer. Cancer. 1995;76(5):765-73.[PMID:8625178](レベルⅢ)
|
|
|
|

|
| |
髄膜がん腫症
|

|
| |
|
CQ4 髄膜がん腫症に対する治療はどう選択するのか?
|

|
| |
|
推奨1
腫瘍の広がりおよび粗大病変の存在に応じて,放射線治療を提案する。(推奨度2C)
|
|

|
| |
|
推奨2
腫瘍の種類によっては,薬物療法を提案する。(推奨度2C)
|
|

|
| |
|
推奨3
髄膜がん腫症に伴う水頭症には,髄液シャントあるいはドレナージを行ってもよい。(推奨度2C)
|
|

|
| |
|
解説
|
| |
|
固形がんの髄腔内播種病変に対する放射線治療の有効性に関しては,一致した意見がない1-6)(いずれもレベルⅢ)。いずれも後方視的な研究であるが,肺がん,乳がん,胃がんによる髄膜がん腫症に対して,全脳照射を追加した群と無施行群の比較では生存期間に差はなかったと報告されている1-3)(いずれもレベルⅢ)。一方,Ganiらは,肺がんおよび乳がん患者に対して全脳照射単独で治療を行い,全生存期間中央値は8.1週,6カ月および12カ月での生存割合はそれぞれ26%,15%であったことより,髄注化学療法を行えないような患者では放射線治療は有用だろうと結論している4)(レベルⅢ)。脳病変には一般的に全脳照射が行われることが多いが,全脊髄照射にまで無条件に照射野を広げることには反対意見が強い。全脊髄照射は骨髄機能を低下させることにより,全身薬物療法の実施を困難にする点にも留意しなければならない。一方,占拠性病変では髄腔内投与の抗がん薬は腫瘍内に十分に浸透しないと考えられ,放射線治療はそのような病変部位局所に用いられることがある。脊髄の症候性病変への照射は,痛みなどの症状緩和に有用なことがある。また,髄液灌流のブロックを起こしている部位への照射では,約半数において髄液灌流の回復が認められたという報告がある7)(レベルⅢ)。
最近,上皮成長因子受容体(epidermal growth factor receptor:EGFR)遺伝子変異を有する非小細胞肺がんによる髄膜がん腫症に対してEGFRチロシンキナーゼ阻害薬(エルロチニブやゲフィチニブ)と放射線治療の併用が有効であるとする報告が散見されるようになっている5)(レベルⅢ)。また,非小細胞肺がんの脳実質内転移では,放射線治療にEGFR遺伝子変異の有無にかかわらずエルロチニブを上乗せした群ではむしろ生存期間中央値が短くなる傾向があり,副作用の増強が関連している可能性も指摘されている点には注意が必要である(RTOG 0320試験)8)(レベルⅠb)。今後の分子標的治療の発展により治療法が変わる可能性があるが,現時点では固形がんの髄膜がん腫症に対する姑息的な治療として全脳照射,粗大病変部や髄液灌流のブロックを起こしている部位に対して症状緩和を目的とした局所照射を考慮することが推奨される。
髄膜がん腫症に伴う水頭症は,頭痛や嘔吐,認知機能障害をきたしQOLを低化させる。脳室腹腔シャント術やドレナージ術等により,これらの症状の8割前後は改善する9-11)(いずれもレベルⅢ)。これらの報告では脳室腹腔シャント術後の生存期間中央値は2~3カ月であるが,シャント術後に何らかの治療を追加した群での生存期間はさらに長くなる傾向にある。問題点としては,シャント術等により髄注化学療法の実施が困難となる点が挙げられる。しかし,Linらは,on-off valve(シャントの流れを一時的に止めることのできるバルブ)を備えた脳室腹腔シャントシステムは,リザーバー設置による髄注化学療法より全生存期間の有意な延長があり,症状緩和が得られると報告している10)(レベルⅢ)。また,Zadaらは,圧可変式バルブの圧設定を高くすることによって,髄腔内の抗がん薬濃度を維持できる可能性を示したが,多数例での検討は行われていない12)(レベルⅣ)。合併症には,圧設定不全等のシャント機能不全が10%程度で認められることや,感染,稀ではあるが硬膜下血腫,脳内血腫,腹膜播種などの報告がある。
|

|
| |
|
| 文献 |
| 1) |
Morris PG, Reiner AS, Szenberg OR, et al. Leptomeningeal metastasis from non-small cell lung cancer:survival and the impact of whole brain radiotherapy. J Thorac Oncol. 2012;7(2):382-5.[PMID:22089116](レベルⅢ)
|
|
| 2) |
de Azevedo CR, Cruz MR, Chinen LT, et al. Meningeal carcinomatosis in breast cancer:prognostic factors and outcome. J Neurooncol. 2011;104(2):565-72.[PMID:21234642](レベルⅢ)
|
|
| 3) |
Oh SY, Lee SJ, Lee J, et al. Gastric leptomeningeal carcinomatosis:multi-center retrospective analysis of 54 cases. World J Gastroenterol. 2009;15(40):5086-90.[PMID:19860003](レベルⅢ)
|
|
| 4) |
Gani C, Müller AC, Eckert F, et al. Outcome after whole brain radiotherapy alone in intracranial leptomeningeal carcinomatosis from solid tumors. Strahlenther Onkol. 2012;188(2):148-53.[PMID:22231633](レベルⅢ)
|
|
| 5) |
Nakamura Y, Takahashi T, Tsuya A, et al. Prognostic factors and clinical outcome of patients with lung adenocarcinoma with carcinomatous meningitis. Anticancer Res. 2012;32(5):1811-6.[PMID:22593466](レベルⅢ)
|
|
| 6) |
Hermann B, Hültenschmidt B, Sautter-Bihl ML. Radiotherapy of the neuroaxis for palliative treatment of leptomeningeal carcinomatosis. Strahlenther Onkol. 2001;177(4):195-9.[PMID:11370554](レベルⅢ)
|
|
| 7) |
Chamberlain MC, Kormanik PA. Prognostic significance of 111indium-DTPA CSF flow studies in leptomeningeal metastases. Neurology. 1996;46(6):1674-7.[PMID:8649568](レベルⅢ)
|
|
| 8) |
Sperduto PW, Wang M, Robins HI, et al. A phase 3 trial of whole brain radiation therapy and stereotactic radiosurgery alone versus WBRT and SRS with temozolomide or erlotinib for non-small cell lung cancer and 1 to 3 brain metastases:Radiation Therapy Oncology Group 0320. Int J Radiat Oncol Biol Phys. 2013;85(5):1312-8.[PMID:23391814](レベルⅠb)
|
|
| 9) |
Lee SH, Kong DS, Seol HJ, et al. Ventriculoperitoneal shunt for hydrocephalus caused by central nervous system metastasis. J Neurooncol. 2011;104(2):545-51.[PMID:21274592](レベルⅢ)
|
|
| 10) |
Lin N, Dunn IF, Glantz M, et al. Benefit of ventriculoperitoneal cerebrospinal fluid shunting and intrathecal chemotherapy in neoplastic meningitis:a retrospective, case-controlled study. J Neurosurg. 2011;115(4):730-6.[PMID:21721878](レベルⅢ)
|
|
| 11) |
Omuro AM, Lallana EC, Bilsky MH, et al. Ventriculoperitoneal shunt in patients with leptomeningeal metastasis. Neurology. 2005;64(9):1625-7.[PMID:15883329](レベルⅢ)
|
|
| 12) |
Zada G, Chen TC. A novel method for administering intrathecal chemotherapy in patients with leptomeningeal metastases and shunted hydrocephalus:case report. Neurosurgery. 2010;67(3 Suppl Operative):onsE306-7. [PMID:20679917](レベルⅣ)
|
|
|
|

|

|

|
| |
| 頭蓋骨転移
|

|
| |
CQ5 頭蓋骨転移に対する治療はどう選択するのか?
|

|
| |
推奨1
症候性または近い将来に局所治療を必要とする頭蓋骨転移には,放射線治療を推奨する。(推奨度1B)
|
|

|
| |
推奨2
薬物療法に高感受性とされる腫瘍では,薬物療法を単独あるいは放射線治療と組み合わせて行うことを提案する。(推奨度2C)
|
|

|
| |
推奨3
全身の転移性骨腫瘍を有する患者に対して,あるいは骨関連事象(SRE)のリスクが高い頭蓋骨転移の場合,SREの発現を軽減するために,ビスホスホネート製剤(ゾレドロン酸)またはヒト型抗RANKL(NFκB活性化受容体リガンド)モノクローナル抗体薬(デノスマブ)の投与を推奨する。(推奨度1B)
|
|

|
| |
推奨4
外科治療は,脳神経症状の早急な解除,静脈洞閉塞の回避,整容,または病理診断を目的に,厳格な適応判断のもとに行うよう提案する。(推奨度2C)
|
|

|
| |
|
解説
|
| |
|
骨転移は,進行前立腺がんの90%,進行乳がんの70~80%,進行非小細胞肺がんの30~40%に発生する1)(レベルⅢ)。一般に,頭蓋骨転移は全身の骨転移に伴って出現する。特に頭蓋底への転移は,Laigle-Donadeyの279例の報告によると,前立腺がん(38.5%),次いで乳がん(20.5%)に多く,他にもさまざまながん種から転移する2)(レベルⅢ)。
頭蓋円蓋部への転移は,必ずしもQOLを低下させることはないが,骨からの硬膜への浸潤,上矢状・横静脈洞の閉塞の回避,ときに整容を目的として治療方針を検討する。一方,頭蓋底への転移は,脳神経障害,疼痛,頭蓋内圧亢進などによりQOLを低下させることが多く,迅速な診断と治療が必要である。頭蓋底転移の発見と診断には,Greenbergらによる5症候群の分類が有用である(表1)3)(レベルⅣ)。特に嚥下困難,複視,三叉神経痛や後頭後頸部の激痛は患者にとって重大な障害になる。これらの症状が出現したときは,MRIによって造影前T1強調画像と造影脂肪抑制T1強調画像とを比較して診断する4)(レベルⅢ)。X線撮影,骨条件CT,骨シンチグラフィも有用である。また,画像診断が困難な場合でも,上記のような症状が出現している場合には放射線治療を勧めてもよいとする意見もある2)。
|

|
| |
| 表1 頭蓋骨転移における腫瘍局在と臨床症候群(文献3より作成)
|
| Greenberg臨床症候群(腫瘍局在部位) |
症状・徴候 |
| 眼窩 |
眼窩上の頭痛,複視,眼球突出 |
| 傍鞍部 |
前頭部痛,複視 |
| 錐体骨前縁(ガッセル神経節) |
顔面感覚障害,非定型的顔面痛,外転神経麻痺,顔面神経麻痺 |
| 頸静脈孔 |
後頭部痛,嗄声,嚥下障害 |
| 後頭顆 |
後頭部痛(ときに激烈),構語障害 |
|
|

|
| |
症候性の骨転移に対する放射線治療の有効率は一般に50~80%と高く,特に疼痛の緩和に有効である5)(レベルⅠa)。また,症状の出現から速やかに開始されるほど効果は高い。症状出現から1カ月以内に放射線治療を開始した場合には87%の患者で症状が改善したが,3カ月を超えると25%にすぎなかったという報告がある6)(レベルⅣ)。定位放射線照射(stereotactic irradiation:STI)の適応は3 cm以下の病変,初期治療および術後残存病変や再発病変であり,奏効割合は65~90%と報告されている7)(レベルⅣ)。また,症状がない場合であっても静脈洞閉塞のリスクがある場合,急速に増大する病変によって重篤な症状が出現する可能性がある場合には,それらを回避するために放射線治療が勧められる。
頭蓋骨転移は,全身の骨転移の一部と捉え,それがQOLを低下させる場合には,それぞれの腫瘍の薬物療法感受性を根拠として,全身薬物療法すなわち化学療法や内分泌療法を行う。さらに,骨転移に特異的な薬物療法として,ビスホスホネート製剤(ゾレドロン酸)またはヒト型抗RANKL(NFκB活性化受容体リガンド)モノクローナル抗体薬(デノスマブ)の投与が行われる。前立腺がんと乳がんを除いた固形がんの患者を対象に,骨関連事象(skeletal related events:SRE)発生率と発生までの時間を指標として,ゾレドロン酸とプラセボの比較試験が行われている8)(レベルⅠb)。9カ月目までのSRE出現率はゾレドロン酸投与群で35~38%,プラセボ群では44%であり,SRE発生までの期間はゾレドロン酸によって有意に延長した。ゾレドロン酸とデノスマブを比較した3件のランダム化比較試験を統合した解析によると,ゾレドロン酸と比較してデノスマブはSREを17%減少させたと報告されている9)(レベルⅠb)。また,両薬剤のSRE予防効果には,過去のSREの有無,年齢を含む患者側の因子は関与していなかった。これらの結果より,転移性骨腫瘍を有する患者に対しては,骨転移による症状の有無にかかわらず,SREを予防する目的でゾレドロン酸またはデノスマブを投与するよう勧められる。
ゾレドロン酸をはじめとするビスホスホネート製剤に共通する副作用として,顎骨壊死と腎障害が知られている。顎骨壊死のリスク因子は,口腔内の感染症,直近の歯科的処置,長期間の投与などである。また,腎機能障害患者では血漿中濃度が増加するため,クレアチニンクリアランスに基づいて投与量を調整する。一方,デノスマブによる顎骨壊死の頻度も,ゾレドロン酸との比較試験の結果より,ゾレドロン酸と同程度と報告されている10)(レベルⅠa)。デノスマブは腎機能による投与量調整は不要であるが,臨床試験では重度の腎障害の患者は除外されており,腎障害患者への適応は慎重に判断する。さらに,低カルシウム血症予防のためにカルシウムとビタミンDの経口補充,カルシウム値のモニタリングが必須である11)(レベルⅠb)。ただし,ゾレドロン酸は点滴投与,デノスマブは皮下投与という投与法の違いがある。処方例として,① ゾレドロン酸4 mg,3~4週ごと点滴投与,② デノスマブ120 mg,4週ごと皮下投与,などが考えられる。
外科治療の適応は,期待できる治療効果,侵襲性,予後などを慎重に検討して決定する。腫瘍摘出の際には,十分なサージカルマージン(安全域)を確保したうえで,また硬膜や皮膚に浸潤する場合は同時に切除する。円蓋部の転移に対する外科治療の適応には,神経学的な異常を伴う,大きな骨破壊や硬膜への浸潤がある,腫瘤が疼痛を伴う,転移が単発である,病理診断の必要があるときなどが挙げられる12)(レベルⅢ)。一方,特にQOLを低下させることの多い頭蓋底への転移では,原発がんの組織型,頭蓋内への進展度,サージカルマージンの状況が治療成績に影響したと報告されている13)(レベルⅢ)。Chamounらは,頭蓋底への転移に対して外科治療を行った27例のうち,全摘出が可能であった症例は59%に留まったことから,外科治療による根治は困難であり,その適応は少数例にすぎないため,より厳格な適応判断が必要であるとしている14)(レベルⅢ)。なお,高齢者における外科治療の安全性については,悪性腫瘍の治療目的で頭蓋顔面手術を受けた症例の解析において,70歳以上の170例では70歳未満の1,096例と比較して,外科治療に関係した死亡率(それぞれ9%,3%)および合併症発生率(それぞれ42%,32%)は有意に高かった15)(レベルⅢ)。
以上より,外科治療は,比較的若年で,他に放射線治療や薬物療法によって治療目的を達成できない場合に限り,厳格な適応判断のもとに行うべきであろう。
|

|
| |
| 文献 |
| 1) |
Coleman RE. Clinical features of metastatic bone disease and risk of skeletal morbidity. Clin Cancer Res. 2006;12(20 Pt 2):6243s-9s.[PMID:17062708](レベルⅢ)
|
|
| 2) |
Laigle-Donadey F, Taillibert S, Martin-Duverneuil N, et al. Skull-base metastases. J Neurooncol. 2005;75(1):63-9.[PMID:16215817](レベルⅢ)
|
|
| 3) |
Greenberg HS, Deck MD, Vikram B, et al. Metastasis to the base of the skull:clinical findings in 43 patients. Neurology. 1981;31(5):530-7.[PMID:6972014](レベルⅣ)
|
|
| 4) |
Mitsuya K, Nakasu Y, Horiguchi S, et al. Metastatic skull tumors:MRI features and a new conventional classification. J Neurooncol. 2011;104(1):239-45.[PMID:21110218](レベルⅢ)
|
|
| 5) |
Chow E, Harris K, Fan G, et al. Palliative radiotherapy trials for bone metastases:a systematic review. J Clin Oncol. 2007;25(11):1423-36.[PMID:17416863](レベルⅠa)
|
|
| 6) |
Vikram B, Chu FC. Radiation therapy for metastases to the base of the skull. Radiology. 1979;130(2):465-8.[PMID:104361](レベルⅣ)
|
|
| 7) |
Chamoun RB, DeMonte F. Management of skull base metastases. Neurosurg Clin N Am. 2011;22(1):61-6, vi-ii.[PMID:21109150](レベルⅣ)
|
|
| 8) |
Rosen LS, Gordon D, Tchekmedyian S, et al. Zoledronic acid versus placebo in the treatment of skel-etal metastases in patients with lung cancer and other solid tumors:a phase III, double-blind, randomized trial--the Zoledronic Acid Lung Cancer and Other Solid Tumors Study Group. J Clin Oncol. 2003;21(16):3150-7.[PMID:12915606](レベルⅠb)
|
|
| 9) |
Lipton A, Fizazi K, Stopeck AT, et al. Superiority of denosumab to zoledronic acid for prevention of skeletal-related events:a combined analysis of 3 pivotal, randomised, phases 3 trials. Eur J Cancer. 2012;48(16):3082-92.[PMID:22975218](レベルⅠb)
|
|
| 10) |
Saad F, Brown JE, Van Poznak C, et al. Incidence, risk factors, and outcomes of osteonecrosis of the jaw:integrated analysis from three blinded active-controlled phase III trials in cancer patients with bone metastases. Ann Oncol. 2012;23(5):1341-7.[PMID:21986094](レベルⅠb)
|
|
| 11) |
Henry DH, Costa L, Goldwasser F, et al. Randomized, double-blind study of denosumab versus zoledronic acid in the treatment of bone metastases in patients with advanced cancer(excluding breast and prostate cancer)or multiple myeloma. J Clin Oncol. 2011;29(9):1125-32.[PMID:21343556](レベルⅠb)
|
|
| 12) |
Stark AM, Eichmann T, Mehdorn HM. Skull metastases:clinical features, differential diagnosis, and review of the literature. Surg Neurol. 2003;60(3):219-25;discussion 225-6.[PMID:12922038](レベルⅢ)
|
|
| 13) |
Patel SG, Singh B, Polluri A, et al. Craniofacial surgery for malignant skull base tumors:report of an international collaborative study. Cancer. 2003;98(6):1179-87.[PMID:12973841](レベルⅢ)
|
|
| 14) |
Chamoun RB, Suki D, DeMonte F. Surgical management of cranial base metastases. Neurosurgery. 2012;70(4):802-9;discussion 809-10.[PMID:21937928](レベルⅢ)
|
|
| 15) |
Ganly I, Patel SG, Singh B, et al. Craniofacial resection for malignant tumors involving the skull base in the elderly:an international collaborative study. Cancer. 2011;117(3):563-71.[PMID:20872881](レベルⅢ)
|
|

|

|

|
| ステロイド・浸透圧利尿薬
|

|
| |
CQ6 転移性脳腫瘍に対するステロイドや浸透圧利尿薬はどう使用するのか?
|

|
| |
推奨
神経症状を呈する腫瘍周辺の浮腫に対しては,ステロイドや浸透圧利尿薬の使用を推奨する。(推奨度1B)
|
|

|
| |
解説
|
| |
転移性脳腫瘍では,腫瘍周辺の高度な浮腫のために神経症状を呈することがある。脳浮腫に対しては,鉱質コルチコイド作用の少ないデキサメタゾン,ベタメタゾンが一般的に使用され,さらに緊急時には浸透圧利尿薬も用いられる1)(レベルⅤ)。ステロイドの使用に際しては,消化管出血や糖尿病,易感染性などの合併症に注意しつつ,長期に使用することは避け,経過をみながら適宜漸減・中止を検討する。また,中枢神経系原発悪性リンパ腫が疑われる場合には,病理診断前のステロイドの使用は勧められない(「3章.中枢神経系原発悪性リンパ腫」CQ2-a参照)。一方,明らかな頭蓋内圧亢進や神経症状がない状態では,ステロイドや浸透圧利尿薬の使用は勧められない。
デキサメタゾンの投与量について明確なコンセンサスはないが,一般的には4~8 mg/日で開始されることが多い。頭蓋内圧亢進や意識障害を呈する場合には16 mg/日あるいはそれ以上の投与量も考慮する2)(レベルⅤ)。Vechtらは,Karnofsky performance status(KPS)80%以下の転移性脳腫瘍患者に対してデキサメタゾンを4,8,16 mg/日で開始し,それぞれ漸減しつつ7日あるいは28日間投与したところ,4 mg/日とそれ以上の投与量では効果に差がみられず,投与量が増えるにつれ副作用が増加したと報告している3)(レベルⅠb)。
転移性脳腫瘍の脳浮腫や頭蓋内圧亢進に対して浸透圧利尿薬が一般に使用されるが,その有用性を検討した臨床試験はない。浸透圧利尿薬の使用に際しては,濃グリセリン・果糖注射液やD-マンニトールの使用による電解質異常,利尿による脱水と腎機能障害,中止後の反跳現象に注意する。また,漫然と長期に使用することは避ける。
ステロイド,特にデキサメタゾンなどの糖質コルチコイドの使用に際しては,シトクロムP450の酵素誘導によりフェニトイン,フェノバルビタール,カルバマゼピンなどの血中薬物濃度が低下することがある点に注意する。逆に,これらの抗てんかん薬によっても酵素誘導され,ステロイドの効果が減弱することがある(本章CQ7参照)。
|

|
| |
| 文献 |
| 1) |
Ryken TC, McDermott M, Robinson PD, et al. The role of steroids in the management of brain metastases:a systematic review and evidence-based clinical practice guideline. J Neurooncol. 2010;96(1):103-14.[PMID:19957014](レベルⅤ)
|
|
| 2) |
Soffietti R, Cornu P, Delattre JY, et al. EFNS Guidelines on diagnosis and treatment of brain metastases:report of an EFNS Task Force. Eur J Neurol. 2006;13(7):674-81.[PMID:16834697](レベルⅤ)
|
|
| 3) |
Vecht CJ, Hovestadt A, Verbiest HB, et al. Does-effect relationship of dexamethasone on Karnofsky performance in metastatic brain tumors:a randomized study of doses of 4, 8, and 16 mg per day. Neurology. 1994;44(4):675-80.[PMID:8164824](レベルⅠb)
|
|

|

|
| 抗てんかん薬
|

|
| |
CQ7 転移性脳腫瘍に対する抗てんかん薬はどう使用するのか?
|

|
| |
推奨1
てんかん発作の既往がある場合に,使用することを推奨する。(推奨度1C)
|
|

|
| |
推奨2
てんかん発作の既往のない場合は,腫瘍摘出術および定位放射線照射の周術期などを除き,予防的な抗てんかん薬は使用しないことを提案する。(推奨度2C)
|
|

|
| |
推奨3
抗てんかん薬を使用する場合は,抗がん薬を含めた他剤との薬物相互作用に注意することを推奨する。(推奨度1C)
|
|

|
| |
解説
|
| |
てんかん発作の既往がある転移性脳腫瘍に対しては,抗てんかん薬を使用することが勧められる。しかし,てんかん発作の既往のない場合,予防的な抗てんかん薬の使用が有効であるという十分なエビデンスはなく,一般には抗てんかん薬の投与は行わない1)(レベルⅤ)。ただし,広範な浮腫を伴うテント上病変など,てんかん発作を伴うことが強く予想される場合には予防的な抗てんかん薬が用いられることもある。Forsythらは,原発性40例および転移性60例(計100例)の脳腫瘍患者を対象に抗てんかん薬の発作抑制効果についてランダム化比較試験を行ったが,全体および転移性だけのサブグループ解析のいずれにおいても有意差は認められなかった2)(レベルⅠb)。米国神経学会(American Academy of Neurology:AAN)は,4つのランダム化比較試験のメタアナリシスにおいても抗てんかん薬による発作抑制効果は認められていないことから,抗てんかん薬の使用は推奨していない3)(レベルⅠa)。さらに,2008年のThe Cochrane Database of Systematic Reviewにおいても脳腫瘍患者に対する予防的な抗てんかん薬の使用による発作抑制効果は示されておらず,一方,副作用は有意に増加していた4)(レベルⅠa)。ただし,これらの結果は,抗てんかん薬としてフェニトイン,フェノバルビタール,バルプロ酸を使用した臨床試験である点に注意が必要である。
抗てんかん薬を使用する場合には,薬物相互作用,特に薬物代謝酵素であるシトクロムP450(CYP)の酵素誘導に注意が必要である(表1)5-7)(いずれもレベルⅤ)。すなわち,フェノバルビタールやカルバマゼピン,フェニトインなど一部の抗てんかん薬を長期間使用すると酵素誘導によってCYP活性が増強するため,CYPによる薬物代謝を受けるパクリタキセルや塩酸イリノテカンなどの殺細胞性抗がん薬,あるいはイマチニブ,ゲフィチニブ,テムシロリムスなどの分子標的治療薬の血中薬物濃度が低下し,ときに薬物効果にも影響することがある。また,デキサメタゾンの長期使用によってもCYP3A4の酵素誘導が起こることが知られている。新規の抗てんかん薬であるレベチラセタムやガバペンチンは,薬物代謝酵素の誘導が少なく,臨床において問題となるような薬物相互作用が少ないという特徴を持つが,薬物療法時の相互作用のデータは乏しい。
|

|
| |
| 表1 抗てんかん薬のシトクロムP450への影響(文献7より作成)
|
| 薬物相互作用への影響 |
抗てんかん薬 |
| 酵素誘導あり |
カルバマゼピン,フェニトイン,フェノバルビタール,プリミドン |
| 酵素阻害あり |
バルプロ酸 |
| 問題となる相互作用はなし |
ラモトリギン,レベチラセタム,トピラマート,ゾニサミド,ガバペンチン,プレガバリン |
|
|

|
| |
| 文献 |
| 1) |
|
|
| 2) |
Forsyth PA, Weaver S, Fulton D, et al. Prophylactic anticonvulsants in patients with brain tumor. Can J Neurosci. 2003;30(2):106-12.[PMID:12774949](レベルⅠb)
|
|
| 3) |
Glantz MJ, Cole BF, Forsyth PA, et al. Practice parameter:anticonvulsant prophylaxis in patients with newly diagnosed brain tumors. Report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2000;54(10):1886-93.[PMID:10822423](レベルⅠa)
|
|
| 4) |
Tremont-Lukats IW, Ratilal BO, Armstrong T, et al. Antiepileptic drugs for preventing seizures in people with brain tumors. Cochrane Database Syst Rev. 2008;2008(2):CD004424.[PMID:18425902](レベルⅠa)
|
|
| 5) |
Yap KY, Chui WK, Chan A. Drug interactions between chemotherapeutic regimens and antiepileptics. Clin Ther. 2008;30(8):1385-407.[PMID:18803983](レベルⅤ)
|
|
| 6) |
Kargiotis O, Markoula S, Kyritsis AP. Epilepsy in the cancer patient. Cancer Chemother Pharmacol. 2011;67(3):489-501.[PMID:21305288](レベルⅤ)
|
|
| 7) |
Sperling MR, Ko J. Seizures and brain tumors. Semin Oncol. 2006;33(3):333-41.[PMID:16769422](レベルⅤ)
|
|

|

|

|
|

|
| |

|
|

|
|

|
|



