| 1 本ガイドラインの目的
|

|
| |
|
中枢神経系原発悪性リンパ腫(primary central nervous system lymphoma: PCNSL)に罹患している個々の症例において,適切な治療方針を検討するうえで必要となる重要な臨床事項を臨床的疑問(clinical question:CQ)として提示し,本ガイドライン作成時点でのエビデンスに基づく推奨事項を述べる。
|

|
| 2 対象患者
|

|
| |
|
中枢神経系原発悪性リンパ腫に罹患した成人患者。
|

|
| 3 利用対象者
|

|
| |
|
脳腫瘍診療に従事する医師。
|

|
| 4 中枢神経系原発悪性リンパ腫(PCNSL)の概括
|

|
| |
|
| |
1. |
PCNSLの定義および疫学
PCNSLは,診断時に中枢神経系外に他の病巣を認めない中枢神経系に限局した節外性リンパ腫を指し,他臓器リンパ腫由来の二次性中枢神経系リンパ腫は含まない。PCNSLは近年増加傾向にあり,Report of Brain Tumor Registry of Japan(2005-2008)14th Editionによると全原発性脳腫瘍の4.9%(814人/4年)を占め1) 、1984-2000年の3.1%、2001-2004年の3.5%(475人/4年)と比べて患者数、割合ともに増加傾向を示している1, 2) 。他の原発性脳腫瘍との発生頻度の比較では、PCNSLは神経膠腫(29%)、髄膜腫(24%)、下垂体腺腫(17%)、神経鞘腫(9%)に次いで、米国と同様第5位の頻度である。PCNSLの年間罹患数は、本邦では2016年で1,153人(全国がん登録)3) 、米国では2011-2014年のデータで年間平均1,517人であった4) 。また、全節外性リンパ腫の4-6%が中枢神経系に発生するとも報告されている5) 。95%以上のPCNSLは非ホジキンリンパ腫(non-Hodgkin lymphoma:NHL)で、組織型はB細胞リンパ腫が92%、T細胞リンパ腫は2%とほとんどをB細胞リンパ腫(ほとんどが,びまん性大細胞型B細胞リンパ腫,diffuse large B-cell lymphoma:DLBCL)が占める。男女比はほぼ同数(男性57%)で、年齢中央値は71歳(米国は66歳)、60歳以上が占める割合が82.1%と高齢者に好発する3) 。欧米ではAIDSに関連して発症する率が高くなっているが,本邦では少なく,ほとんどが免疫不全を合併しない症例である。
|
| |
2. |
PCNSLの分子病態の特徴
近年の包括的遺伝子・エピジネティック解析の結果、PCNSLでは特徴的な高頻度の体細胞性遺伝子変異や異常な体細胞超変異(somatic hypermutation; SHM)、遺伝子構造変化、発現異常、メチル化などが報告された6-8)。その中で機能活性化をもたらすB細胞受容体(B-cell receptor; BCR)経路のCD79B変異(41 - 83%)、CARD11変異(10 – 30%)と、Toll-like receptor(TLR)の中心に位置するMYD88変異(58 - 85%)が極めて高頻度で認められ、これらの経路が集約するNF-kBシグナルの異常活性化が、PCNSLにおける重要かつ中心的変異と考えられている9)。また、最近のDLBCLにおいて提唱されている分子分類では、MCD/C5サブタイプに属する10)。ブルトン型チロシンキナーゼ(Bruton’s tyrosine kinase; BTK)はBCRおよびTLRからNF-kBに通ずる経路に位置する中間キナーゼであり、PCNSLを含めたリンパ系悪性腫瘍に対する標的分子として阻害薬が開発されている9, 11, 12)。その他BCR経路の下流にあるPI3K/AKT/mTOR経路の阻害薬も注目されている。また免疫チェックポイントに関与するPDL1/L2遺伝子座の増幅や遺伝子再配列が報告されている7, 8)。
|
| |
3. |
予後規定因子
PCNSLにおける予後規定因子としては,これまで年齢とperformance status (PS)の重要性が指摘されてきている。Radiation Therapy Oncology Group(RTOG)による最初の前方視的臨床試験(RTOG 83-15試験)において,年齢とKarnofsky PS(KPS)が独立した予後因子として報告された13)。その後,前方視的第II相試験で,これらの因子は常に予後因子として抽出されている14-16)。またCorryらも,62例の免疫不全のないPCNSLに対する後方視的解析で,年齢60歳未満,WHO PSが1以下のみが独立した有意な予後因子であったと報告している17)。
Ferreriらは,多国48施設から378例のHIV陰性PCNSLを集積し,解析データが揃う105例をもとに予後因子解析を行った。その結果,①年齢(60歳より高齢)[p = 0.0001,オッズ比(odds ratio:OR) = 1.02],②PS(WHO PS 2以上)(p = 0.001,(odds ratio:(OR) = 1.02],),③血清LDH値(高値)(p = 0.05,OR = 1.41),④髄液蛋白濃度(高値)(p = 0.03,OR = 1.71),⑤深部脳病巣(脳室周囲,大脳基底核,脳幹,小脳)(p = 0.007,OR = 1.45)の5項目が独立した有意な予後不良因子として抽出された18, 19)。さらに,これら5項目を陽性の場合に各1点として合計した総点数を0~1点の群(予後良好群),2~3点の群(予後中間群),4~5点の群(予後不良群)の3群に分類するInternational Extranodal Lymphoma Study Group (IELSG) scoring systemを提唱した。2年生存割合は,順に80%±8%,48%±7%,15%±7%(p = 0.00001)と有意に差が認められた18)。
その後,Memorial Sloan Kettering Cancer Center(MSKCC)のAbreyらが,より簡便な予後分類システムとして,年齢とPSのみからなるrecursive partitioning analysis(RPA) scoring systemを提唱しており,連続338例のPCNSL症例中282例のデータを用いて予後因子を解析し,クラス1(50歳未満),クラス2(50歳以上かつKPS 70%以上),クラス3(50歳以上かつKPS 70%未満)の3群に分類した20)。生存期間中央値はクラス1,2,3で各8.5年,3.2年,1.1年(p<0.001),無失敗生存期間(failure-free survival:FFS)は各2.0年,1.8年,0.6年(p<0.001),無失敗生存期間(failure-free survival:FFS)と群間で有意な差が認められた。RTOGによる前方視的臨床試験の152例の治療データを用いた検証的解析でも,同様にp<0.001の有意水準で予後との相関が示された。一方,同じ症例を上記IELSG scoring systemを用いて分類し,予後との相関を解析すると,0〜1点群と2〜5点群間のみ有意差が認められた(p=0.006)。IELSG scoring systemでは一部の症例で髄液所見や血清LDHのデータが欠損しており,十分な解析ができなかった点と,観察期間の中央値が2年と短かった点が影響している可能性が指摘された20)。
今後は,このような予後因子スコアを使用することで,より均てん化した臨床試験をデザインすることが望ましい。
|
| |
4. |
PCNSLの治療前評価と治療効果判定
治療開始前にPCNSLの進行度や進達度を評価し,また治療後にその治療効果を判定するためには,国際的な基準を用いることが望ましい。International PCNSL Collaborative Group (IPCG)が2005年に取りまとめたPCNSLに対する神経所見を基にした治療効果判定(評価)基準には,①眼科的精査(スリットランプ検査含む),②ガドリニウム造影脳MRI,および安全に施行できる際に腰椎穿刺による脳脊髄液(cerebro-spinal fluid:CSF)採取(悪性細胞の検出),③脊髄症状のある症例に対しての脊髄MRI,④全身性悪性リンパ腫の除外のための臨床諸検査(リンパ節,体幹・骨盤CT,骨髄検査,精巣検査)⑤HIV感染の有無,が含まれ,表1のように判定される21)。適切な治療方針の選択,治療効果の判定や臨床試験の登録には,これらの腫瘍関連因子の精査・記録が科学的な解析には必須であり,日常診療においても,可能な限り施行すべきである。また,全身病変の検索にはPET検査も有用性が報告されている22)。全身性NHLに対する病期分類法とは異なることに留意する必要がある。なお,治療効果判定は原則としてガドリニウム造影脳MRIにて行う。
また,PCNSLの治療経過上重要な晩発性認知機能障害を評価するうえで,治療前の認知機能の客観的な評価が必須であり,治療前のPSと神経症状・認知機能を記録することが必要である。PSの評価基準としては,通常KPSが使用される(表2)。また,認知機能評価の基準としては,IPCGでも推奨されているMini Mental State Examination(MMSE)を使用することが望ましいが,長谷川式スケール(HDS-R)を代替スケールとして用いてもよい。
|
|

|
| |
|
| |
|
表1.IPCGによるPCNSL治療効果判定(評価)基準
|
| |
|
| 効果判定 |
腫瘍縮小効果 |
副腎皮質ステロイド |
眼所見 |
髄液細胞診 |
| CR |
造影病巣なし |
なし |
正常 |
陰性 |
| CRu |
造影病巣なし |
あり・なし |
正常 |
陰性 |
| CRu |
微細な異常所見 |
あり・なし |
微小RPE異常 |
陰性 |
| PR |
50%以上の造影病巣の縮小 |
問わない |
微小RPE異常または正常 |
陰性 |
| PR |
造影病巣なし |
問わない |
硝子体または網膜腫瘍細胞
浸潤の減少 |
遷変または疑い |
| PD |
25%以上の病巣増大 |
問わない |
再発または新規眼病巣出現 |
再発または陽性 |
| PD |
中枢神経系あるいは
全身性新病変 |
|
|
|
|
| |
|
註:PDは各項目のいずれかが認められた場合に判定される。
CR:complete response, CRu:unconfirmed complete response, RPE:retinal pigment epithelium,
PR:partial response, PD:progressive disease
(文献21より引用)
|
|

|
| |
|
| |
|
表2.Karnofsky Performance Status(KPS)
|
| |
|
| KPS |
状 態 |
| 100% |
正常。自他覚症状がない。 |
| 90 |
通常の活動ができる。軽度の自他覚症状がある。 |
| 80 |
通常の活動に努力が要る。中等度の自他覚症状がある。 |
| 70 |
自分の身の回りのことはできる。通常の活動や活動的な作業はできない。 |
| 60 |
時に介助が必要だが,自分でやりたいことの大部分はできる。 |
| 50 |
かなりの介助と頻回の医療ケアが必要。 |
| 40 |
活動にかなりの障害があり,特別なケアや介助が必要。 |
| 30 |
高度に活動が障害され,入院が必要。死が迫った状態ではない。 |
| 20 |
非常に重篤で入院が必要。死が迫った状態ではない。 |
| 10 |
死が迫っており,死に至る経過が急速に進行している。 |
|
| |
|
出典:Karnofsy DA, et al. Cancer. 1948;1(4):634-56.
(National Cancer Institute – Common Toxicity Criteria (NCI-CTC Version 2.0, April 30, 1999) 日本語訳JCOG版-第2版より引用。JCOGホームページ https://jcog.jp/ )
|
|
|

|
| |
|
| |
5. |
治療法
PCNSLの治療の原則は,生検術による腫瘍組織からの病理診断確定の後,大量メトトレキサート(high dose methotrexate:HD-MTX)療法を基盤とする多剤併用薬物療法による寛解導入療法を行い、寛解導入療法で完全奏効(complete response:CR)が得られた場合、引き続き地固め療法を行う。本邦では保険診療下で実施可能なR-MPV(リツキシマブ-MTX+プロカルバジン+ビンクリスチン)による寛解導入療法が広く行われる。地固め療法には、薬物療法、全脳照射による放射線治療、あるいはその併用が用いられるが、特に高齢者において遅発性中枢神経障害の発症のリスクである全脳照射を回避、あるいは照射線量を減量した照射が選択される。若年患者には、チオテパを含む大量化学療法を自家幹細胞移植支援の下実施可能となっており、地固め療法として用いられることがある。
本ガイドラインでは,PCNSLに対する治療について,次項のアルゴリズムに沿って,まず初発時治療について,その概要,寛解導入療法としての多剤併用療法,リツキシマブ,放射線治療を論じた後,自家幹細胞移植を用いた大量化学療法,維持療法,髄注化学療法について述べる。さらに重要なCQとして,本疾患の多くの患者が含まれる高齢者への治療,ときに合併する眼内リンパ腫について検討した。最後に確立した治療法が未だない再発時の治療について論じた。
これらの治療法についての詳細と文献は,各CQの記載を参照のこと。
|
| |
6. |
遅発性中枢神経障害
PCNSLの半数は60歳以上であり,高次脳機能障害や遅発性治療関連神経毒性(白質脳症)の影響を極めて受けやすい対象である。特に,60歳以上のHD-MTX療法と全脳照射を施行した症例群は最もハイリスク群とみなされている。AbreyらはHD-MTX療法+メトトレキサート(MTX)髄注+全脳照射40 Gy+局所照射14.4 Gy+大量シタラビン(high dose cytarabine:HD-AraC)療法を行ったPCNSL症例のうち,60歳以上の症例で有意に遅発性神経毒性の発生リスクが高かった(p<0.0001)と報告している23)。したがって,遅発性中枢神経障害の有無や程度の評価は極めて重要で,克服しなくてはならない課題である。
一方で,高い総放射線線量,MTX髄注治療の併用,HD-MTX療法そのものや,照射後の化学療法の追加などのいずれも神経障害を惹起しうる治療法であり,遅発性神経毒性の原因検索とその回避については慎重な考察を要する。ハイリスクの高齢者の定義としては,60歳以上あるいは70歳以上など,各報告で統一されていない。また,高齢者に遅発性神経毒性の発生リスクが高いとしても,高齢者の治療成績が十分ではなく,頭蓋内病変の制御が悪ければ,必然的に認知機能や生活の質(quality of life:QOL)も低下するという面も,考慮する必要がある。
神経毒性の症状は,主として急速に進行する皮質下認知障害で,精神運動障害,遂行・記銘力障害,行動異常,歩行失調,失禁などが含まれる24)。このような症状や障害を科学的に評価していくためには,系統的認知機能評価法の導入が必須であり,Correaらは認知機能の4つの主領域(注意,遂行機能,記銘力,精神運動速度)を含む5つの標準化された神経精神テストとQOL質問票を提唱している25)。今後の臨床試験のみならず,日常診療においても可能な範囲でこのような評価法を我が国でも進めて行くことが望ましい。
|
|

|
| 5 診療アルゴリズム
|

|
| |
|
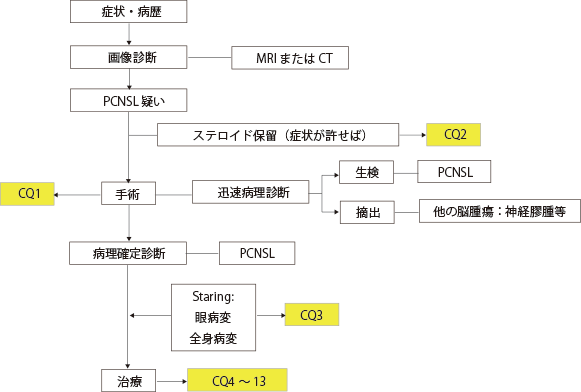
|

|
| |
|
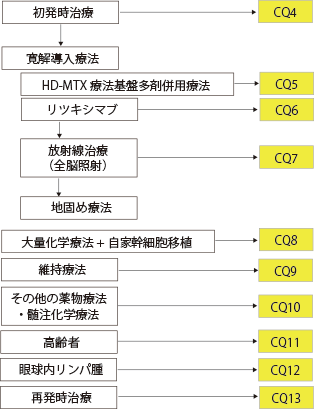
|

|
| 6 CQと推奨の一覧
|

|
| |
|
| Clinical Question |
推奨 |
推奨度(投票結果) |
CQ1
(手術)
|
PCNSLの診療における手術の位置づけは? |
推奨 PCNSLに対しては,原則として手術による組織診断を推奨する。 |
1A
(8/8) |
CQ2-a
(ステロイド療法) |
診断確定前にステロイド療法は施行するべきか? |
推奨 生検術前のステロイド使用は,可能な限り投与を控えることを推奨する。ステロイドによる標的病変の縮小が高頻度に生じるため,手術時に生検的中率が低下するリスクがあるため。 |
1B
(8/8) |
CQ2-b
(ステロイド療法) |
診断確定後のステロイド療法の位置づけは? |
推奨1 診断確定後のステロイド使用を提案する。PCNSLに対するステロイド療法は,一過性の腫瘍縮小効果が認められることが多く,また,症状緩和目的に使用されることも多いため。 |
2C
(8/8) |
| 推奨2 ステロイドは治癒的効果に乏しいため,治癒目的に単独使用を行わないことを推奨する。 |
1B
(8/8) |
CQ3
(ステージング:眼科検査,全身検査) |
脳リンパ腫に対して眼科的検査,全身精査は必要か? |
推奨 中枢神経系リンパ腫では,眼内リンパ腫や全身性悪性リンパ腫を合併することがあり,その有無を精査することを推奨する。 |
1A
(8/8) |
CQ4
(寛解導入療法:①初発時治療) |
PCNSLに対してどのような初発時治療が推奨されるか? |
推奨1 PCNSLに対する治療では,大量メトトレキサート(HD-MTX)療法を基盤とする薬物療法による寛解導入療法を行うことを推奨する。 |
1A
(8/8) |
| 推奨2 寛解導入療法後に完全奏効が得られた場合、年齢を考慮したうえで薬物療法、全脳照射による放射線治療、あるいはその併用による地固め療法を行うことを推奨する。 |
1A
(8/8) |
CQ5
(寛解導入療法:②多剤併用療法) |
PCNSLに対する寛解導入療法として多剤併用療法が推奨されるか? |
推奨1 PCNSLに対する寛解導入療法として,大量メトトレキサート(HD-MTX)を含む多剤併用薬剤療法を推奨する。 |
1A
(8/8) |
CQ6
(寛解導入療法:③リツキシマブ) |
PCNSLに対してリツキシマブの併用は推奨されるか? |
推奨 CD20に対するキメラモノクローナル抗体リツキシマブは,大量メトトレキサート(HD-MTX)基盤化学療法に併用することを弱く推奨する。 |
2B
(8/8) |
CQ7-a
(放射線治療の意義と実際) |
PCNSLに対する放射線治療ではどのような照射野が推奨されるか? |
推奨 照射野は眼球進展がない症例では眼球後半部を含んだ全脳を推奨する。眼球進展がある症例では全眼球を含んだ全脳を推奨する。 |
1A
(8/8) |
CQ7-b
(放射線治療の意義と実際) |
PCNSLに対する放射線治療ではどのような照射線量が推奨されるか? |
推奨 照射線量は23.4~50 Gy(1回線量1.5~2.0 Gy)を推奨する。ただし眼球への線量は30~36 Gy程度に留める。 |
1A
(8/8) |
| ①寛解導入療法CR後の地固め照射 |
①大量メトトレキサート(HD-MTX)を基盤とする寛解導入療法CR後の地固め照射では全脳に対して23.4~36 Gy(1回線量1.5~2.0 Gy)を推奨する。 |
1B
(8/8) |
| ②寛解導入療法PR以下の際や,再発時の救済照射 |
②HD-MTXを基盤とする寛解導入療法PR以下の場合には,全脳に対して30~45 Gy(1回線量1.5~2.0 Gy),腫瘍床に対しては総線量36~45 Gy程度の照射を推奨する。 |
1B
(8/8) |
| ③薬物療法不適応の際の代替治療としての照射 |
③HD-MTXを基盤とする寛解導入療法が適応にならない場合には,全脳に対して30~50 Gy(1回線量1.5~2.0 Gy),腫瘍床に対する総線量は40~50 Gyを推奨する。 |
1A
(8/8) |
| ④緩和照射の場合 |
④緩和照射の場合は,全脳に対して30~36 Gy程度(1回線量2.5~3.0 Gy)を推奨する。 |
1C
(8/8) |
CQ8
(大量化学療法) |
CNSLに対して自家幹細胞移植を伴う大量化学療法は推奨されるか? |
推奨1 65歳以下の初発PCNSLに対して大量メトトレキサート(HD-MTX)を基盤とする寛解導入化学療法の後の地固め療法として,自家幹細胞移植併用大量化学療法を提案する。 |
2C
(2Cx4/2Bx2/棄権2) |
| 推奨2 再発PCNSLに対する治療法として,殺細胞薬に対する感受性を有していれば自家幹細胞移植併用大量化学療法を提案する。 |
2C
(2Cx4/2Bx2/棄権2) |
CQ9
(維持療法) |
寛解導入後の維持療法は推奨されるか? |
推奨1 寛解導入後に、高齢者あるいは患者の状態に応じ地固め療法の代わりに、行うことを提案する。 |
2C
(8/8) |
| 推奨2 寛解導入・地固め療法が完遂された場合には、一般臨床としては行わないことを提案する。 |
2C
(8/8) |
CQ10
(髄注療法) |
PCNSLに対する抗がん薬の髄注療法は推奨されるか? |
推奨1 診断時の髄液細胞診が陰性の症例では髄注を行わないことを推奨する。 |
1B
(8/8) |
| 推奨2 診断時の髄液細胞診が陽性の症例では髄注を行うことを提案する。 |
2C
(8/8) |
CQ11
(高齢者治療) |
高齢者PCNSLに対してどのような治療法が推奨されるか? |
推奨 遅発性中枢神経障害の発生を軽減するため,高齢者における初発時の治療として,大量メトトレキサート(HD-MTX)療法を基盤とした導入化学療法後完全奏効(CR)となった症例については,全脳照射を待機した治療法を推奨する。 |
1B
(8/8) |
CQ12
(VRL治療法) |
眼内リンパ腫にはどのような治療法があるか? |
推奨1 眼内リンパ腫の眼内病変は,放射線照射を提案する。 |
1C
(8/8) |
| 推奨2 眼内リンパ腫の眼内病変には,メトトレキサート(MTX)の硝子体注射を提案する(保険適用外)。 |
1C
(8/8) |
CQ13
(再発治療) |
再発PCNSLに対し,どのような治療法が推奨されるか? |
推奨1 大量メトトレキサート(HD-MTX)療法を含む初期治療により長期間の奏効が得られた患者では,HD-MTX療法を含む治療を提案する。 |
2C
(8/8) |
| 推奨2 再発・難治性の患者では、チラブルチニブ単独療法を弱く推奨する。 |
2B
(8/8) |
| 推奨3 初回治療で全脳照射を行っていない場合,もしくは追加照射が可能な場合には再発時に全脳照射を弱く推奨する。 |
2B
(2Bx6/2Cx2) |
|
| |
|
(注:推奨度の投票は、PCNSLガイドライン委員および拡大ガイドライン委員会委員長で行った(賛成人数/全投票人数)) |

|
| 7 ガイドライン統括委員会
|

|
| |
|
本ガイドラインの作成にあたり、特定非営利活動法人 日本脳腫瘍学会脳腫瘍診療ガイドライン拡大委員会はガイドライン統括委員会の役割を果たしている。日本脳腫瘍学会脳腫瘍診療ガイドライン拡大委員会の構成委員と所属は共通項目参照。
|

|
| 8 中枢神経系原発悪性リンパ腫ガイドライン改訂ワーキンググループ(第3版作成時)
|

|
| |
|
|
| |
|
| 氏名 |
所属機関/専門分野 |
作成上の役割 |
| 青山 英史 |
北海道大学大学院医学研究院 放射線治療学教室 |
委員 |
| 石澤 賢一史 |
山形大学医学部 内科学第三講座/血液内科 |
協力委員 |
| 伊豆津 宏二 |
国立がん研究センター中央病院 血液腫瘍科/血液内科 |
協力委員 |
| 鈴木 茂伸 |
国立がん研究センター中央病院 眼腫瘍科/眼科 |
協力委員 |
| 中洲 庸子 |
滋賀医科大学 脳神経外科/脳神経外科 |
委員 |
| 永根 基雄 |
杏林大学医学部 脳神経外科/脳神経外科 |
委員長 |
| 三島 一彦 |
埼玉医科大学国際医療センター 脳脊髄腫瘍科/脳神経外科 |
委員 |
|

|
| 9 利益相反
|

|
| |
|
特定非営利活動法人 日本脳腫瘍学会脳腫瘍診療ガイドライン拡大委員会の構成委員、ガイドライン改訂ワーキンググループ委員の利益相反は別に開示する。
|

|
| 10 改訂予定
|

|
| |
|
2026年3月に改訂を行う予定である。
|

|
| 11 文献検索
|

|
| |
|
第2版作成時の検索日以降の,2017年4月から2021年4月の時点までの論文を対象とした。
PubMed/MEDLINEにて,c (Central Nervous System Neoplasms[MH] AND Lymphoma[MH]) OR ((PCNSL[TIAB] OR "primary central nervous system lymphoma" [TIAB] OR CNS[TIAB] OR (primary[TIAB] AND brain[tiab] AND lymphoma[TIAB]) NOT MEDLINE[SB])) AND (2017/4/01[PDAT]:2021/04/30[PDAT]) を検索式として検索し,約7,000件の論文を抽出した。そこから,各clinical questionに対して,適切な検索式を掛け合わせ,該当する論文を選出した。そのうえでエビデンスのあるまたは臨床上重要な情報を提供すると考えられた論文を抽出し,エビデンスレベル分類と推奨グレード分類から評価した。
なお,重要な文献を構造化抄録に抽出した(構造化抄録のある文献は,本文文献リストにて,著者名の前に●を添付)。
|

|
| |
|
| ◆文献(第3版分)(○:本改訂にて追加された文献-11件) |
| 1) |
The Commettee of Brain Tumor Registry of Japan. Report of Brain Tumor Registry of Japan (2005-2008) 14th Edition. Neurol Med Chir (Tokyo). 2017;57(Supplement 1):9-102.
|
|
| 2) |
○The Commettee of Brain Tumor Registry of Japan. Report of Brain Tumor Registry of Japan (2001-2004) 13th Edition. Neurol Med Chir (Tokyo). 2014;54(Supplement 1):9-102. |
|
| 3) |
○成田善孝. 脳腫瘍の分類と疫学. 日本臨床. 2021;79(Supplement 1):187-193.
|
|
| 4) |
○Ostrom QT, Gittleman H, Truitt G, et al. CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2011-2015. Neuro Oncol. 2018;20(suppl_4):iv1-iv86
https://www.ncbi.nlm.nih.gov/pubmed/30445539.
|
|
| 5) |
○Deckert M, Paulus W, Kluin PM, et al., editors. Lymphomas. Revised 4th Edition ed. Lyon: IARC Press; 2016.
|
|
| 6) |
○Fukumura K, Kawazu M, Kojima S, et al. Genomic characterization of primary central nervous system lymphoma. Acta Neuropathol. 2016;131(6):865-875
https://www.ncbi.nlm.nih.gov/pubmed/26757737.
|
|
| 7) |
○Chapuy B, Roemer MG, Stewart C, et al. Targetable genetic features of primary testicular and primary central nervous system lymphomas. Blood. 2016;127(7):869-881
https://www.ncbi.nlm.nih.gov/pubmed/26702065.
|
|
| 8) |
○Nayyar N, White MD, Gill CM, et al. MYD88 L265P mutation and CDKN2A loss are early mutational events in primary central nervous system diffuse large B-cell lymphomas. Blood Adv. 2019;3(3):375-383
https://www.ncbi.nlm.nih.gov/pubmed/30723112.
|
|
| 9) |
○永根基雄. 中枢神経系原発びまん性大細胞型B細胞リンパ腫. 血液内科. 2020;80(5):623-635.
|
|
| 10) |
○Ennishi D, Hsi ED, Steidl C, et al. Toward a New Molecular Taxonomy of Diffuse Large B-cell Lymphoma. Cancer Discovery. 2020;10(9):1267-1281
https://www.ncbi.nlm.nih.gov/pubmed/32616477.
|
|
| 11) |
○Grommes C, Pastore A, Palaskas N, et al. Ibrutinib Unmasks Critical Role of Bruton Tyrosine Kinase in Primary CNS Lymphoma. Cancer Discovery. 2017;7(9):1018-1029
https://www.ncbi.nlm.nih.gov/pubmed/28619981.
|
|
| 12) |
○Grommes C, Nayak L, Tun HW, et al. Introduction of novel agents in the treatment of primary CNS lymphoma. Neuro Oncol. 2019;21(3):306-313
https://www.ncbi.nlm.nih.gov/pubmed/30423172.
|
|
| 13) |
Nelson DF, Martz KL, Bonner H, et al. Non-Hodgkin's lymphoma of the brain: can high dose, large volume radiation therapy improve survival? Report on a prospective trial by the Radiation Therapy Oncology Group (RTOG): RTOG 8315. Int J Radiat Oncol Biol Phys. 1992;23(1):9-17
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=1572835.
|
|
| 14) |
DeAngelis LM, Seiferheld W, Schold SC, et al. Combination chemotherapy and radiotherapy for primary central nervous system lymphoma: Radiation Therapy Oncology Group Study 93-10. J Clin Oncol. 2002;20(24):4643-4648
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=12488408.
|
|
| 15) |
O'Neill BP, O'Fallon JR, Earle JD, et al. Primary central nervous system non-Hodgkin's lymphoma: survival advantages with combined initial therapy? Int J Radiat Oncol Biol Phys. 1995;33(3):663-673
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=7558957.
|
|
| 16) |
Schultz C, Scott C, Sherman W, et al. Preirradiation chemotherapy with cyclophosphamide, doxorubicin, vincristine, and dexamethasone for primary CNS lymphomas: initial report of radiation therapy oncology group protocol 88-06. J Clin Oncol. 1996;14(2):556-564
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=8636771.
|
|
| 17) |
Corry J, Smith JG, Wirth A, et al. Primary central nervous system lymphoma: age and performance status are more important than treatment modality. Int J Radiat Oncol Biol Phys. 1998;41(3):615-620
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=9635710.
|
|
| 18) |
Ferreri AJ, Blay JY, Reni M, et al. Prognostic scoring system for primary CNS lymphomas: the International Extranodal Lymphoma Study Group experience. J Clin Oncol. 2003;21(2):266-272
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=12525518.
|
|
| 19) |
Ferreri AJ, Reni M. Prognostic factors in primary central nervous system lymphomas. Hematol Oncol Clin North Am. 2005;19(4):629-649, vi
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=16083827.
|
|
| 20) |
Abrey LE, Ben-Porat L, Panageas KS, et al. Primary central nervous system lymphoma: the Memorial Sloan-Kettering Cancer Center prognostic model. J Clin Oncol. 2006;24(36):5711-5715
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=17116938.
|
|
| 21) |
Abrey LE, Batchelor TT, Ferreri AJ, et al. Report of an international workshop to standardize baseline evaluation and response criteria for primary CNS lymphoma. J Clin Oncol. 2005;23(22):5034-5043
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=15955902.
|
|
| 22) |
Mohile NA, Deangelis LM, Abrey LE. The utility of body FDG PET in staging primary central nervous system lymphoma. Neuro Oncol. 2008;10(2):223-228
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=18287338.
|
|
| 23) |
Abrey LE, DeAngelis LM, Yahalom J. Long-term survival in primary CNS lymphoma. J Clin Oncol. 1998;16(3):859-863
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=9508166.
|
|
| 24) |
Omuro AM, Ben-Porat LS, Panageas KS, et al. Delayed neurotoxicity in primary central nervous system lymphoma. Arch Neurol. 2005;62(10):1595-1600
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=16216945.
|
|
| 25) |
Correa DD, Maron L, Harder H, et al. Cognitive functions in primary central nervous system lymphoma: literature review and assessment guidelines. Ann Oncol. 2007;18(7):1145-1151
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=17284616.
|
|

|
| 略語一覧
|

|
| |
|
| ABC |
activated B-cell-like |
|
| ASCT |
autologous stem-cell transplant |
自家幹細胞移植 |
| BCNU |
carmustine |
カルムスチン |
| BCR |
B-cell receptor |
B細胞受容体 |
| BTK |
Bruton's tyrosine kinase |
ブルトン型チロシンキナーゼ |
| CALG |
Cancer and Leukemia Group B |
|
| CCNU |
lomustine |
|
| CPA |
cyclophosphamide |
シクロホスファミド |
| CQ |
clinical question |
|
| CR |
complete response |
完全奏効 |
| CRu |
unconfirmed complete response |
未確認完全奏効 |
| CSF |
cerebro-spinal fluid |
脳脊髄液 |
| DLBCL |
diffuse large B-cell lymphoma |
びまん性大細胞型B細胞リンパ腫 |
| EANO |
European Association for Neuro-Oncology |
欧州脳腫瘍学会 |
| EFS |
event-free survival |
無イベント生存期間 |
| HD-AraC |
high dose cytarabine |
大量シタラビン療法 |
| HD-MTX |
high dose methotrexate |
大量メトトレキサート療法 |
| HDC |
high dose chemotherapy |
大量化学療法 |
| HR |
hazard ratio |
ハザード比 |
| IELSG |
International Extranodal Lymphoma Study Group |
|
| IPCG |
International PCNSL Collaborative Group |
|
| ITT |
intention-to-treatment |
|
| JCOG |
Japan Clinical Oncology Group |
|
| KPS |
Karnofsky Performance Status |
|
| LOC |
the French oculo-cerebral lymphoma |
|
| LYSA |
Lymphoma study association |
|
| MMSE |
Mini-Mental State Examination |
|
| mOS |
median overall survival |
全生存期間中央値 |
| mPFS |
median progression-free survival |
無増悪生存期間中央値 |
| MSKCC |
Memorial Sloan-Kettering Cancer Center |
|
| MTIC |
5-[(1Z)-3-methyltriaz-1-en-1-yl]-1H-imidazole-4-carboxamide |
|
| MTX |
methotrexate |
メトトレキサート |
| NABTT |
New Approaches to Brain Tumor Therapy |
|
| NCCN |
National Comprehensive Cancer Network |
|
| NHL |
non-Hodgkin lymphoma |
非ホジキンリンパ腫 |
| NIH |
National Insitute for Health |
米国国立衛生研究所 |
| ORR |
overall response rate |
全奏効割合 |
| OS |
overall survival |
全生存期間 |
| PCNSL |
primary central nervous system lymphoma |
中枢神経系原発悪性リンパ腫 |
| PCZ |
procarbazine |
プロカルバジン |
| PD |
progressive disease |
増悪 |
| PFS |
progression-free survival |
無増悪生存期間 |
| PR |
partial response |
部分奏効 |
| PS |
performance status |
|
| QOL |
quality of life |
生活の質 |
| r/r |
relapsed or refractory |
再発難治性 |
| RPA |
recursive partitioning analysis |
|
| RPE |
retinal pigment epithelium |
|
| RTOG |
Radiation Therapy Oncology Group |
|
| SD |
stable disease |
不変 |
| SFGM-TC |
Société Française de Greffe de Moëlle et Thérapie Cellulaire |
|
| SHM |
somatic hypermutation |
異常な体細胞超変異 |
| STI |
steriotactic irradiation |
定位放射線照射 |
| TLR |
Toll-like receptor |
|
| TMZ |
temozolomide |
テモゾロミド |
| TTP |
time to progression |
無増悪期間 |
| VCR |
vincristine |
ビンクリスチン |
| VDS |
vindesin |
ビンデシン |
| VP-16 |
etoposide |
エトポシド |
| VRL |
vitreo-retinal lymphoma |
硝子体網膜リンパ腫 |
| WBRT |
whole brain radiotherapy |
全脳照射 |
| WCST |
Wisconsin Card Scoring Test |
|
|

|
| Clinical Question
|

|
手術
CQ1 PCNSLの診療における手術の位置づけは?
|

|
| |
推奨
PCNSLに対しては,原則として手術による組織診断を推奨する。(推奨度1A)
|
|

|
| |
|
解説
|
| |
|
MRI・CTによる画像診断により,PCNSL典型例では高い診断率が得られる.しかし,組織型の確定〔ほとんどがびまん性大細胞型B細胞リンパ腫(DLBCL)であるが,T細胞リンパ腫(T-cell lymphoma)やその他の組織型も存在する〕や,悪性神経膠腫,その他の疾患との組織学的鑑別は必要であり,PCNSLの診断を確定するためには組織診断が必須である。
手術法としては,原則的に定位的もしくは開頭による生検術が施行される。PCNSLは多発性であることが多く,くも膜下腔や血管周囲腔・脳実質内への浸潤性進展性格が極めて強い。切迫脳ヘルニアをきたしている症例での減圧効果以外には,肉眼的全摘や部分摘出は予後に影響せず,画像上の全摘,あるいは生検でも治療成績は変わらないと報告されている1)(レベルIII)。2012年ドイツから,第III相試験(G-PCNSL SG-1試験)の部分解析で,亜全摘と全摘を受けた患者(全526例中137例)は生検を受けた患者に比して有意に無増悪生存期間(progression-free survival:PFS)と全生存期間(overall survival:OS)が長いことを報告した2){Weller, 2012 #874}(レベルIII)。しかし,単発病変の患者が亜全摘・全摘群に多く,病変の個数を調整するとOSの有意差は消失した。
現在のところ,積極的な摘出術を推奨するエビデンスは不十分と考えられている。ただし,脳深部病巣や高齢者等の患者背景因子により生検術施行のリスクが高いと判断される場合には,手術施行が困難であることもあり得る。
|

|
| |
|
文献検索式:
|
| |
|
#1 (Central Nervous System Neoplasms[MH] AND Lymphoma[MH]) OR ((PCNSL[TIAB] OR "primary central nervous system lymphoma" [TIAB] OR CNS[TIAB] OR (primary[TIAB] AND brain[tiab] AND lymphoma[TIAB]) NOT MEDLINE[SB])) 19,646
#2 surgery[majr] OR surgery[sh] 3,216,735
#3 (Randomized Controlled Trial[PT] OR Meta-Analysis[PT] OR Cohort Studies[MH:noexp] OR Follow-Up Studies[MH] OR Prospective Studies[MH] OR Clinical Trial, Phase II[PT] OR Clinical Trial, Phase III[PT] OR Clinical Trial, Phase IV[PT] OR prospective[TIAB] OR trial[TIAB]) AND (2017/04/01[PDAT]:2021/04/30[PDAT]) 540,689
#4 #1 AND #2 AND #3 22
|
本改訂時の新規抽出文献数:22件
抽出後追加文献数:0件
本CQへの新規追加採用文献数:0件
|
|

|
| |
|
|

|

|
ステロイド療法
CQ2-a 診断確定前にステロイド療法は施行するべきか?
|

|
| |
推奨
生検術前のステロイド使用は,可能な限り投与を控えることを推奨する。ステロイドによる標的病変の縮小が高頻度に生じるため,手術時に生検的中率が低下するリスクがあるため。(推奨度1B)
|
|

|
| CQ2-b 診断確定後のステロイド療法の位置づけは?
|

|
| |
推奨1
診断確定後のステロイド使用を提案する。PCNSLに対するステロイド療法は,一過性の腫瘍縮小効果が認められることが多く,また,症状緩和目的に使用されることも多いため。(推奨度2C)
|
|

|
| |
推奨2
ステロイドは治癒的効果に乏しいため,治癒目的の単独使用を行わないことを推奨する。(推奨度1B)
|
|

|
| |
|
解説
|
| |
|
ステロイド(糖質コルチコイド)の主たる作用機序は,核内受容体を介した腫瘍細胞への直接的細胞融解効果であり,血液脳関門の再構築効果もあわせて,半数近くの症例でステロイド投与後に急速な腫瘍縮小がみられる 〔完全奏効(complete response:CR)15%,部分奏効(partial response:PR)25%〕1) (レベルIII)。しかし,この治療効果は一過性であり2)(レベルIV/),一般に数週〜数カ月で腫瘍は再燃し,根治性に乏しい。
術前のステロイド投与は,標的病巣の急速な縮小により,生検による腫瘍細胞検出が困難となることがあり,また病理組織像も修飾を受けるため,術前にはできるだけステロイド投与を控えることが肝要である3) (レベルV)。ただし,強い脳浮腫や腫瘍のmass effectを伴うような場合など,臨床上必要と考えられる場合は治療開始前の病状安定化目的のため,ステロイド使用もやむを得ない。
なお,初発PCNSLでステロイドに対する治療反応を示した症例と反応がみられなかった症例との比較では,前者で生存期間中央値が17.9カ月であったのに対し,後者では5.5カ月にすぎなかったとの報告もあり,初発時のステロイド反応性は予後良好因子である可能性が指摘されている4) (レベルV)。
|

|
| |
|
文献検索式:
|
| |
|
1 (Central Nervous System Neoplasms[MH] AND Lymphoma[MH]) OR ((PCNSL[TIAB] OR "primary central nervous system lymphoma" [TIAB] OR CNS[TIAB] OR (primary[TIAB] AND brain[tiab] AND lymphoma[TIAB]) NOT MEDLINE[SB])) 19,638
2 Adrenal Cortex Hormones[MH] OR Adrenal Cortex Hormones[NM] OR steroid[tiab] OR steroids[tiab] OR corticosteroid[tiab] OR corticosteroids[tiab] 508,719
3 (Randomized Controlled Trial[PT] OR Meta-Analysis[PT] OR Cohort Studies[MH:noexp] OR Follow-Up Studies[MH] OR Prospective Studies[MH] OR Clinical Trial, Phase II[PT] OR Clinical Trial, Phase III[PT] OR Clinical Trial, Phase IV[PT] OR prospective[TIAB] OR trial[TIAB]) AND (2017/04/01[PDAT]:2021/04/30[PDAT]) 541,297
4 #1 AND #2 AND #3 15
|
本改訂時の新規抽出文献数:15件
抽出後追加文献数:0件
本CQへの新規追加採用文献数:0件
|
|

|
| |
|
|

|

|
ステージング:全身検査,眼科検査
CQ3 脳リンパ腫に対して眼科的検査,全身精査は必要か?
|

|
| |
推奨
中枢神経系リンパ腫では,眼内リンパ腫や全身性悪性リンパ腫を合併することがあり,その有無を精査することを推奨する。(推奨度1A)
|
|

|
| |
|
解説
|
| |
|
PCNSLではしばしば(約10~20%)眼内リンパ腫を認めるため眼科的検査が必要である。眼内リンパ腫単独症例は,脳や脳脊髄液への浸潤をきたすハイリスク群であり,未治療の場合,脳内への再発の根源となりやすい。したがって,PCNSL患者に対しては眼科的精査(スリットランプ検査含め)が必須であり,International PCNSL Collaborative Groupによるステージング精査1) (レベルV),National Eye Instituteの診断指針にも含められている2) (レベルV)。
また,全身性悪性リンパ腫の精査は,もし検出された場合に中枢神経系リンパ腫が転移性腫瘍である可能性が生じる点,中枢神経系以外の病巣を標的とする治療レジメンの検討が必要となってくる点など,治療上極めて重要である。全身精査の方法として,PET検査の有用性も報告されている。Memorial Sloan-Kettering Cancer Center(MSKCC)における小規模の後方視的研究で,166例のPCNSL疑い症例のうち,49例で全身FDG-PET検査が施行された。このうちの11%の症例で全身FDG-PET検査により全身性悪性リンパ腫が検出され,8%の症例では全身FDG-PET検査が唯一の全身病変を示す検査であった3) (レベルIV)。この結果は,全身PETがCTで検出できない病巣を捉えることのできる可能性を示唆するもので,PCNSLのステージングにおける有用性を示している。
なお,HIV陽性の免疫不全症例では,PCNSLを発症するリスクが高いことが知られており,感染の有無をスクリーニングすることが必須である。
|

|
| |
|
文献検索式:
|
| |
|
1 (Central Nervous System Neoplasms[MH] AND Lymphoma[MH]) OR ((PCNSL[TIAB] OR "primary central nervous system lymphoma" [TIAB] OR CNS[TIAB] OR (primary[TIAB] AND brain[tiab] AND lymphoma[TIAB]) NOT MEDLINE[SB])) 19,638
2 (Randomized Controlled Trial[PT] OR Meta-Analysis[PT] OR Cohort Studies[MH:noexp] OR Follow-Up Studies[MH] OR Prospective Studies[MH] OR Clinical Trial, Phase II[PT] OR Clinical Trial, Phase III[PT] OR Clinical Trial, Phase IV[PT] OR prospective[TIAB] OR trial[TIAB]) AND (2017/04/01[PDAT]:2021/04/30[PDAT]) 541,297
3 Diagnostic Techniques, Ophthalmological[MH] OR Diagnostic Techniques and Procedures[MH] 7,496,500
4 #1 AND #2 AND #3 36
|
本改訂時の新規抽出文献数:36件
抽出後追加文献数:0件
本CQへの新規追加採用文献数:0件
|
|

|
| |
|
|

|

|
寛解導入療法:①初発時治療
CQ4 PCNSLに対してどのような初発時治療が推奨されるか?
|

|
| |
推奨1
PCNSLに対する治療では,大量メトトレキサート(HD-MTX)療法を基盤とする薬物療法による寛解導入療法を行うことを推奨する。(推奨度1A)
|
|

|
| |
推奨2
寛解導入療法後に完全奏効が得られた場合、年齢を考慮したうえで薬物療法、全脳照射による放射線治療、あるいはその併用による地固め療法を行うことを推奨する。(推奨度1A)
|
|

|
| |
|
解説
|
| |
|
PCNSLに対する初発時治療として,生検等による組織診断確定後に、薬物療法による寛解導入療法を行い,完全奏効(complete response/complete response unconfirmed:CR/CRu)が得られた場合、引き続き地固め療法を行う。近年のアプローチとして,寛解導入療法にはCR/CRuがより高い多剤併用メトトレキサート(MTX)基盤療法が用いられる(CQ5参照)。
CR/CRu後は、特に高齢者において遅発性中枢神経障害の発症のリスクである全脳照射を待機し,薬物療法のみで地固めをはかる試みが複数のランダム化比較試験で検討されている。現時点で,検証的第III相試験による全脳照射待機治療法の優越性・非劣性は示されていない。エビデンス上は全脳照射による地固め療法が標準治療の位置づけにあるが、全脳照射は現在の薬物療法が開発される以前に広く使用されてきた治療法であり、全脳照射後も再発は予防しきれない。一方、大量シタラビン療法(HD-AraC)、あるいは自家幹細胞移植(autologous stem- cell transplantation:ASCT)支援大量化学療法(high-dose chemotherapy:HDC)(HDC/ASCT)などの薬物療法による非照射地固め療法が、ランダム化第II、第III相試験にて全脳照射と比較し全生存期間(OS)が劣らない結果と、認知機能障害の発生割合が低いことが報告されている1-3)(レベルIb)。
その結果、現在の欧米のガイドラインでは、CR/CRu例に対しての地固め療法として薬物療法または(減線量での)全脳照射が推奨され(National Comprehensive Cancer Network:NCCN)、60歳以上では非照射が推奨されている(European Association for Neuro-Oncology:EANO)4)(レベルIII)。本邦では60歳以上が82%以上を占め、発症年齢中央値が71歳と多くの初発PCNSL患者は全脳照射による遅発性中枢神経障害のハイリスクとなることことから5)(レベルIII)、寛解導入療法でCR/CRu例に対しては、年齢を考慮した上で地固め療法を検討することが一般化してきている。
本CQでは,初発時治療に用いられる各治療法について概要を述べる。
|
| |
|
1.多剤併用による寛解導入療法(レジメン)
初発PCNSLに対する寛解導入療法として,大量メトトレキサート(HD-MTX)療法の有効性が示されているが,HD-MTX単独療法ではCR/CRu割合は低く(30 ~50%),引き続きの全脳照射が必要とされる。
HD-MTX療法を含む多剤併用薬物療法は,HD-MTX単独療法と比較し高い奏効割合(overall response rate:ORR),CR/CRu割合を期待し,第II相試験(単アーム、ランダム化比較試験)、第III相試験として複数の試験結果が報告されている2, 6-13)(レベルIb,IIa)。これらの試験では、高齢者対象あるいはHDC/ASCT試験以外で地固め療法として全脳照射が組み込まれていたものが多く、寛解導入療法部分のみの奏効割合の評価が困難であるが、いずれも高い奏効割合とCR割合が示されている。どのような併用薬剤やレジメンが良いか、レジメン間の比較試験が乏しく、優劣の推奨は困難であるが、本邦で承認されている薬剤を用いるR-MPV療法が国内では広く使用されている。詳細は本章CQ5を参照のこと。
|
| |
|
2.リツキシマブ
全身のびまん性大細胞型B細胞リンパ腫(DLBCL)に対する標準治療に組み込まれている抗CD20モノクローナル抗体薬のリツキシマブに関しては,血液脳関門の透過性が乏しいことからPCNSLへの適用は疑問視される面があった。しかし,病初期にはPCNSLは強く造影増強される病変として存在することから腫瘍塊部では血液脳関門は破綻していると考えられ,初期治療における寛解導入への効果を期待し,近年の初発PCNSLに対する薬物療法試験においてはリツキシマブを併用したレジメンが主流となっている。エビデンスとしては、2016年に報告された欧州でのMATRix試験(IESLG32試験)では,リツキシマブのHD-MTX+大量シタラビン(HD-AraC)併用療法への上乗せによる生存期間延長効果の傾向が示され6)(レベルIb),リツキシマブの寛解導入療法での併用の可能性が示唆された。一方、2019年に報告されたオセアニアとオランダで実施されたHOVON 105試験(ランダム化第III相)では、リツキシマブの寛解導入療法への上乗せ効果が示されず12)(レベルIb)、科学的検証がさらに待たれる。詳細は本章CQ6を参照のこと。
|
| |
|
3.大量化学療法(HDC)・自家幹細胞移植(ASCT)
地固め療法を強化し,全脳照射を待機することを目的として,HDCにASCTを併用した治療法が試みられており,ここ数年間に複数の単アームおよびランダム化第II相試験の結果が報告された1, 2, 14-17)(レベルIb, IIa)。このアプローチは高齢者に対しては高度有害事象発生のリスクが高いとされることから,治療対象者は若年者に限定される点を考慮する必要があるが,治療を完遂できた患者での長期無増悪生存の可能性が示唆されている。Key drugとなるチオテパ(TT)が悪性リンパ腫に対する自家造血幹細胞移植の前治療(ブスルファンとの併用)を効能として2020年に本邦でも承認されたことで、今後の発展が注目される。また再発・初期治療不応時の救済治療として検討されている。詳細は本章CQ8を参照のこと。
|
| |
|
4.高齢者
PCNSLは高齢者に発症しやすく,本邦でも80%以上は初発時年齢が60歳以上であり,脳の脆弱性の観点からも,遅発性中枢神経系障害のリスクを軽減するべく全脳照射を回避した治療レジメンが,第II相試験(ランダム化比較試験も含む)にて試みられている13, 18-20)(レベルIb,IIa)。詳細は本章CQ12を参照のこと。
|
| |
|
5.全脳照射単独療法
PCNSLは放射線感受性が高い腫瘍であるが,照射後早期に再発する傾向にある。全脳照射単独療法による生存期間中央値(median overall survival; mOS)は,これまでの報告をまとめると12~18カ月程度で,5年生存割合も5%足らずと,単独療法の治療効果は不十分である。すなわち,PCNSLに対する放射線単独療法は,奏効割合は高いものの早期に再発する傾向が高く,長期予後は不良である。RTOGによる報告では,全脳40 Gyに局所20 Gyの追加照射を施行した結果,腫瘍縮小効果は81%で得られたが,mOSは12.2カ月に留まった(RTOG 83-15)21) (レベルIIa)。Shibamotoらによる1990~1999年の我が国での放射線治療の成績は5年生存割合が18%であった22) (レベルIII)。したがって,術後の放射線単独療法は化学療法施行困難例に限られる。
|
| |
|
6.CHOP療法
PCNSLに対する放射線単独療法の治療成績には限界があるため,化学療法と全脳照射の併用療法が検討された。全脳照射と全身性節外性非ホジキンリンパ腫(non-Hodgkin lymphoma:NHL)の標準治療法であるCHOP (D)療法〔シクロホスファミド(CPA),ドキソルビシン(DXR),ビンクリスチン,デキサメタゾン〕の併用はORR 67%,mOS 16カ月であり,全脳照射単独治療成績を上回れず,有効性が証明されなかった(RTOG 88-06) 23) (レベルIIa)。この結果は,CPAとDXRが血液脳関門を透過しない薬剤であったことに主として起因すると考えられている24)。
|
| |
|
7.大量メトトレキサート(MTX)療法後全脳照射
メトトレキサート(MTX)は大量に急速点滴静注投与することで血液脳関門を透過し,引き続きのロイコボリンカルシウム投与により正常細胞を救済することが可能とされている。
HD-MTX療法は単剤あるいは他剤との併用療法とその後の全脳照射併用によって,mOSが有意に延長する結果が得られた。HD-MTX単独と全脳照射併用療法では,Glassらは25例に対し,ORR 88%、mOS 33カ月25) (レベルIIb),Trans-Tasman Radiation Oncology Groupは46例に対し照射後ORR 95%,mOS 36カ月26)(レベルIIa),Hiragaらは28例に対しORR 78.6%,mOS 39.3カ月27) (レベルIIa)と,放射線治療単独に比べ良好な治療成績が報告されている。
本療法での神経毒性発生率は10~15%であった。急性毒性としては,好中球減少,血小板減少,肝機能障害,嘔気・嘔吐などの消化器症状が~20%程度に認められ,稀に腎不全もみられた。我が国でのPCNSL研究会による第II相試験では,同様にHD-MTX単独療法の後,全脳照射を55例に施行し,照射後のORR 85%,mOS 44カ月と中間報告されている28) (レベルIIb)。しかし、上記のようにHD-MTX単独寛解導入療法ではCR/CRu割合が低く、救済療法としての全脳照射を必要とすることが多いこと、またその上で早期の再発がみられることから、近年はHD-MTX基盤多剤併用寛解導入療法が用いられ、HD-MTX単独療法は多剤併用療法が毒性等の観点から実施困難な患者にのみ使用される。
MTXの用量および投与時間についてはさまざまな報告があり,それぞれの投与方法を比較した試験はない。メタアナリシスでは,3 g/m2以上で効果が高いとの報告がある29) (レベルIII)。十分な中枢神経系移行のためには短時間(通常2~3時間)での投与を行い,規定どおりの大量補液、尿アルカリ化、MTX血中濃度をモニタリングしながらのロイコボリン救済治療を行う。
|
| |
|
8.全脳照射のタイミング
具体的な検証試験は行われていないが,標準治療であるHD-MTX療法と放射線治療の併用療法では,HD-MTX療法を先行し,その後に全脳照射を施行するほうが,MTXの治療効果の判定が可能となることと,遅発性中枢神経障害の発生リスクを軽減すると考えられている30) (レベルIII)。
|

|
| |
|
文献検索式:
|
| |
|
1 ((Central Nervous System Neoplasms[MH] AND Lymphoma[MH]) OR ((PCNSL[TIAB] OR "primary central nervous system lymphoma" [TIAB] OR CNS[TIAB] OR (primary[TIAB] AND brain[tiab] AND lymphoma[TIAB]) NOT MEDLINE[SB]))) 19,693
2 (Remission Induction[MH] OR remission[TIAB] OR induction[TIAB]) 648,912
3 ((Randomized Controlled Trial[PT] OR Meta-Analysis[PT] OR Cohort Studies[MH:noexp] OR Follow-Up Studies[MH] OR Prospective Studies[MH] OR Clinical Trial, Phase II[PT] OR Clinical Trial, Phase III[PT] OR Clinical Trial, Phase IV[PT] OR prospective[TIAB] OR trial[TIAB]) AND (2017/04/01[PDAT]:2021/04/30[PDAT])) 544,940
4 #1 AND #2 AND #3 51
|
本改訂時の新規抽出文献数:51件
抽出後追加文献数:3件(Thiel, 成田、EANO)
本CQへの新規追加採用文献数:7件(HOVON, MATRix, PRECIS, PRIMAIN)
|
|

|
| |
|
| ◆文献:(第3版分)(○:本改訂にて追加された文献) |
| 1) |
○Ferreri AJM, Cwynarski K, Pulczynski E, et al. Whole-brain radiotherapy or autologous stem-cell transplantation as consolidation strategies after high-dose methotrexate-based chemoimmunotherapy in patients with primary CNS lymphoma: results of the second randomisation of the International Extranodal Lymphoma Study Group-32 phase 2 trial. Lancet Haematol. 2017;4(11):e510-e523 (レベル)
https://www.ncbi.nlm.nih.gov/pubmed/29054815.
|
|
| 2) |
○Houillier C, Taillandier L, Dureau S, et al. Radiotherapy or Autologous Stem-Cell Transplantation for Primary CNS Lymphoma in Patients 60 Years of Age and Younger: Results of the Intergroup ANOCEF-GOELAMS Randomized Phase II PRECIS Study. J Clin Oncol. 2019;37(10):823-833 (レベル)
https://www.ncbi.nlm.nih.gov/pubmed/30785830.
|
|
| 3) |
○Thiel E, Korfel A, Martus P, et al. High-dose methotrexate with or without whole brain radiotherapy for primary CNS lymphoma (G-PCNSL-SG-1): a phase 3, randomised, non-inferiority trial. Lancet Oncol. 2010;11(11):1036-1047 (レベル)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=20970380.
|
|
| 4) |
○Hoang-Xuan K, Bessell E, Bromberg J, et al. Diagnosis and treatment of primary CNS lymphoma in immunocompetent patients: guidelines from the European Association for Neuro-Oncology. Lancet Oncol. 2015;16(7):e322-332 (レベル)
https://www.ncbi.nlm.nih.gov/pubmed/26149884.
|
|
| 5) |
○成田善孝. 脳腫瘍の分類と疫学. 日本臨床. 2021;79(Supplement 1):187-193 (レベル).
|
|
| 6) |
●Ferreri AJ, Cwynarski K, Pulczynski E, et al. Chemoimmunotherapy with methotrexate, cytarabine, thiotepa, and rituximab (MATRix regimen) in patients with primary CNS lymphoma: results of the first randomisation of the International Extranodal Lymphoma Study Group-32 (IELSG32) phase 2 trial. Lancet Haematol. 2016;3(5):e217-227 (レベルIb)
https://www.ncbi.nlm.nih.gov/pubmed/27132696.
|
|
| 7) |
●Ferreri AJM, Ciceri F, Brandes AA, et al. MATILDE chemotherapy regimen for primary CNS lymphoma: results at a median follow-up of 12 years. Neurology. 2014;82(15):1370-1373 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/24634458.
|
|
| 8) |
●Glass J, Won M, Schultz CJ, et al. Phase I and II Study of Induction Chemotherapy With Methotrexate, Rituximab, and Temozolomide, Followed By Whole-Brain Radiotherapy and Postirradiation Temozolomide for Primary CNS Lymphoma: NRG Oncology RTOG 0227. J Clin Oncol. 2016;34(14):1620-1625 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/27022122.
|
|
| 9) |
●Laack NN, O'Neill BP, Ballman KV, et al. CHOD/BVAM chemotherapy and whole-brain radiotherapy for newly diagnosed primary central nervous system lymphoma. Int J Radiat Oncol Biol Phys. 2011;81(2):476-482 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/20800387.
|
|
| 10) |
●Morris PG, Correa DD, Yahalom J, et al. Rituximab, methotrexate, procarbazine, and vincristine followed by consolidation reduced-dose whole-brain radiotherapy and cytarabine in newly diagnosed primary CNS lymphoma: final results and long-term outcome. J Clin Oncol. 2013;31(31):3971-3979 (レベルIIa)
http://www.ncbi.nlm.nih.gov/pubmed/24101038.
|
|
| 11) |
●Rubenstein JL, Hsi ED, Johnson JL, et al. Intensive chemotherapy and immunotherapy in patients with newly diagnosed primary CNS lymphoma: CALGB 50202 (Alliance 50202). J Clin Oncol. 2013;31(25):3061-3068 (レベルIIa)
http://www.ncbi.nlm.nih.gov/pubmed/23569323.
|
|
| 12) |
○Bromberg JEC, Issa S, Bakunina K, et al. Rituximab in patients with primary CNS lymphoma (HOVON 105/ALLG NHL 24): a randomised, open-label, phase 3 intergroup study. Lancet Oncol. 2019;20(2):216-228 (レベルIb)
https://www.ncbi.nlm.nih.gov/pubmed/30630772.
|
|
| 13) |
○Fritsch K, Kasenda B, Schorb E, et al. High-dose methotrexate-based immuno-chemotherapy for elderly primary CNS lymphoma patients (PRIMAIN study). Leukemia. 2017;31(4):846-852 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/27843136.
|
|
| 14) |
●Illerhaus G, Kasenda B, Ihorst G, et al. High-dose chemotherapy with autologous haemopoietic stem cell transplantation for newly diagnosed primary CNS lymphoma: a prospective, single-arm, phase 2 trial. Lancet Haematol. 2016;3(8):e388-397 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/27476790.
|
|
| 15) |
●Kasenda B, Schorb E, Fritsch K, et al. Prognosis after high-dose chemotherapy followed by autologous stem-cell transplantation as first-line treatment in primary CNS lymphoma--a long-term follow-up study. Ann Oncol. 2012;23(10):2670-2675 (レベルIIb)
http://www.ncbi.nlm.nih.gov/pubmed/22473593.
|
|
| 16) |
●Kiefer T, Hirt C, Späth C, et al. Long-term follow-up of high-dose chemotherapy with autologous stem-cell transplantation and response-adapted whole-brain radiotherapy for newly diagnosed primary CNS lymphoma: results of the multicenter Ostdeutsche Studiengruppe Hamatologie und Onkologie OSHO-53 phase II study. Ann Oncol. 2012;23(7):1809-1812 (レベルIIb)
https://www.ncbi.nlm.nih.gov/pubmed/22115927.
|
|
| 17) |
●Omuro A, Correa DD, DeAngelis LM, et al. R-MPV followed by high-dose chemotherapy with TBC and autologous stem-cell transplant for newly diagnosed primary CNS lymphoma. Blood. 2015;125(9):1403-1410 (レベルIIa)
http://www.ncbi.nlm.nih.gov/pubmed/25568347.
|
|
| 18) |
●Fritsch K, Kasenda B, Hader C, et al. Immunochemotherapy with rituximab, methotrexate, procarbazine, and lomustine for primary CNS lymphoma (PCNSL) in the elderly. AnnOncol. 2011;22(9):2080-2085 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/21303800.
|
|
| 19) |
●Omuro A, Chinot O, Taillandier L, et al. Methotrexate and temozolomide versus methotrexate, procarbazine, vincristine, and cytarabine for primary CNS lymphoma in an elderly population: an intergroup ANOCEF-GOELAMS randomised phase 2 trial. Lancet Haematol. 2015;2(6):e251-259 (レベルIb)
http://www.ncbi.nlm.nih.gov/pubmed/26688235.
|
|
| 20) |
●Pulczynski EJ, Kuittinen O, Erlanson M, et al. Successful change of treatment strategy in elderly patients with primary central nervous system lymphoma by de-escalating induction and introducing temozolomide maintenance: results from a phase II study by the Nordic Lymphoma Group. Haematologica. 2015;100(4):534-540 (レベルIIa)
http://www.ncbi.nlm.nih.gov/pubmed/25480497.
|
|
| 21) |
Nelson DF, Martz KL, Bonner H, et al. Non-Hodgkin's lymphoma of the brain: can high dose, large volume radiation therapy improve survival? Report on a prospective trial by the Radiation Therapy Oncology Group (RTOG): RTOG 8315. Int J Radiat Oncol Biol Phys. 1992;23(1):9-17 (レベルIIa)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=1572835.
|
|
| 22) |
Shibamoto Y, Ogino H, Hasegawa M, et al. Results of radiation monotherapy for primary central nervous system lymphoma in the 1990s. Int J Radiat Oncol Biol Phys. 2005;62(3):809-813 (レベルIII)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=15936564.
|
|
| 23) |
Schultz C, Scott C, Sherman W, et al. Preirradiation chemotherapy with cyclophosphamide, doxorubicin, vincristine, and dexamethasone for primary CNS lymphomas: initial report of radiation therapy oncology group protocol 88-06. J Clin Oncol. 1996;14(2):556-564 (レベルIIa)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=8636771.
|
|
| 24) |
Ott RJ, Brada M, Flower MA, et al. Measurements of blood-brain barrier permeability in patients undergoing radiotherapy and chemotherapy for primary cerebral lymphoma. Eur J Cancer. 1991;27(11):1356-1361 (レベル)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=1835848.
|
|
| 25) |
Glass J, Gruber ML, Cher L, et al. Preirradiation methotrexate chemotherapy of primary central nervous system lymphoma: long-term outcome. J Neurosurg. 1994;81(2):188-195 (レベルIIb)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=8027800.
|
|
| 26) |
O'Brien PC, Roos DE, Pratt G, et al. Combined-modality therapy for primary central nervous system lymphoma: long-term data from a Phase II multicenter study (Trans-Tasman Radiation Oncology Group). Int J Radiat Oncol Biol Phys. 2006;64(2):408-413 (レベルIIa)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=16198065.
|
|
| 27) |
Hiraga S, Arita N, Ohnishi T, et al. Rapid infusion of high-dose methotrexate resulting in enhanced penetration into cerebrospinal fluid and intensified tumor response in primary central nervous system lymphomas. J Neurosurg. 1999;91(2):221-230 (レベルIIa)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=10433310.
|
|
| 28) |
泉本修一, 森鑑二, 有田憲生. 中枢神経系悪性リンパ腫研究会:悪性リンパ腫に対するHD-MTX療法の長期成績と問題点―多施設共同研究から. 第26回日本脳腫瘍学会抄録集. 2008:130 (レベルIIb).
|
|
| 29) |
Reni M, Ferreri AJ, Guha-Thakurta N, et al. Clinical relevance of consolidation radiotherapy and other main therapeutic issues in primary central nervous system lymphomas treated with upfront high-dose methotrexate. Int J Radiat Oncol Biol Phys. 2001;51(2):419-425 (レベルIII)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=11567816.
|
|
| 30) |
DeAngelis LM, Yahalom J, Heinemann MH, et al. Primary CNS lymphoma: combined treatment with chemotherapy and radiotherapy. Neurology. 1990;40(1):80-86 (レベルIII)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=2296388.
|
|

|

|
寛解導入療法:②多剤併用療法
CQ5 PCNSLに対する寛解導入療法として多剤併用療法が推奨されるか?
|

|
| |
推奨1
PCNSLに対する寛解導入療法として,大量メトトレキサート(HD-MTX)を含む多剤併用薬剤療法を推奨する(推奨度1A)。
|
|

|
| |
|
解説
|
| |
|
大量メトトレキサート(HD-MTX)単独療法+全脳照射により,PCNSLの治療成績は生存期間中央値(median overall survival; mOS)が33~44カ月と放射線治療単独に比べ改善したが,依然長期の寛解や治癒に至る症例は少ない。より治療成績の向上を目的として,HD-MTX療法に他剤を併用する多剤併用HD-MTX療法±全脳照射が試みられている。併用薬としては,プロカルバジン(PCZ),シクロホスファミド(CPA),ビンクリスチン(VCR),チオテパ(寛解導入療法は適応外),シタラビン(AraC),カルムスチン(BCNU:注射薬は国内未承認),リツキシマブ(本章CQ6参照)などが使用されている 。
|
| |
|
1. (R)-MPV-A=〔(リツキシマブ)-MTX+PCZ+VCR-AraC〕療法
Memorial Sloan-Kettering Cancer Center(MSKCC)で行われた第II相試験(52症例)では,5サイクルのHD-MTX (3.5 g/m2),PCZ,VCR併用療法後に全脳照射を施行し,さらに大量シタラビン(HD-AraC)による地固め療法が施行された(MPV-A療法)。60歳以上では全脳照射が待機される症例も含まれたが,長期フォローアップでmOSが51カ月とHD-MTX単独療法の治療成績を上回る成績が報告された1)(レベルIIa)。しかし,一方で治療関連神経毒性は最終的には30%に発生し,初期治療で全脳照射を行った60歳以上の症例では75%と高頻度で出現している。RTOG 93-10試験では,同様にHD-MTX(2.5 g/m2)にPCZ,VCR,およびメトトレキサート(MTX)髄注,全脳照射後AraCを加えた治療を102例に施行し,mOSは37カ月であったが,15%に重篤な神経障害を認めた2)(レベルIIa)。
MSKCCからはその後,MPV-A療法にリツキシマブを併用する多剤併用免疫化学療法のR-MPV-Aレジメンの治療成績が報告された(MSK-01-146試験)3)。この単アーム第II相試験では,R-MPV療法を5サイクルもしくは7サイクル施行後に完全奏効(CR)となった場合,全脳照射は23.4 Gyに減量し,地固めのHD-AraC療法を追加した。全52例中30例(60%)でR-MPV療法後にCRとなり減量照射が行われ,主要評価項目の減量照射施行例での2年PFSは77%,PFS中央値(mPFS)は7.7年,mOSは未到達であった。全例でのmPFSは3.3年,mOSは6.6年,全治療終了後の追跡でも認知機能やMRI上の白質変化に有意な悪化は認めなかった。主たる有害事象は好中球減少症で,4例が毒性により中止(腎機能障害,イレウス,発熱性好中球減少,憩室破裂)され,治療関連死は6%であった3)(レベルIIa)(リツキシマブに関しては本章CQ6を参照のこと)。
Omuroらは同様に32例(年齢中央値57歳,KPS中央値80%)に対しR-MPV療法(5〜7サイクル)後,チオテパ+CPA+ブスルファン併用(TBCレジメン)による大量化学療法(HDC)と自家幹細胞移植(ASCT)を行う単アーム第II相試験を実施した4)。追跡期間45カ月で,R-MPVの奏効割合(ORR)は97%,mPFS・mOSは未到達,2年PFSおよびOSは各79%,81%と良好な成績が認められたが,治療関連死が3例(10%)に生じた(レベルIIa)。
[注意]
TBCレジメンは適応外
|
| |
|
2. (R)-MA=〔(リツキシマブ)+MTX+AraC〕療法
PCNSLに対するHD-MTX療法を行った19件の前方視的臨床試験の結果を解析したメタアナリシスが2001年に報告され,有意に予後良好であった3 g/m2以上のMTX投与量の症例に限ると,AraCの追加が多変量解析にて生存期間の延長効果が認められた5)(レベルIII)。この結果を受けて,2009年にInternational Extranodal Lymphoma Study Group (IELSG)はHD-MTX療法+全脳照射群と,HD-AraCをHD-MTXに追加する併用(MA)群を比較するランダム化第II相試験(IELSG20試験)の治療成績を報告した6)(レベルIb)。79症例を2群に分け,奏効割合はMTX群40%,MA群69% (p=0.009),3年FFS割合は単独群で21%,MA群38% (p=0.01)(HR=0.54),3年生存割合はMTX単独群32%,MA群46%(p=0.07)(HR=0.65)と,MA群で治療反応性と無増悪生存期間の延長効果が認められた。しかし毒性はMA群で明らかに強く,Grade3/4の高度血液毒性がMTX単独群では15%に留まったのに対し,MA群では92%にみられ,また治療関連死も8%(MTX単独群では3%)に出現した。HD-AraC併用はG-CSFなどの予防的治療を必要とし,75歳以上の高齢者には推奨できないとしている。また,本試験でのMTX単独群での治療間隔は3週間ごとであり,通常の2週間ごとの治療間隔に比べ長いことから投与量強度(dose intensity)が相対的には低く,全体のORRも低めであることなど,本試験結果の今後の検証が必要と考えられる。
|
| |
|
3. チオテパ,リツキシマブ
欧州のIELSGでは,初発PCNSLに対し,上記のHD-MTX+HD-AraC療法を対照に,抗体薬のリツキシマブ,およびチオテパ(寛解導入療法は国内適応外)の上乗せ効果を探索するランダム化第II相試験を実施した(IELSG32:MATRix試験)7)。70歳以下の227例(平均年齢57歳)をグループA:MTX+AraC(MA)併用群(75例)),B:MA+リツキシマブ(MAR)群(69例),C:MAR+チオテパ(適応外)群(MATRixレジメン。75例)の3群にランダム化し,主要評価項目の寛解導入療法後のCR割合は,A群23%,B群30%,C群49%で,C群はA群、B群に対して有意に上回った。B群のA群に対する優位性は示されなかった(p=0.29)。ORRはA群53%,B群74%,C群87%であった。B群はORRに関してA群に対して有意に上回り(p=0.012),PFS,OSにおいても改善傾向を示した(PFS:p=0.051,OS:p=0.095)。C群はORRに関してA群に対して有意に上回り(p=0.00001),B群に対しても改善傾向(p=0.053)が認められた。PFS, OSにおいてもA群に対して有意に上回り(PFS:p=0.00089, OS:p=0.0015),B群に対しても延長傾向(PFS:p=0.12, OS:p=0.12)を認めた(レベルIb)7)。Grade4の血液毒性はC群で他群より多く発生したが,感染性合併症の発生割合は3群間で同等であった。Grade4の非血液毒性は稀で,寛解導入療法期の治療関連死は6%であった。したがって,初発PCNSLに対し,リツキシマブの併用,さらにはチオテパ(適応外)の併用は有力な治療法と考えられ,現在の多くの臨床試験ではリツキシマブが寛解導入療法の一部となっている。一方,チオテパはPCNSLに対して本邦では寛解導入療法には適応外となっているため、MATRixレジメンは保険診療下では使用することはできない(リツキシマブに関しては本章CQ6を参照のこと)。
|
| |
|
4. テモゾロミド(PCNSLは適応外)
膠芽腫の標準治療薬であるテモゾロミド(TMZ)は血液脳関門透過性が良好なアルキル化薬のため,浸潤性が強くアルキル化系抗がん薬が適応となっているPCNSLに対する有効性が期待される薬剤である(現在は適応外)。再発PCNSLに対する効果が報告されたことを受け,2つの単アーム第II相試験がTMZを初期寛解導入療法に組み込んだレジメンで実施された。CALGB 50202試験では,MT-R(MTX+TMZ+リツキシマブ)療法5サイクルによる導入後,CR例で全脳照射を回避し,CYVE (エトポシド+AraC)療法による地固め療法を行った。44例(年齢中央値61歳)が登録され,主要評価項目のMT-R後のCR割合は66%,2年PFSは全体で57%,CYVE地固めを完了した患者群では77%であった8)(レベルIIa)。Grade4の好中球減少,血小板減少が各55%,50%に認められたが,その80%が地固めCYVE療法後に生じ,1例感染による死亡があった。MT-RによるGrade4の有害事象は低頻度であった。
RTOG 0227試験では,MT-R併用による寛解導入療法後に全脳照射(36 Gy)を行い,その後TMZ単独による維持療法(10サイクル)を行う単アーム第I/II相試験が実施された。第II相では53例(平均年齢57歳)で,主要評価項目の2年OSは80.8%,2年PFS 63.6%,ORR 85.7%,Grade3/4の有害事象は照射前に66%,照射後治療は45%であった9)(レベルIIa)。この結果は,RTOGによるPCNSLに対する過去の試験と比較し最も優れた成績であった。
TMZはプロカルバジン(PCZ)と同じく5-[(1Z)-3-methyltriaz-1-en-1-yl]-1H-imidazole-4-carboxamide(MTIC)が抗腫瘍効果を発揮する誘導体であり,PCZに比べ毒性が軽い特徴を有することから,これらの試験結果から今後PCZに代わり多剤併用寛解導入療法に組み入れられる可能性がある。Omuroらは,60歳以上の高齢者初発PCNSLに対するMPV-A療法とMTX+TMZ(MT)療法を比較するランダム化第II相試験(ANOCEF-GOELAMS試験)を実施した10)。95例をMT群48例(年齢中央値73歳),MPV-A群47例(同72歳)に割り付け,主要評価項目の1年PFSは,MT群,MPV-A群ともに36%と有意差を認めなかったが,mPFSは各6.1カ月,9.5カ月,mOSは各14カ月,31カ月,ORRは各71%,82%とMPV-A療法群が良好な傾向がみられた(レベルIb)。
我が国では,Japan Clinical Oncology Group(JCOG)脳腫瘍グループが70歳以下の初発PCNSLを対象に,HD-MTX療法を3サイクル後,全脳照射(CR例で30 Gy,非CR例では30 Gy+局所照射10 Gy)にTMZを併用し,照射後に維持TMZ療法を2年間継続する試験治療群を,TMZを用いない標準治療群を比較するランダム化第III相試験を先進医療B下で実施した(JCOG 1114C)。中間解析の結果、TMZのPFSおよびOSへの上乗せ効果は示されなかった11)。
|
| |
|
5. その他のレジメン
欧州では、MBVP療法(MTX+BCNU+VP-16またはテニポシド+プレドニゾロン)±リツキシマブ(RMBVP)がランダム化第II、III相試験(PRECIS試験、HOVON-105試験)の寛解導入療法として用いられている12, 13)(BCNUが国内未承認のため使用不可)。PRECIS試験では、RMBVP(VP16使用)療法とその後のリツキシマブ+AraC(RA)による寛解導入療法後、全脳照射(70例) vs. HDC/ASCT(TBCレジメン、70例)を比較し、2年PFSは各63%、87%、intention-to-treatment(ITT)群での4年OSは全脳照射群64%、HDC群65%であった13)(レベル1b)。HOVON-105試験では、MBVP(tenoposide使用)±リツキシマブ)(Rなし群100例、Rあり群99例)の寛解導入療法に、60歳以下では減量全脳照射を行い、1年無イベント生存割合(event-free survival:EFS)はMBVP群で49%、R-MBVP群で52%であった12)(レベルIb)。その他,MATILDE療法〔MTX+AraC+イダルビシン+チオテパ(適応外)〕療法後に全脳照射を施行する第II相試験(41例,年齢中央値57歳)では,主要評価項目のMATILDE療法後のCR割合は44%,5年PFSおよびOSは各24%,30%であった14)(レベルIIa)。また65歳以上の高齢者を対象としたPRIMAIN試験では,リツキシマブ+MTX+PCZ+lomustine(CCNU)(未承認)の併用療法を3サイクル行い,PCZによる維持療法を実施した(107例,年齢中央値73歳)15)。主要評価項目の3サイクル後のCR割合は35.5%,2年PFSおよびOSは各37.3%,47.0%であった。治療関連死が9例(9%)に認められた(レベルIIa)。Laackらは70歳までの36例にCHOD療法(CPA+VCR+デキサメタゾン)療法後にBVAM(BCNU+AraC+MTX)療法を行う第II相試験を行った。主要評価項目の1年OSは64%,mOSは18.5カ月,無増悪期間の中央値(median time to progression:mTTP)は12.3カ月にすぎなかった。28%でGrade3/4の中枢神経毒性が認められたとしている16)(レベルIIa)。
以上より,HD-MTXと併用する多剤併用薬剤療法は一定の奏効と生存延長効果が多くの第II相、III相試験で示されており,国内で保険診療下使用が可能なR-MPV療法を初期寛解導入療法として主として使用することを考慮することが推奨されるが,ランダム化第III相試験での検証は未実施である。
[注意]
カルムスチン(carmustine:BCNU):注射薬は国内未承認,脳内留置用剤(徐放性ポリマー)は悪性神経膠腫に対して承認
テモゾロミド(temozolomide: TMZ):適応外
tenoposide(VM26):国内非販売
チオテパ(thiotepa):寛解導入療法には適応外
|

|
| |
|
文献検索式:
|
| |
|
1 ((Central Nervous System Neoplasms[MH] AND Lymphoma[MH]) OR ((PCNSL[TIAB] OR "primary central nervous system lymphoma" [TIAB] OR CNS[TIAB] OR (primary[TIAB] AND brain[tiab] AND lymphoma[TIAB]) NOT MEDLINE[SB]))) 19,694
2 (Antineoplastic Combined Chemotherapy Protocols[MH] OR Drug Therapy, Combination[MH] OR (((combination[TIAB] OR multiagent*[TIAB] OR multidrug*[TIAB]) AND (chemotherapy[TIAB] OR therapy[TIAB])) NOT medline[SB])) 368,585
3 (Remission Induction[MH] OR remission[TIAB] OR induction[TIAB]) 648,975
4 ((Randomized Controlled Trial[PT] OR Meta-Analysis[PT] OR Cohort Studies[MH:noexp] OR Follow-Up Studies[MH] OR Prospective Studies[MH] OR Clinical Trial, Phase II[PT] OR Clinical Trial, Phase III[PT] OR Clinical Trial, Phase IV[PT] OR prospective[TIAB] OR trial[TIAB]) AND (2017/04/01[PDAT]:2021/04/30[PDAT])) 545,022
5 #1 AND #2 AND #3 AND #4 25
|
本改訂時の新規抽出文献数:25件
抽出後追加文献数:2件
本CQへの新規追加採用文献数:3件(HOVON, PRECIS, JCOG1114C)
|
|

|
| |
|
| ◆文献:(○:本改訂にて追加された文献)(第3版分) |
| 1) |
●Gavrilovic IT, Hormigo A, Yahalom J, et al. Long-term follow-up of high-dose methotrexate-based therapy with and without whole brain irradiation for newly diagnosed primary CNS lymphoma. J Clin Oncol. 2006;24(28):4570-4574 (レベルIIa)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=17008697.
|
|
| 2) |
●DeAngelis LM, Seiferheld W, Schold SC, et al. Combination chemotherapy and radiotherapy for primary central nervous system lymphoma: Radiation Therapy Oncology Group Study 93-10. J Clin Oncol. 2002;20(24):4643-4648 (レベルIIa)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=12488408.
|
|
| 3) |
●Morris PG, Correa DD, Yahalom J, et al. Rituximab, methotrexate, procarbazine, and vincristine followed by consolidation reduced-dose whole-brain radiotherapy and cytarabine in newly diagnosed primary CNS lymphoma: final results and long-term outcome. J Clin Oncol. 2013;31(31):3971-3979 (レベルIIa)
http://www.ncbi.nlm.nih.gov/pubmed/24101038.
|
|
| 4) |
●Omuro A, Correa DD, DeAngelis LM, et al. R-MPV followed by high-dose chemotherapy with TBC and autologous stem-cell transplant for newly diagnosed primary CNS lymphoma. Blood. 2015;125(9):1403-1410 (レベルIIa)
http://www.ncbi.nlm.nih.gov/pubmed/25568347.
|
|
| 5) |
●Reni M, Ferreri AJ, Guha-Thakurta N, et al. Clinical relevance of consolidation radiotherapy and other main therapeutic issues in primary central nervous system lymphomas treated with upfront high-dose methotrexate. Int J Radiat Oncol Biol Phys. 2001;51(2):419-425 (レベルIII)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=11567816.
|
|
| 6) |
●Ferreri AJ, Reni M, Foppoli M, et al. High-dose cytarabine plus high-dose methotrexate versus high-dose methotrexate alone in patients with primary CNS lymphoma: a randomised phase 2 trial. Lancet. 2009;374(9700):1512-1520 (レベルIb)
.
|
|
| 7) |
Ferreri AJ, Cwynarski K, Pulczynski E, et al. Chemoimmunotherapy with methotrexate, cytarabine, thiotepa, and rituximab (MATRix regimen) in patients with primary CNS lymphoma: results of the first randomisation of the International Extranodal Lymphoma Study Group-32 (IELSG32) phase 2 trial. Lancet Haematol. 2016;3(5):e217-227 (レベルIb)
https://www.ncbi.nlm.nih.gov/pubmed/27132696.
|
|
| 8) |
●Rubenstein JL, Hsi ED, Johnson JL, et al. Intensive chemotherapy and immunotherapy in patients with newly diagnosed primary CNS lymphoma: CALGB 50202 (Alliance 50202). J Clin Oncol. 2013;31(25):3061-3068 (レベルIIa)
http://www.ncbi.nlm.nih.gov/pubmed/23569323.
|
|
| 9) |
●Glass J, Won M, Schultz CJ, et al. Phase I and II Study of Induction Chemotherapy With Methotrexate, Rituximab, and Temozolomide, Followed By Whole-Brain Radiotherapy and Postirradiation Temozolomide for Primary CNS Lymphoma: NRG Oncology RTOG 0227. J Clin Oncol. 2016;34(14):1620-1625 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/27022122.
|
|
| 10) |
●Omuro A, Chinot O, Taillandier L, et al. Methotrexate and temozolomide versus methotrexate, procarbazine, vincristine, and cytarabine for primary CNS lymphoma in an elderly population: an intergroup ANOCEF-G
http://www.ncbi.nlm.nih.gov/pubmed/26688235.
|
|
| 11) |
○Mishima K, Nishikawa R, Narita Y, et al. Randomized phase III study of high-dose methotrexate and whole-brain radiotherapy with/without temozolomide for newly diagnosed primary CNS lymphoma: JCOG1114C. Neuro Oncol. 2023;25(4):687-98. (レベルIb)
https://www.ncbi.nlm.nih.gov/pubmed/36334050.
|
|
| 12) |
○Houillier C, Taillandier L, Dureau S, et al. Radiotherapy or Autologous Stem-Cell Transplantation for Primary CNS Lymphoma in Patients 60 Years of Age and Younger: Results of the Intergroup ANOCEF-GOELAMS Randomized Phase II PRECIS Study. J Clin Oncol. 2019;37(10):823-833 (レベルIb)
https://www.ncbi.nlm.nih.gov/pubmed/30785830.
|
|
| 13) |
○Bromberg JEC, Issa S, Bakunina K, et al. Rituximab in patients with primary CNS lymphoma (HOVON 105/ALLG NHL 24): a randomised, open-label, phase 3 intergroup study. Lancet Oncol. 2019;20(2):216-228 (レベルIb)
https://www.ncbi.nlm.nih.gov/pubmed/30630772.
|
|
| 14) |
●Ferreri AJM, Ciceri F, Brandes AA, et al. MATILDE chemotherapy regimen for primary CNS lymphoma: results at a median follow-up of 12 years. Neurology. 2014;82(15):1370-1373 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/24634458.
|
|
| 15) |
●Fritsch K, Kasenda B, Schorb E, et al. High-dose methotrexate-based immuno-chemotherapy for elderly primary CNS lymphoma patients (PRIMAIN study). Leukemia. 2017;31(4):846-852 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/27843136.
|
|
| 16) |
●Laack NN, O'Neill BP, Ballman KV, et al. CHOD/BVAM chemotherapy and whole-brain radiotherapy for newly diagnosed primary central nervous system lymphoma. Int J Radiat Oncol Biol Phys. 2011;81(2):476-482 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/20800387.
|
|

|

|
寛解導入療法:③リツキシマブ
CQ6 PCNSLに対してリツキシマブの併用は推奨されるか?
|

|
| |
推奨
CD20に対するキメラモノクローナル抗体リツキシマブは,大量メトトレキサート(HD-MTX)基盤化学療法に併用することを弱く推奨する。(推奨度2B)
|
|

|
| |
|
解説
|
| |
|
抗CD20キメラモノクローナル抗体リツキシマブは,CD20陽性B細胞性リンパ腫に対して,その有用性が示されており,びまん性大細胞型B細胞リンパ腫ではリツキシマブ併用CHOP療法(R-CHOP療法),濾胞性リンパ腫に対してはリツキシマブ単剤あるいはリツキシマブ併用化学療法が標準治療法となっている。
PCNSLにおいては,血液脳関門を透過しにくいなどの問題点があるものの,近年リツキシマブ併用化学療法の有効性,忍容性がMemorial Sloan-Kettering Cancer Center(MSKCC)1, 2),Cancer and Leukemia Group B (CALGB)3),RTOG4)で実施された第Ⅱ相試験で示された(いずれもレベルIIa)。
さらにIELSGは,MTX基盤化学療法とMTX基盤化学療法にリツキシマブあるいはリツキシマブとチオテパ(適応外)を追加したMATRix療法の3群を比較し、さらに不変(SD)以上の症例をランダム化し全脳照射と自家移植併用大量化学療法(HDC/ASCT)を比較する2X2デザインのランダム化第Ⅱ相試験を実施した。導入療法のランダム化の結果が報告され、主要評価項目のCR割合は,MTX基盤療法(A群)23%に対してリツキシマブ追加群(B群)30%,MATRixレジメン(C群)49%であり,B群(HR 0.74、p=0. 29)では有意な改善は認められず,C群(HR 0.46、p=0.0007)で有意に改善した5)(レベルIb)。ORRはMTX基盤療法(A群)53%に対してリツキシマブ追加群(B群)74%,MATRix(C群) 87%であり、リツキシマブ追加群B群はA群に対し改善がみられた(HR 0.69、p=0.012)。2年PFSはMTX基盤療法(A群)36%、リツキシマブ追加群(B群)46%、MATRix(C群)61%、2年OSはA群42%、B群56%、C群69%であった5)。リツキシマブの追加は、すべてのパラメーターで改善傾向が認められた。
一方、オセアニアとオランダの共同第III相試験(HOVON 105/ALLG NHL 24)では、MTX+BCNU(注射薬は国内未承認)+teniposide(国内非発売)+メチルプレドニゾロン(MBVP)(MBVP)併用療法±リツキシマブの2アーム間(Rなし群100例、Rあり群99例)での寛解導入療法に、60歳以下では減量全脳照射(30 Gy)を行い、1年EFSはMBVP群で49%、R-MBVP群で52%と両群で有意差が認められなかった6)(レベルIb)。しかし、60歳以下の群(地固め全脳照射あり)ではリツキシマブ投与群でEFSが延長する傾向(p=0.054)を認め、逆に60歳超の群(非照射)ではリツキシマブ投与群が不良な傾向(P=0.13)を示した。この2試験の結果からは、リツキシマブの有効性に関しては依然議論の余地が残る。しかし、高度の有害事象は乏しく、近年の初発PCNSLに対する臨床試験の多くでリツキシマブが使用されているのが実情である。したがって、リツキシマブ投与が禁忌でない限り,MTX基盤化学療法にリツキシマブ追加を考慮してもよい。
|

|
| |
|
文献検索式:
|
| |
|
1 (Central Nervous System Neoplasms[MH] AND Lymphoma[MH]) OR ((PCNSL[TIAB] OR "primary central nervous system lymphoma" [TIAB] OR CNS[TIAB] OR (primary[TIAB] AND brain[tiab] AND lymphoma[TIAB]) NOT MEDLINE[SB])) 19,452
2 Rituximab[MH] OR Rituximab[TIAB] 25,996
3 (Randomized Controlled Trial[PT] OR Meta-Analysis[PT] OR Cohort Studies[MH:noexp] OR Follow-Up Studies[MH] OR Prospective Studies[MH] OR Clinical Trial, Phase II[PT] OR Clinical Trial, Phase III[PT] OR Clinical Trial, Phase IV[PT] OR Clinical Trial[PT] OR prospective[TIAB] OR trial[TIAB]) AND (2017/04/01[PDAT]:2021/04/30[PDAT]) 563,276
4 #1 AND #2 AND #3 57
|
本改訂時の新規抽出文献数:57件
抽出後追加文献数:0件
本CQへの新規追加採用文献数:1件(HOVON)
|
|

|
| |
|
| ◆文献:(○:本改訂にて追加された文献)(第3版分) |
| 1) |
●Morris PG, Correa DD, Yahalom J, et al. Rituximab, methotrexate, procarbazine, and vincristine followed by consolidation reduced-dose whole-brain radiotherapy and cytarabine in newly diagnosed primary CNS lymphoma: final results and long-term outcome. J Clin Oncol. 2013;31(31):3971-3979 (レベルIIa)
http://www.ncbi.nlm.nih.gov/pubmed/24101038.
|
|
| 2) |
●Omuro A, Correa DD, DeAngelis LM, et al. R-MPV followed by high-dose chemotherapy with TBC and autologous stem-cell transplant for newly diagnosed primary CNS lymphoma. Blood. 2015;125(9):1403-1410 (レベルIIa)
http://www.ncbi.nlm.nih.gov/pubmed/25568347.
|
|
| 3) |
●Rubenstein JL, Hsi ED, Johnson JL, et al. Intensive chemotherapy and immunotherapy in patients with newly diagnosed primary CNS lymphoma: CALGB 50202 (Alliance 50202). J Clin Oncol. 2013;31(25):3061-3068 (レベルIIa)
http://www.ncbi.nlm.nih.gov/pubmed/23569323.
|
|
| 4) |
●Glass J, Won M, Schultz CJ, et al. Phase I and II Study of Induction Chemotherapy With Methotrexate, Rituximab, and Temozolomide, Followed By Whole-Brain Radiotherapy and Postirradiation Temozolomide for Primary CNS Lymphoma: NRG Oncology RTOG 0227. J Clin Oncol. 2016;34(14):1620-1625 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/27022122.
|
|
| 5) |
●Ferreri AJ, Cwynarski K, Pulczynski E, et al. Chemoimmunotherapy with methotrexate, cytarabine, thiotepa, and rituximab (MATRix regimen) in patients with primary CNS lymphoma: results of the first randomisation of the International Extranodal Lymphoma Study Group-32 (IELSG32) phase 2 trial. Lancet Haematol. 2016;3(5):e217-227 (レベルIb)
https://www.ncbi.nlm.nih.gov/pubmed/27132696.
|
|
| 6) |
○Bromberg JEC, Issa S, Bakunina K, et al. Rituximab in patients with primary CNS lymphoma (HOVON 105/ALLG NHL 24): a randomised, open-label, phase 3 intergroup study. Lancet Oncol. 2019;20(2):216-228 (レベルIb)
https://www.ncbi.nlm.nih.gov/pubmed/30630772.
|
|

|

|
放射線治療の意義と実際
CQ7-a PCNSLに対する放射線治療ではどのような照射野が推奨されるか? |

|
| |
推奨
照射野は眼球進展がない症例では眼球後半部を含んだ全脳を推奨する。眼球進展がある症例では全眼球を含んだ全脳を推奨する。(推奨度1A)
|
|

|
| CQ7-b PCNSLに対する放射線治療ではどのような照射線量が推奨されるか?
|
| |
| ① 寛解導入療法CR後の地固め照射 |
| ② 寛解導入療法PR以下の際や,再発時の救済照射/td>
|
|
③ 薬物療法不適応の際の代替治療としての照射/td>
|
|
④ 緩和照射の場合
|
|
| |
推奨
照射線量は23.4~50 Gy(1回線量1.5~2.0 Gy)を推奨する。ただし,眼球への線量は30~36 Gy程度にとどめる。(推奨度1A)
|
| ① |
大量メトトレキサート(HD-MTX)を基盤とする寛解導入療法CR後の地固め照射では全脳に対して23.4~36 Gy(1回線量1.5~2.0 Gy)を推奨する。(推奨度1B) |
| ② |
HD-MTXを基盤とする寛解導入療法PR以下の場合には,全脳に対して30~45 Gy(1回線量1.5~2.0 Gy),腫瘍床に対しては総線量36~45 Gy程度の照射を推奨する。(推奨度1B) |
| ③ |
HD-MTXを基盤とする寛解導入療法が適応にならない場合には,全脳に対して30~50 Gy(1回線量1.5~2.0 Gy),腫瘍床に対する総線量は40~50 Gyを推奨する。(推奨度1A) |
| ④ |
緩和照射の場合は,全脳に対して30~36 Gy程度(1回線量2.5~3.0 Gy)を推奨する。(推奨度1C) |
|

|
| |
|
解説
|
| |
|
PCNSLは,極めて高い浸潤性増殖性格を持つため,照射野は歴史的に全脳照射が推奨されてきた。実際,国内多施設で行った後方視的研究によると,安全域4 cm以下の局所照射で有意に照射野外再発が多く,また生存期間も短かった1)(レベルIII)。したがって,初回治療で定位放射線照射(STI)などの病巣に限局した局所照射のみを行うことは不適切と考えられる。ただし前述の後方視的研究は1994年以前に治療された症例での検討であるため大量メトトレキサート(HD-MTX)基盤の寛解導入後の局所照射の役割については再考の余地が残されている2)(レベルIII)。
照射線量に関しては,1964~1980年に照射単独治療が施行された198例の解析において,腫瘍局所に総線量50 Gy以上で治療された症例で有意に予後が良好であったとの報告がなされた3)(レベルIV)。しかしながら,PCNSLにおける世界初の前方視的臨床試験であるRTOG 83-15試験では,全脳40 Gy 照射後に20 Gyの局所追加照射が行われたが,生存期間中央値(mOS)は11.6カ月に留まり,追加照射による腫瘍制御や生存期間延長効果は認められなかった4)(レベルIIa)。また,全脳照射線量減量の試みとして,化学療法で完全奏効(CR)となった症例に対して30.6 Gyとする臨床試験が行われたが,対照の全脳照射45 Gyと比較して,3年生存割合が前者で60%に留まり,後者の92%と比べて有意に不良であった。特に,60歳未満の若年症例で有意に再発率増大,生存割合低下が認められた5)(レベルIIa)。この結果は,この試験で使用されたCHOD/BVAM〔シクロホスファミド,ドキソルビシン,ビンクリスチン(VCR),デキサメタゾン/カルムスチン(注射薬は国内未承認),VCR,シタラビン(AraC),メトトレキサート(MTX)〕療法などの MTXを基盤としない化学療法との併用の際には,全脳照射線量30.6 Gyは不十分であることを示唆している。さらに,Yahalomらが提唱する国際リンパ腫放射線治療グループからのガイドラインでは,HD-MTXを基盤をとする寛解導入療法の適応とならない症例における推奨線量は全脳に対して40~50 Gyとしている6) (レベルV)。一方,国内多施設共同で行われた後方視的研究では,全脳照射線量40 Gy以上,腫瘍への局所線量50Gy以上を行っても生存期間延長はみられず,全脳照射線量,腫瘍床への局所線量それぞれとして30~39.9 Gy,40~49.9 Gyが適切であるとしている2)(レベルIII)。これらの結果を踏まえ,HD-MTXを基盤とする寛解導入療法が適応にならない場合の推奨線量は,全脳に対して30~50 Gy(1回線量1.5~2.0Gy),腫瘍床に対する総線量は40~50 Gyとした。
HD-MTXを基盤とする寛解導入療法によりCRを達成した場合,認知機能低下のリスクを低減するため,全脳照射の線量は待機または減量される方向に進んでいる。RTOG 93-10試験では過分割照射36 Gy(1.2 Gy × 2回/日)を行い,従来の45 Gy照射群と同様の治療結果が得られた。しかし,過分割照射による神経毒性の軽減が期待されたが,45 Gy照射群と比べGrade5の神経毒性出現までの期間は遅延するものの,発生率に有意差は認められなかった7)(レベルIIa)。RTOG02-27試験でもRTOG 93-10試験と同様の過分割照射36 Gy(1.2 Gy × 2回/日)が採用され,追跡期間中央値3.6年,2年全生存,無増悪生存割合は80.8%,63.6%という成績が得られた。こちらの試験における認知機能についての解析では,治療後の認知機能は治療前よりも改善し,その後有意な低下は認めなかったとしている8)(レベルIIa)。Memorial Sloan-Kettering Cancer Center(MSKCC)のグループは多剤併用免疫化学療法(R-MPV:リツキシマブ+HD-MTX+プロカルバジン+VCR)でCRとなった症例群に対しては全脳照射の線量を23.4 Gy(1回線量1.8 Gy)に留め,照射後に大量シタラビン(HD-AraC)療法を地固め療法として追加する第II相試験を行った。全52例中31例(60%)でR-MPV療法後にCRとなり減量照射が行われた。主要評価項目である2年無増悪生存期間(PFS)は,減量照射施行例で77%,PFS中央値は7.7年,mOSは未到達であった。全治療終了後の追跡でも,認知機能やMRI上の白質変化に有意な悪化は認めなかった9)(レベルIIa)。ただし線量低減による再発率が悪化する危険性を示唆する研究もあることから現時点では研究レベルであることに留意する必要がある10)(レベルIIa)。Ferreriらは,HD-MTXを基盤とする初期化学療法によりCRを達成したPCNSLに対して,地固め照射として全脳照射を40 Gy以上施行した群と,30〜36 Gyを施行した群について後方視的解析を行った。再発率(前者46%,後者30%),5年無再発率(同51% vs. 50%,p = 0.26)ともに有意差はなく,全脳照射線量は36 Gyが望ましいと報告している11) (レベルIII)。以上より,HD-MTXを基盤とする寛解導入療法によりCRを達成した場合の全脳照射推奨線量は23.4~36 Gyとした。
全脳照射は現在の薬物療法が開発される以前に広く使用されてきた治療法であり、全脳照射後も再発は予防しきれない。一方、自家幹細胞移植(ASCT)支援大量化学療法(HDC)(HDC/ASCT)による地固め療法が、2件のランダム化第II相試験(IESLG32試験、PRECIS試験)にて全脳照射と比較しOSが劣らない結果と、認知機能障害の発生割合が低いことが報告されている12, 13)(レベルIb, Ib)。また、骨髄非破壊的な大量化学療法による地固め療法も地固め全脳照射に劣らない治療成績を示している14)(レベルIIa)。非劣性試験としてドイツで施行された第III相試験(G-PCNSL-SG-1試験)では、HD-MTX(±イホスファミド)療法による寛解導入療法後の地固め療法として、全脳照射(45 Gy)群と非照射群 [CR例は観察、部分奏効(partial response; PR)以下はHD- AraC療法] を比較し、実際に治療された318例での主要評価項目のOSは、mOSが全脳照射群で32.4ヶ月、非照射群で37.1ヶ月 ( HR=1.06、95% CI:0.80-1.40、p=0.71)であったが、非照射群の非劣性は検証されなかった15)(レベルIb)。臨床症状評価の神経毒性は全脳照射群で49%、非照射群で26%と全脳照射群に多く発生した。
その結果、現在の欧米のガイドラインでは、CR例に対しての地固め療法として薬物療法または(減線量での)全脳照射が推奨され(National Comprehensive Cancer Network; NCCN)、60歳以上では非照射が推奨されている(European Association for Neuro-Oncology; EANO)16)(レベルIII)。本邦では60歳以上が82%以上を占め、発症年齢中央値が71歳と多くの初発PCNSLは全脳照射による遅発性中枢神経障害のハイリスクとなることから17)(レベルIII)、寛解導入療法で完全奏効例に対しては、年齢を考慮した上で地固め療法を検討することが一般化してきている。
一方で,HD-MTXを基盤とする寛解導入療法でPR以下の場合には,CRを得られた場合より高線量が必要と考えられている。ドイツのグループによる大規模多施設共同ランダム化第III相試験(G-PCNSL-SG-1試験)では全脳照射45 Gy(1回線量1.5 Gy)が用いられた15, 18)(レベルIb)。MSKCCのグループはHD-MTX療法後に主に45 Gyの全脳照射線量が用いられた場合の認知機能をMTX単独治療群と比較検討し,前者では後者に比べて重篤な認知機能低下を認める症例の割合は有意に高いと報告している19)(レベルIII)。EORTC 20962試験ではHD-MTX療法後に全脳照射線量を30 Gyとし,局所総線量 40 Gyとする研究を行った。治療を行えた51例中,HD-MTX後にCRが得られたのは17例(33%)にとどまったが,mOSは46カ月であった20)(レベルIIa)。Yahalomらが提唱した国際リンパ腫放射線治療グループのガイドラインでは,寛解導入療法の反応が不十分である場合の適切な全脳照射線量は36~45 Gy(1回線量1.5~1.8 Gy)とされている6)(レベルV)。前述の国内多施設後方視的試験では,寛解導入療法にHD-MTX療法を用いた場合の全脳照射線量は30~39.9 Gyが適切であるとしている2)(レベルIII)。これらの結果を踏まえ,寛解導入療法で部分奏効(PR)以下の場合の推奨線量は脳に対して30~45 Gy(1回線量1.5~2.0 Gy),腫瘍床に対しては総線量36~45Gy程度とした。
なお,治療の目的が全身状態が極めて不良な症例に対する緩和である場合は,放射線による晩期有害反応は問題とならないため1回線量を2.5~3.0 Gyとし,総線量30~36 Gy程度まで照射することを推奨する(レベルV)6)。
高齢者PCNSLに対する照射に関しては,本章CQ12を参照のこと。
[注意]
カルムスチン(BCNU):注射薬は国内未承認,脳内留置用剤(徐放性ポリマー)は悪性神経膠腫に対して承認済み
|

|
| |
|
文献検索式:
|
| |
|
1 (Central Nervous System Neoplasms[MH] AND Lymphoma[MH]) OR ((PCNSL[TIAB] OR "primary central nervous system lymphoma" [TIAB] OR CNS[TIAB] OR (primary[TIAB] AND brain[tiab] AND lymphoma[TIAB]) NOT MEDLINE[SB])) 19,452
2 (Radiotherapy[MH] OR Radiotherapy[SH] OR (((radiation[TIAB] AND (therapy[TIAB] OR treatment[TIAB] OR procedure[TIAB])) OR radiotherapy[TIAB]) NOT medline[SB])) 334,162
3 (Randomized Controlled Trial[PT] OR Meta-Analysis[PT] OR Cohort Studies[MH:noexp] OR Follow-Up Studies[MH] OR Prospective Studies[MH] OR Clinical Trial, Phase II[PT] OR Clinical Trial, Phase III[PT] OR Clinical Trial, Phase IV[PT] OR Clinical Trial[PT] OR prospective[TIAB] OR trial[TIAB]) AND (2017/04/01[PDAT]:2021/04/30[PDAT]) 563,276
4 #1 AND #2 AND #3 61
|
本改訂時の新規抽出文献数:61件
抽出後追加文献数:5件(MATRix, PRECIS, CALGB50101, EANO, 成田)
本CQへの新規追加採用文献数:6件(Adhikari)
|
|

|
| |
|
| ◆文献:(第3版分)(○:本改訂にて追加された文献) |
| 1) |
●Shibamoto Y, Hayabuchi N, Hiratsuka J, et al. Is whole-brain irradiation necessary for primary central nervous system lymphoma? Patterns of recurrence after partial-brain irradiation. Cancer. 2003;97(1):128-133 (レベルIII)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=12491514.
|
|
| 2) |
●Shibamoto Y, Sumi M, Takemoto M, et al. Analysis of radiotherapy in 1054 patients with primary central nervous system lymphoma treated from 1985 to 2009. Clin Oncol (R Coll Radiol). 2014;26(10):653-660 (レベルIII)
https://www.ncbi.nlm.nih.gov/pubmed/25034088.
|
|
| 3) |
Murray K, Kun L, Cox J. Primary malignant lymphoma of the central nervous system. Results of treatment of 11 cases and review of the literature. J Neurosurg. 1986;65(5):600-607 (レベルIV)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=3772445.
|
|
| 4) |
●Nelson DF, Martz KL, Bonner H, et al. Non-Hodgkin's lymphoma of the brain: can high dose, large volume radiation therapy improve survival? Report on a prospective trial by the Radiation Therapy Oncology Group (RTOG): RTOG 8315. Int J Radiat Oncol Biol Phys. 1992;23(1):9-17 (レベルIIa)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=1572835.
|
|
| 5) |
●Bessell EM, López-Guillermo A, Villá S, et al. Importance of radiotherapy in the outcome of patients with primary CNS lymphoma: an analysis of the CHOD/BVAM regimen followed by two different radiotherapy treatments. J Clin Oncol. 2002;20(1):231-236 (レベルIIa)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=11773174.
|
|
| 6) |
●Yahalom J, Illidge T, Specht L, et al. Modern radiation therapy for extranodal lymphomas: field and dose guidelines from the International Lymphoma Radiation Oncology Group. Int J Radiat Oncol Biol Phys. 2015;92(1):11-31 (レベルV)
https://www.ncbi.nlm.nih.gov/pubmed/25863750.
|
|
| 7) |
●Fisher B, Seiferheld W, Schultz C, et al. Secondary analysis of Radiation Therapy Oncology Group study (RTOG) 9310: an intergroup phase II combined modality treatment of primary central nervous system lymphoma. J Neurooncol. 2005;74(2):201-205 (レベルIIa)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=16193393.
|
|
| 8) |
Glass J, Won M, Schultz CJ, et al. Phase I and II Study of Induction Chemotherapy With Methotrexate, Rituximab, and Temozolomide, Followed By Whole-Brain Radiotherapy and Postirradiation Temozolomide for Primary CNS Lymphoma: NRG Oncology RTOG 0227. J Clin Oncol. 2016;34(14):1620-1625 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/27022122.
|
|
| 9) |
●Morris PG, Correa DD, Yahalom J, et al. Rituximab, methotrexate, procarbazine, and vincristine followed by consolidation reduced-dose whole-brain radiotherapy and cytarabine in newly diagnosed primary CNS lymphoma: final results and long-term outcome. J Clin Oncol. 2013;31(31):3971-3979 (レベルIIa)
http://www.ncbi.nlm.nih.gov/pubmed/24101038.
|
|
| 10) |
○Adhikari N, Biswas A, Gogia A, et al. A prospective phase II trial of response adapted whole brain radiotherapy after high dose methotrexate based chemotherapy in patients with newly diagnosed primary central nervous system lymphoma-analysis of acute toxicity profile and early clinical outcome. J Neurooncol. 2018;139(1):153-166 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/29633112.
|
|
| 11) |
●Ferreri AJ, Verona C, Politi LS, et al. Consolidation radiotherapy in primary central nervous system lymphomas: impact on outcome of different fields and doses in patients in complete remission after upfront chemotherapy. Int J Radiat Oncol Biol Phys. 2011;80(1):169-175 (レベルIII)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=20584577.
|
|
| 12) |
○Ferreri AJM, Cwynarski K, Pulczynski E, et al. Whole-brain radiotherapy or autologous stem-cell transplantation as consolidation strategies after high-dose methotrexate-based chemoimmunotherapy in patients with primary CNS lymphoma: results of the second randomisation of the International Extranodal Lymphoma Study Group-32 phase 2 trial. Lancet Haematol. 2017;4(11):e510-e523 (レベルIb)
https://www.ncbi.nlm.nih.gov/pubmed/29054815.
|
|
| 13) |
○Houillier C, Taillandier L, Dureau S, et al. Radiotherapy or Autologous Stem-Cell Transplantation for Primary CNS Lymphoma in Patients 60 Years of Age and Younger: Results of the Intergroup ANOCEF-GOELAMS Randomized Phase II PRECIS Study. J Clin Oncol. 2019;37(10):823-833 (レベルIb)
https://www.ncbi.nlm.nih.gov/pubmed/30785830.
|
|
| 14) |
○Rubenstein JL, Hsi ED, Johnson JL, et al. Intensive chemotherapy and immunotherapy in patients with newly diagnosed primary CNS lymphoma: CALGB 50202 (Alliance 50202). J Clin Oncol. 2013;31(25):3061-3068 (レベルIIa)
http://www.ncbi.nlm.nih.gov/pubmed/23569323.
|
|
| 15) |
●Thiel E, Korfel A, Martus P, et al. High-dose methotrexate with or without whole brain radiotherapy for primary CNS lymphoma (G-PCNSL-SG-1): a phase 3, randomised, non-inferiority trial. Lancet Oncol. 2010;11(11):1036-1047 (レベルIb)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=20970380.
|
|
| 16) |
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=20970380
https://www.ncbi.nlm.nih.gov/pubmed/26149884.
|
|
| 17) |
○成田善孝. 脳腫瘍の分類と疫学. 日本臨床. 2021;79(Supplement 1):187-193 (レベルIII).
|
|
| 18) |
●Korfel A, Thiel E, Martus P, et al. Randomized phase III study of whole-brain radiotherapy for primary CNS lymphoma. Neurology. 2015;84(12):1242-1248 (レベルIb)
http://www.ncbi.nlm.nih.gov/pubmed/25716362.
|
|
| 19) |
●Correa DD, Shi W, Abrey LE, et al. Cognitive functions in primary CNS lymphoma after single or combined modality regimens. Neuro Oncol. 2012;14(1):101-108 (レベルIII)
https://www.ncbi.nlm.nih.gov/pubmed/22013168.
|
|
| 20) |
●Poortmans PM, Kluin-Nelemans HC, Haaxma-Reiche H, et al. High-dose methotrexate-based chemotherapy followed by consolidating radiotherapy in non-AIDS-related primary central nervous system lymphoma: European Organization for Research and Treatment of Cancer Lymphoma Group Phase II Trial 20962. J Clin Oncol. 2003;21(24):4483-4488 (レベルIIa)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=14597741.
|
|

|

|
大量化学療法
CQ8 PCNSLに対して自家幹細胞移植を伴う大量化学療法は推奨されるか?
|

|
| |
推奨1
65歳以下の初発PCNSLに対して、大量メトトレキサート(HD-MTX)を基盤とする寛解導入化学療法の後の地固め療法として,自家幹細胞移植併用大量化学療法を提案する。(推奨度2C)
|
|

|
| |
推奨2
再発PCNSLに対する治療法として,殺細胞薬に対する感受性を有していれば自家幹細胞移植併用大量化学療法を提案する。(推奨度2C)
|
|

|
| |
|
解説
|
| |
|
自家幹細胞移植(以下autologous stem cell transplantation:ASCT)を併用した大量化学療法(HDC)がPCNSLの初発,再発ともに試みられている。
初発PCNSLに対するHDC/ASCTは、HD-MTX療法を基盤とする寛解導入化学療法後の地固め療法として行われ、全脳照射なしで長期無増悪生存を維持する可能性がある治療と考えられている。HDC/ASCTは65歳以下が一般的に適応となるが、60歳代後半の全身臓器機能が良い患者では実施を考慮してもよい。
2015年Omuroら,2016年IllerhausらがHD-MTX療法を基盤とする寛解導入化学療法後に地固め療法としてHDC/ASCTを行う第II相試験の結果を報告し,いずれも奏効割合(ORR)が90%以上で,後者のPFSは74カ月を超えた1, 2)。Omuroらの報告は,年齢中央値57歳(範囲23~67)の対象患者32人にR-MPV療法で寛解導入し,前処置としてチオテパ+ブスルファン+シクロホスファミド(TBCレジメン)が用いられた。81%がHDC/ASCTに進み,2年生存割合が81%であった2)(レベルIIa)。Illerhausらの報告は,年齢中央値56歳(範囲51~66)の対象患者79人にリツキシマブ+MTX+チオテパ(適応外)+AraCで寛解導入し,前処置はリツキシマブ/BCNU/チオテパが投与された。92%がHDC/ASCTに進み,3年生存割合が81%だった1)(レベルIIa)。
HDCレジメンは種々あり,PCNSL初発例に対するASCTの成績は前処置によって異なると考えられている。悪性リンパ腫に対するASCTで最も多く用いられている大量化学療法であるBEAMレジメンは、PCNSLに対しても実施可能ではあるものの(本邦ではBCNUの注射薬は国内適応外)、十分な効果が得られなかった3)(レベルIIa)。一方、チオテパを基盤とするもので良好な予後が得られる傾向が認められ、本邦のレジストリー研究でも同様の結果であった4)(レベルⅢ)。本邦でもチオテパはブスルファンとの併用(BuTTレジメン)でASCTの前治療として2020年3月に再承認された。
最近、地固め療法としてのHDC/ASCTと全脳照射の有用性を比較するランダム化第Ⅱ相試験が二つ公表された。いずれも自家移植では全脳照射と比較して、少なくとも同程度の無増悪生存期間(PFS)が得られ、認知機能に及ぼす影響が軽度であることが示された。IELSG32試験(MATRix試験)では(CQ5参照)、寛解導入療法でSD以上の治療効果が得られた患者が全面照射群(36 Gy+boost 9 Gy)とHDC/ASCT群(BCNU+チオテパ)に無作為に割り付けられた。その結果、主要評価項目である2年PFSは全脳照射群80%、HDC/ASCT群69%で有意差は認められなかった(p=0.17)。治療後と2年後の認知機能、QOLの評価では、前頭葉機能検査(WCST: Wisconsin Card Scoring Test)、聴覚性言語学習検査、がん特異的QOL尺度(EORTC QLQ)において、全脳照射群と比較してHDC/ASCT群で改善が認められた5)(レベルIb)。ANOCEF/GOELAMSは、R-MBVP 2サイクル+R-HD-AraC 2サイクルの寛解導入療法後、治療効果に関わらず全脳照射群(40 Gy)とHDC/ASCT群(TBC)にランダム割り付けするPRECIS試験を実施した。主要評価項目であるプロトコール治療が実施できた各群38例における2年PFSは、全脳照射群63%、HDC/ASCT群87%であった。全症例の2年PFSは全面照射群58%、HDC/ASCT群70%、2年OSは全脳照射群75%、HDC/ASCT群66%であった。地固め療法後の認知機能はHDC/ASCT群で不変あるいは改善傾向であったが、全面照射群では悪化が認められた。HDC/ASCTは実施可能な症例に対しては、全面照射と少なくとも同等の治療成績で、認知機能の及ぼす影響は軽度と考えられた6)(レベルIb)。
OSHO-53試験では、大量化学療法レジメンとして日本で承認されている用法・用量と同様のチオテパとブスルファンの併用療法(BuTT)が用いられた。未治療PCNSLに対してHD-MTX療法による寛解導入療法後に地固め療法としてBuTTレジメンによるHDC/ASCTが行われ、2年無イベント生存割合(EFS)は45%であった7)(レベルIIa)。
このように、HDC/ASCTでは、全脳照射に代わるPCNSLの初回治療の地固め療法として期待できる治療成績が報告されているが、これらの臨床試験の対象は60歳代後半までの全身臓器機能が良い患者であるにもかかわらず,0〜10%の治療関連死が報告されていることに留意する必要がある1, 2, 5, 6, 8-10)。このため、十分な管理のもと、専門施設で実施することが必要である。また、HDC/ASCTが自家移植を伴わない強力な化学療法による地固め療法と比較して、優れていることを直接示す根拠はまだなく、臨床試験が行われている(NCT01511562, NCT02531841)。
再発・難治性PCNSLに対するHDC/ASCTは、初回治療の一環としてHDC/ASCTが行われていない患者における選択肢となりうる。しかし、再発・難治性PCNSLに対するHDC/ASCTの前向き臨床試験の報告は少なく、特にHDC/ASCTを行わない対照群と予後を比較した臨床試験は報告されていない。フランスのSocie te Franc aise de Greffe de Moe lle Osseuse-The rapie Cellulaire(SFGM-TC)が行った第II相試験では、再発・難治性PCNSLを対象としてHD-AC+エトポシド(CYVE)による救援化学療法に続いてTBCを用いたHDC/ASCTを行った。43人中27人でHDC/ASCTが実施され、HDC/ASCT実施例での2年PFSは58%であった11)(レベルIIa)。German Cooperative PCNSL study groupが行った第II相試験では、HD-MTX療法後の再発・難治性PCNSLの患者39人[年齢中央値57歳(37~65)]のうち32人がリツキシマブ・BCNU・チオテパを用いたHDC/ASCTに進み,うちASCT後にPRにとどまった6人に全脳照射を実施したところ、2年PFS 46%、2年OSが56.4%であった8)(レベルIIa)。
[注意]
カルムスチン(BCNU):注射薬は国内未承認,脳内留置用剤(徐放性ポリマー)は悪性神経膠腫に対して承認済み
チオテパ:PCNSLに対する寛解導入療法は適応外
|

|
| |
|
文献検索式:
|
| |
|
1 (Central Nervous System Neoplasms[MH] AND Lymphoma[MH]) OR ((PCNSL[TIAB] OR "primary central nervous system lymphoma" [TIAB] OR CNS[TIAB] OR (primary[TIAB] AND brain[tiab] AND lymphoma[TIAB]) NOT MEDLINE[SB])) 19,452
2 (Randomized Controlled Trial[PT] OR Meta-Analysis[PT] OR Cohort Studies[MH:noexp] OR Follow-Up Studies[MH] OR Prospective Studies[MH] OR Clinical Trial, Phase II[PT] OR Clinical Trial, Phase III[PT] OR Clinical Trial, Phase IV[PT] OR Clinical Trial[PT] OR prospective[TIAB] OR trial[TIAB]) AND (2017/04/01[PDAT]:2021/04/30[PDAT]) 563,276
3 ((Transplantation, Autologous[MH] AND Stem Cell Transplantation[MH]) OR (((autologous[tiab] AND transplant*[TIAB]) AND stem[TIAB]) NOT medline[MH])) 22,231
4 #1 AND #2 AND #3 32
|
本改訂時の新規抽出文献数:32件
抽出後追加文献数:2件(OSHO, Soussain08)
本CQへの新規追加採用文献数:4件(PRECIS, Kondo)
|
|

|
| |
|
| ◆文献:(第3版分)(○:本改訂にて追加された文献) |
| 1) |
Omuro A, Correa DD, DeAngelis LM, et al. R-MPV followed by high-dose chemotherapy with TBC and autologous stem-cell transplant for newly diagnosed primary CNS lymphoma. Blood. 2015;125(9):1403-1410 (レベルIIa)
http://www.ncbi.nlm.nih.gov/pubmed/25568347.
|
|
| 2) |
●Illerhaus G, Kasenda B, Ihorst G, et al. High-dose chemotherapy with autologous haemopoietic stem cell transplantation for newly diagnosed primary CNS lymphoma: a prospective, single-arm, phase 2 trial. Lancet Haematol. 2016;3(8):e388-397 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/27476790.
|
|
| 3) |
Abrey LE, Moskowitz CH, Mason WP, et al. Intensive methotrexate and cytarabine followed by high-dose chemotherapy with autologous stem-cell rescue in patients with newly diagnosed primary CNS lymphoma: an intent-to-treat analysis. J Clin Oncol. 2003;21(22):4151-4156 (レベルIIa)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=14615443.
|
|
| 4) |
○Kondo E, Ikeda T, Izutsu K, et al. High-Dose Chemotherapy with Autologous Stem Cell Transplantation in Primary Central Nervous System Lymphoma: Data From the Japan Society for Hematopoietic Cell Transplantation Registry. Biol Blood Marrow Transplant. 2019;25(5):899-905 (レベルIIb)
https://www.ncbi.nlm.nih.gov/pubmed/30664936.
|
|
| 5) |
●Ferreri AJM, Cwynarski K, Pulczynski E, et al. Whole-brain radiotherapy or autologous stem-cell transplantation as consolidation strategies after high-dose methotrexate-based chemoimmunotherapy in patients with primary CNS lymphoma: results of the second randomisation of the International Extranodal Lymphoma Study Group-32 phase 2 trial. Lancet Haematol. 2017;4(11):e510-e523 (レベルIb)
https://www.ncbi.nlm.nih.gov/pubmed/29054815.
|
|
| 6) |
○Houillier C, Taillandier L, Dureau S, et al. Radiotherapy or Autologous Stem-Cell Transplantation for Primary CNS Lymphoma in Patients 60 Years of Age and Younger: Results of the Intergroup ANOCEF-GOELAMS Randomized Phase II PRECIS Study. J Clin Oncol. 2019;37(10):823-833 (レベルIb)
https://www.ncbi.nlm.nih.gov/pubmed/30785830.
|
|
| 7) |
○Montemurro M, Kiefer T, Schuler Schüler F, et al. Primary central nervous system lymphoma treated with high-dose methotrexate, high-dose busulfan/thiotepa, autologous stem-cell transplantation and response-adapted whole-brain radiotherapy: results of the multicenter Ostdeutsche Studiengruppe Hamato-Onkologie OSHO-53 phase II study. Ann Oncol. 2007;18(4):665-671 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/17185743.
|
|
| 8) |
●Kasenda B, Ihorst G, Schroers R, et al. High-dose chemotherapy with autologous haematopoietic stem cell support for relapsed or refractory primary CNS lymphoma: a prospective multicentre trial by the German Cooperative PCNSL study group. Leukemia. 2017;31(12):2623-2629 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/28559537.
|
|
| 9) |
●Kasenda B, Schorb E, Fritsch K, et al. Prognosis after high-dose chemotherapy followed by autologous stem-cell transplantation as first-line treatment in primary CNS lymphoma--a long-term follow-up study. Ann Oncol. 2012;23(10):2670-2675 (レベルIIb)
http://www.ncbi.nlm.nih.gov/pubmed/22473593.
|
|
| 10) |
●Schorb E, Kasenda B, Atta J, et al. Prognosis of patients with primary central nervous system lymphoma after high-dose chemotherapy followed by autologous stem cell transplantation. Haematologica. 2013;98(5):765-770 (レベルIII)
https://www.ncbi.nlm.nih.gov/pubmed/23300179.
|
|
| 11) |
○Soussain C, Hoang-Xuan K, Taillandier L, et al. Intensive chemotherapy followed by hematopoietic stem-cell rescue for refractory and recurrent primary CNS and intraocular lymphoma: Societe Francaise de Greffe de Moëlle Osseuse-Thérapie Cellulaire. J Clin Oncol. 2008;26(15):2512-2518 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/18413641.
|
|

|

|
維持療法
CQ9 寛解導入後の維持療法は推奨されるか?
|

|
| |
推奨1
寛解導入後に、高齢者あるいは患者の状態に応じ地固め療法の代わりに、行うことを提案する。(推奨度2C)
|
|

|
| |
推奨2
寛解導入・地固め療法が完遂された場合には、一般臨床としては行わないことを提案する。(推奨度2C)
|
|

|
| |
|
解説
|
| |
|
維持化学療法は寛解導入療法および地固め療法後に,腫瘍の長期制御を目指して行われる。
複数の第II相試験の結果,特に高齢患者において初期治療の強度を減じ,維持療法を行う意義の可能性が示唆されている。しかし,現時点では初期治療後の維持療法の有用性は第III相試験等による検証がされておらず,さらに臨床試験で検証されるべき治療方策であり,よりレベルの高いエビデンスが集積されるまでは,積極的に推奨される段階ではない。
米国のNew Approaches to Brain Tumor Therapy(NABTT)が実施した第II相試験(NABTT-9607)では,大量メトトレキサート(HD-MTX)療法(8 g/m2)の寛解導入療法で完全奏効(CR)になった症例に対して、HD-MTXによる地固めの後維持療法を施行し,無増悪生存期間(PFS)は12.8カ月であった1)(レベルIIa)。
最近,経口アルキル化剤で維持療法を行う3件の臨床研究が報告された。(1)米国で施行されたNRG Oncologyグループの単アームの第I/II相試験(RTOG0227)で,HD-MTXにリツキシマブ,テモゾロミド(TMZ)を加えた化学療法後,維持療法として多分割照射36 Gyと10サイクルのTMZが処方された。2年生存割合は80.8%,2年PFS割合は63.6%で,遅発性神経毒性は少なく(42例中1例),先行のRTOG 9310試験に比較し有意に優れた治療成績であった2)(レベルIIa)(注:TMZは本邦では適応外のため、保険診療下では実施できない)。放射線線量を減じ維持化学療法を行う本治療の有用性をさらに検証する必要がある。
Nordic Lymphoma Groupは,18~65歳の若年者39例に対してはHD-MTX+シタラビン(AraC)を基盤に,リツキシマブ,イホスファミド,ビンクリスチン(VCR),シクロホスファミド,ビンデシン(VDS),デキサメタゾン,AraCを組み合わせ,強化した導入化学療法,66~75歳の高齢者にはHD-MTX+Ara-Cを基盤にリツキシマブ,TMZ,VDS,デキサメタゾン,AraCを用いた若年者に比べ治療強度を下げた導入化学療法後,奏効した例にはTMZで維持療法をする第II相試験を行った3)。高齢群では導入化学療法を軽くしても若年群との生存期間に有意な差がなく(2年生存割合 55.6% vs. 60.7%,p=0.4),CR後の再発も高齢群で少ない(28% vs. 63%)ことから,TMZで維持療法を行うことが有望な治療法であるとしている(レベルIIa)(本章CQ12を参照)(注:TMZは国内適応外)。
ドイツの単アーム第II相試験では,65歳以上の高齢者を対象とし,リツキシマブ,HD-MTX,プロカルバジン(PCZ),lomustine併用初期寛解導入療法(R-MPL)とPCZによる維持療法を施行し、CR割合35.5 %,部分奏効(PR)割合14 %,PFS中央値10.3カ月,全生存期間中央値20.7カ月であった4) (レベルIIa)(本章CQ13を参照)。
現在海外では,高齢者に対して,フランスでのHD-MTX基盤化学療法(R-MPVA)後CR症例をランダム化し,毎月ごとのリツキシマブ,MTX,TMZ による維持療法を計7サイクルの有無により再発までの期間を比較する第III相試験(BLOCAGE-01試験,NCT02313389)と、欧州での寛解導入R-MP療法後、レナリドミドとPCZの維持療法を比較する第II相試験(FIORELLA試験)(NCT03495960)、およびイスラエルでのブルトン型チロシンキナーゼ(BTK)阻害薬イブルチニブを維持療法に用いた第II相試験(NCT02623010)が行われており、これらの試験による維持療法の有効性の検証が待たれる。また我が国ではJCOG脳腫瘍グループが,初発PCNSLに対してHD-MTX療法後ランダム化し,照射治療群とTMZ併用放射線治療+TMZ維持療法群を比較するランダム化第III相試験(JCOG1114C)を実施したが、試験治療群の生存延長効果は示されなかった5)(レベルIb)。
[注意]
テモゾロミド(temozolomide: TMZ):適応外
lomustine:国内未承認
レナリドミド(lenalidomide):適応外
イブルチニブ(ibrutinib):適応外
cytarabine liposomal;国内未承認
|

|
| |
|
文献検索式:
|
| |
|
1 (Central Nervous System Neoplasms[MH] AND Lymphoma[MH]) OR ((PCNSL[TIAB] OR "primary central nervous system lymphoma" [TIAB] OR CNS[TIAB] OR (primary[TIAB] AND brain[tiab] AND lymphoma[TIAB]) NOT MEDLINE[SB])) 19,452
2 Maintenance Chemotherapy[MH] OR (maintenance[TIAB] NOT medline[SB]) OR Chemotherapy, Adjuvant[MH] 79,637
3 (Randomized Controlled Trial[PT] OR Meta-Analysis[PT] OR Cohort Studies[MH:noexp] OR Follow-Up Studies[MH] OR Prospective Studies[MH] OR Clinical Trial, Phase II[PT] OR Clinical Trial, Phase III[PT] OR Clinical Trial, Phase IV[PT]) AND (2017/04/01[PDAT]:2021/04/30[PDAT]) AND humans[MH] 366,573
4 #1 AND #2 AND #3 1
|
本改訂時の新規抽出文献数:1件
抽出後追加文献数:0件
本CQへの新規追加採用文献数: 1件
|
|

|
| |
|
| ◆文献:(第3版分)(○:本改訂にて追加された文献) |
| 1) |
●Batchelor T, Carson K, O'Neill A, et al. Treatment of primary CNS lymphoma with methotrexate and deferred radiotherapy: a report of NABTT 96-07. J Clin Oncol. 2003;21(6):1044-1049 (レベルIIa)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=12637469.
|
|
| 2) |
●Glass J, Won M, Schultz CJ, et al. Phase I and II Study of Induction Chemotherapy With Methotrexate, Rituximab, and Temozolomide, Followed By Whole-Brain Radiotherapy and Postirradiation Temozolomide for Primary CNS Lymphoma: NRG Oncology RTOG 0227. J Clin Oncol. 2016;34(14):1620-1625 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/27022122.
|
|
| 3) |
●Pulczynski EJ, Kuittinen O, Erlanson M, et al. Successful change of treatment strategy in elderly patients with primary central nervous system lymphoma by de-escalating induction and introducing temozolomide maintenance: results from a phase II study by the Nordic Lymphoma Group. Haematologica. 2015;100(4):534-540 (レベルIIa)
http://www.ncbi.nlm.nih.gov/pubmed/25480497.
|
|
| 4) |
●Fritsch K, Kasenda B, Schorb E, et al. High-dose methotrexate-based immuno-chemotherapy for elderly primary CNS lymphoma patients (PRIMAIN study). Leukemia. 2017;31(4):846-852 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/27843136.
|
|
| 5) |
○Mishima K, Nishikawa R, Narita Y, et al. Randomized phase III study of high-dose methotrexate and whole-brain radiotherapy with/without temozolomide for newly diagnosed primary CNS lymphoma: JCOG1114C. Neuro Oncol. 2023 ;25(4):687-698 (レベルIb)
https://www.ncbi.nlm.nih.gov/pubmed/36334050.
|
|

|

|
髄注療法
CQ10 PCNSLに対する抗がん薬の髄注療法は推奨されるか?
|

|
| |
推奨1
診断時の髄液細胞診が陰性の症例では髄注を行わないことを推奨する。(推奨度1B)
|
|

|
| |
推奨2
診断時の髄液細胞診が陽性の症例では髄注を行うことを提案する。(推奨度2C)
|
|

|
| |
|
解説
|
| |
|
PCNSLはしばしば,くも膜下腔浸潤をきたすため,大量メトトレキサート(HD-MTX)療法にメトトレキサート(MTX)を主とする髄注療法の併用が予防的治療として臨床試験でも施行されてきた。髄注のルートとしては,脳室内Ommaya reservoir,腰椎穿刺などが挙げられる。しかし,症例対照比較後方視的研究では,MTX髄注による生存期間延長,腫瘍制御,神経毒性に関する効果は認められなかった1,2){Ferreri, 2002 #1121;Khan, 2002 #370} (いずれもレベルIII)。その他,シタラビン(AraC)やヒドロコルチゾンも髄注に使用されるが,明らかな治療効果の検証はされていない。
さらに,髄注に伴う合併症としてOmmaya reservoir感染,くも膜炎,白質脳症などが指摘されている。40症例以上の髄腔内播種陽性症例を検討した複数の報告(陽性率は10~20%程度が主)からも,播種陽性による生存予後への影響は否定的な結果が多く3){Kiewe, 2010 #1305} (レベルIII),またHD-MTXや大量シタラビン(HD-AraC)により通常,殺腫瘍細胞効果に足る髄液内濃度が得られるため,現在進行中の臨床試験では,予防的抗がん薬髄注は含まれないことが一般的となっている。
しかし,初期導入療法に髄注を行わない治療法では,同じ化学療法に髄注を加えた場合と比べ,早期にかつ高率に再発を認めたとする小規模の非比較試験の報告もある4,5){Pels, 2009 #430;Pels, 2003 #205} (いずれもレベルIIb)。髄液細胞診陽性のPCNSLに対しては,MTXを主とする抗がん薬髄注療法が行われることもあるのが実情である。リツキシマブの髄注の効果について症例報告が続き,2016年に報告された第II相臨床試験では,全身薬物療法に加えて,リツキシマブ,MTX,AraC,デキサメタゾンを脳室内に投与し,奏効割合が94%と高かった6) (レベルIIb)。
[注意]
リツキシマブ:髄注は国内未承認
|

|
| |
|
文献検索式:
|
| |
|
1 ((Central Nervous System Neoplasms[MH] AND Lymphoma[MH]) OR ((PCNSL[TIAB] OR "primary central nervous system lymphoma" [TIAB] OR CNS[TIAB] OR (primary[TIAB] AND brain[tiab] AND lymphoma[TIAB]) NOT MEDLINE[SB]))) 19,468
2 (Injections, Spinal[MH] OR "spinal injection"[TIAB] OR "intraspinal injection"[TIAB]) 16,962
3 ((Randomized Controlled Trial[PT] OR Meta-Analysis[PT] OR Cohort Studies[MH:noexp] OR Follow-Up Studies[MH] OR Prospective Studies[MH] OR Clinical Trial, Phase II[PT] OR Clinical Trial, Phase III[PT] OR Clinical Trial, Phase IV[PT] OR prospective[TIAB] OR trial[TIAB]) AND (2017/04/01[PDAT]:2021/04/30[PDAT])) 550,335
4 #1 AND #2 AND #3 4
|
本改訂時の新規抽出文献数:4件
抽出後追加文献数:0件
本CQへの新規追加採用文献数: 0件
|
|

|
| |
|
| ◆文献:(第3版分)(○:本改訂にて追加された文献) |
| 1) |
●Ferreri AJ, Reni M, Pasini F, et al. A multicenter study of treatment of primary CNS lymphoma. Neurology. 2002;58(10):1513-1520 (レベルIII)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=12034789.
|
|
| 2) |
Khan RB, Shi W, Thaler HT, et al. Is intrathecal methotrexate necessary in the treatment of primary CNS lymphoma? J Neurooncol. 2002;58(2):175-178 (レベルIII)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=12164690.
|
|
| 3) |
Kiewe P, Fischer L, Martus P, et al. Meningeal dissemination in primary CNS lymphoma: diagnosis, treatment, and survival in a large monocenter cohort. Neuro Oncol. 2010;12(4):409-417 (レベルIII)
https://www.ncbi.nlm.nih.gov/pubmed/20308318.
|
|
| 4) |
Pels H, Juergens A, Glasmacher A, et al. Early relapses in primary CNS lymphoma after response to polychemotherapy without intraventricular treatment: results of a phase II study. J Neurooncol. 2009;91(3):299-305 (レベルIIb)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=18931887.
|
|
| 5) |
●Pels H, Schmidt-Wolf IG, Glasmacher A, et al. Primary central nervous system lymphoma: results of a pilot and phase II study of systemic and intraventricular chemotherapy with deferred radiotherapy. J Clin Oncol. 2003;21(24):4489-4495 (レベルIIb)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=14597744.
|
|
| 6) |
●Qian L, Zhou C, Shen J, et al. Treatment of newly diagnosed B-cell origin primary CNS lymphoma with systemic R-IDARAM chemotherapy and intrathecal immunochemotherapy. Oncotarget. 2016;7(18):25783-25790 (レベルIIb)
https://www.ncbi.nlm.nih.gov/pubmed/27029056
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5041943/pdf/oncotarget-07-25783.pdf .
|
|

|

|
高齢者治療
CQ11 高齢者PCNSLに対してどのような治療法が推奨されるか?
|

|
| |
推奨
遅発性中枢神経障害の発生を軽減するため,高齢者における初発時の治療として,大量メトトレキサート(HD-MTX)療法を基盤とした導入化学療法後完全奏効(CR)となった症例については,全脳照射を待機した治療法を推奨する。(推奨度1B)
|
|

|
| |
|
解説
|
| |
|
60歳以上あるいは70歳以上の高齢者PCNSLに対しての治療は,全脳照射により高率に遅発性中枢神経障害の出現が生じるなど,未だ確立していない。
治療後の遅発性神経毒性は,進行性の認知障害など,腫瘍の再発がなくとも急速に患者のQOLを低下させる主因となり,その原因の一つに全脳照射が挙げられ,近年.高齢者のPCNSLに対する治療の開発動向は非照射化学療法が主体となっている。高齢者ではHD-MTX療法の毒性が懸念されるが,Grade3/4の有害事象は10%未満であり,腎機能,メトトレキサート(MTX)血中濃度のモニターおよび管理を適切にすれば,腎機能に応じた用量の調整を行う必要はあるものの,HD-MTX療法は遂行可能である1) (レベルⅢ)。
60歳以上の初発高齢者PCNSLを対象とした1996〜2014年の前方視的および後方視的研究から13研究(405例)を抽出し,さらに378例を追加した計783例を対象としたメタアナリシス2)の結果では,Karnofsky performance status(KPS)が70%以上で予後が良いことが示されている。また,HD-MTXを基盤とする化学療法により生存期間は延長し,さらに多剤併用HD-MTX療法の方がHD-MTX単独療法より無増悪生存期間(PFS)は有意に改善し.全生存期間(OS)も良好であった。さらにHD-MTXに2剤以上の経静脈的化学療法を加えた積極的治療と,HD-MTXに1剤の経口アルキル化薬〔プロカルバジン(PCZ)あるいはテモゾロミド(TMZ)〕を加えた治療を比較したところ,積極的治療を行っても奏効割合や生存期間に有意な影響は及ぼさないことが示され,HD-MTXには経口アルキル化薬の併用が推奨される結果であった。さらに放射線治療を加えると,とりわけKPS 70%未満の患者に対してはPFS,OSの延長に寄与するが,遅発性神経毒性のリスクが有意に増強することが示されている2) (レベルIII)。この結果から,高齢者にもHD-MTX療法が可能であれば行うべきであり,さらに1剤のアルキル化薬を加えることも勧められる。
PCNSLに対する初の第III相試験であるG-PCNSL-SG-1のサブグループ解析の報告では,HD-MTX基盤化学療法に対する全奏効割合(ORR)(44% vs. 57%,p=0.016),PFS中央値(mPFS)(4カ月 vs. 7.7カ月,p=0.014),OS中央値(mOS)(12.5カ月 vs. 26.2カ月,p<0.001)はいずれも有意に70歳未満に比べ70歳以上の高齢者で不良であった。Grade3/4の白血球減少も高齢者で有意に多かった(34% vs, 21%,p=0.007)。また,化学療法で完全奏効(CR)になった症例でも70歳以上の高齢者では早期に再発しており(16.1カ月 vs. 35カ月,p=0.024),予後改善には地固め療法あるいは維持療法が必要であるとされている3)(レベルIII)。
フランスのグループ(ANOCEF-GOELAMS)は60歳以上の高齢者を対象とした初のランダム化第II相試験で,2つのHD-MTXを基盤とした化学療法レジメンを比較しており,MPV-A 〔MTX+PCZ+ビンクリスチン(VCR),シタラビン(AraC)〕療法のほうがHD-MTX+TMZに比較し,統計的有意差はないもののmPFS 9.5カ月 vs. 6.1 カ月,mOS 31カ月 vs. 14 カ月と治療成績の良いことを報告した4)(レベルIb)。両者の毒性は中等度と差はなく,遅発性神経毒性は認められず,同グループは今後,高齢者のPCNSLに対する標準治療群としてMPV-Aを基本にした治療開発を推奨している。また,本章CQ5で述べたように,少数例ではあるが,R-MPV療法に低線量全脳照射(23.4 Gy)とAraCによる地固めを行う治療5) (レベルⅡa)や,リツキシマブ,HD-MTX,TMZ(MT-R療法)による導入療法後エトポシドとHD-AraC(EA療法)による地固め療法で照射は回避する治療法6) (レベルⅡa)は比較的PSが良い高齢者に対して有望である(本章CQ5参照)。
65歳以上を対象とし,HD-MTX,PCZ,lomustine(国内未承認)に リツキシマブを併用した寛解導入化学療法(R-MPL療法)とPCZによる維持療法を施行したドイツでの単アーム第II相試験(PRIMAIN)においては,CR割合は 35.5 %,部分奏効(PR)割合 14 %,mPFS 10.3カ月,mOS 20.7カ月であった。なお初期治療で感染症の合併症が多かったため途中でプロトコール治療からlomustineが除かれた(R-MP療法)。R-MPL療法とR-MP療法で予後には差はなく,Grade3以上の有害事象はR-MPL療法で87 %,R-MP療法で71.1 %,治療関連死(toxic death)はR-MPL療法で10.1 %,R-MP療法で5.3 %にみられ,高齢者にはR-MP療法が遂行可能であると結論した7)(レベルIIa)。
最近,Nordic Lymphoma Groupは18~65歳の若年群に対してはリツキシマブ,HD-MTX+AraCを基盤に多剤で強化した寛解導入化学療法を行い,66~75歳の高齢群には若年群に比べ治療強度を下げた寛解導入化学療法後,奏効したものにはTMZによる維持治療を行う第II相試験を施行した8)。導入化学療法終了後のORRは若年群69.2%,高齢群80.8%,2年の生存割合は若年群で60.7 %,高齢群 55.6 %,mOSはいずれの年齢群でも未到達であり,2年PFSは若年群で33.1 %,高齢群で44.4 %であった。一方,高齢群では11 % の治療関連死を認め大量シタラビン(HD-AraC)に起因するものであった。生存期間は高齢群において劣っておらず,CR後の再発も高齢者で少ない(28% vs. 63%)ことから,高齢群では若年群よりも導入化学療法の強度を下げ,TMZで維持療法を行うことが期待される治療法であると結論している(レベルIIa)。現在,維持療法の意義に関しては,HD-MTX基盤化学療法(R-MPVA)後CR症例をランダム化し毎月ごとのリツキシマブ,MTX,TMZ による維持療法を計7サイクルの有無で再発までの期間を比較する第III相試験 [ BLOCAGE-01(NCT02313389)] がフランスで行われており,その結果が待たれる。
一方で、65歳を超える臓器機能が保たれPSが良い適切に選択された高齢者に対して、リツキシマブ、HD-MTX, HD-AraCでの寛解導入化学療法後、ブスルファン、チオテパ(BuTT)による自家幹細胞移植支援大量化学療法(HDC/ASCT)を行う前向きpilot試験(MARiTA)がドイツの2施設で施行され、2年PFSは92,2%, 2年OSは92.3%で治療関連死は認めなかったとの良い治療成績の報告がなされた9)(レベルIIb)。この結果を受け、ドイツでは65歳を超える高齢者を対象に、年齢に合わせた寛解導入化学療法後に大量化学療法を行う多施設共同第II相試験(MARTA)が現在施行されており(German clinical trials registry: DRKS00011932)10)、その結果が注目される。
以上より,高齢者PCNSLに対しても腎機能をモニターし毒性を減らす管理を適切に行えば,HD-MTXを基盤とした化学療法は可能である。全脳照射による遅発性中枢神経障害の発生を避けるため,寛解導入化学療法後CRになった症例には,通常線量の全脳照射は回避、または再発まで待機すべきであり,低線量全脳照射(23.4 Gy)は考慮してもよいと考えられる。高齢者は導入化学療法でCRになっても未だPFSは短く,予後改善のためには安全で効果のある地固め療法や維持化学療法の開発が必要と考えられる。
[注意]
lomustine:国内未承認
|

|
| |
|
文献検索式:
|
| |
|
1 (Central Nervous System Neoplasms[MH] AND Lymphoma[MH]) OR ((PCNSL[TIAB] OR "primary central nervous system lymphoma" [TIAB] OR CNS[TIAB] OR (primary[TIAB] AND brain[tiab] AND lymphoma[TIAB]) NOT MEDLINE[SB])) 19,452
2 (Aged[MH] OR elderly[TIAB]) 3,337,041
3 (Randomized Controlled Trial[PT] OR Meta-Analysis[PT] OR Cohort Studies[MH:noexp] OR Follow-Up Studies[MH] OR Prospective Studies[MH] OR Clinical Trial, Phase II[PT] OR Clinical Trial, Phase III[PT] OR Clinical Trial, Phase IV[PT] OR Clinical Trial[PT] OR prospective[TIAB] OR trial[TIAB]) AND (2017/04/01[PDAT]:2021/04/30[PDAT]) 563,276
4 #1 AND #2 AND #3 109
|
本改訂時の新規抽出文献数:109件
抽出後追加文献数:1件
本CQへの新規追加採用文献数:2件(MARTA, MARiTA)
|
|

|
| |
|
| ◆文献:(第3版分)(○:本改訂にて追加された文献) |
| 1) |
●Jahnke K, Korfel A, Martus P, et al. High-dose methotrexate toxicity in elderly patients with primary central nervous system lymphoma. Ann Oncol. 2005;16(3):445-449 (レベルIII)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=15653703.
|
|
| 2) |
●Kasenda B, Ferreri AJ, Marturano E, et al. First-line treatment and outcome of elderly patients with primary central nervous system lymphoma (PCNSL)--a systematic review and individual patient data meta-analysis. Ann Oncol. 2015;26(7):1305-1313 (レベルIII)
http://www.ncbi.nlm.nih.gov/pubmed/25701456.
|
|
| 3) |
●Roth P, Martus P, Kiewe P, et al. Outcome of elderly patients with primary CNS lymphoma in the G-PCNSL-SG-1 trial. Neurology. 2012;79(9):890-896 (レベルIII)
https://www.ncbi.nlm.nih.gov/pubmed/22895585.
|
|
| 4) |
●Omuro A, Chinot O, Taillandier L, et al. Methotrexate and temozolomide versus methotrexate, procarbazine, vincristine, and cytarabine for primary CNS lymphoma in an elderly population: an intergroup ANOCEF-GOELAMS randomised phase 2 trial. Lancet Haematol. 2015;2(6):e251-259 (レベルIb)
http://www.ncbi.nlm.nih.gov/pubmed/26688235.
|
|
| 5) |
●Morris PG, Correa DD, Yahalom J, et al. Rituximab, methotrexate, procarbazine, and vincristine followed by consolidation reduced-dose whole-brain radiotherapy and cytarabine in newly diagnosed primary CNS lymphoma: final results and long-term outcome. J Clin Oncol. 2013;31(31):3971-3979 (レベルIIa)
http://www.ncbi.nlm.nih.gov/pubmed/24101038.
|
|
| 6) |
●Rubenstein JL, Hsi ED, Johnson JL, et al. Intensive chemotherapy and immunotherapy in patients with newly diagnosed primary CNS lymphoma: CALGB 50202 (Alliance 50202). J Clin Oncol. 2013;31(25):3061-3068 (レベルIIa)
http://www.ncbi.nlm.nih.gov/pubmed/23569323.
|
|
| 7) |
●Fritsch K, Kasenda B, Schorb E, et al. High-dose methotrexate-based immuno-chemotherapy for elderly primary CNS lymphoma patients (PRIMAIN study). Leukemia. 2017;31(4):846-852 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/27843136.
|
|
| 8) |
●Pulczynski EJ, Kuittinen O, Erlanson M, et al. Successful change of treatment strategy in elderly patients with primary central nervous system lymphoma by de-escalating induction and introducing temozolomide maintenance: results from a phase II study by the Nordic Lymphoma Group. Haematologica. 2015;100(4):534-540 (レベルIIa)
http://www.ncbi.nlm.nih.gov/pubmed/25480497.
|
|
| 9) |
○Schorb E, Kasenda B, Ihorst G, et al. High-dose chemotherapy and autologous stem cell transplant in elderly patients with primary CNS lymphoma: a pilot study. Blood Adv. 2020;4(14):3378-3381 (レベルIIb)
https://www.ncbi.nlm.nih.gov/pubmed/32722778.
|
|
| 10) |
○Schorb E, Finke J, Ihorst G, et al. Age-adjusted high-dose chemotherapy and autologous stem cell transplant in elderly and fit primary CNS lymphoma patients. BMC Cancer. 2019;19(1):287 (レベルV)
https://www.ncbi.nlm.nih.gov/pubmed/30925912.
|
|

|

|
VRL治療法
CQ12 眼内リンパ腫にはどのような治療法があるか?
|

|
| |
推奨1
眼内リンパ腫の眼内病変は,放射線照射を提案する。(推奨度1C)
|
|

|
| |
推奨2
眼内リンパ腫の眼内病変には,メトトレキサート(MTX)の硝子体注射を提案する(保険適用外)。(推奨度1C)
|
|

|
| |
|
解説
|
| |
|
眼内リンパ腫は,原発性と続発性に分けられる。続発性は全身のリンパ腫の眼内転移であり,主に血行性に脈絡膜に病変を生じる。原発性の眼内リンパ腫は,PCNSLの亜型として位置づけられており,病変は硝子体,網膜および網膜下,視神経に生じる。そのため,現在では原発性眼内リンパ腫を硝子体網膜リンパ腫(primary vitreo-retinal lymphoma:VRL)と呼称することが多い。本ガイドラインは原発性VRLが対象であるが,慣習的に用いられている眼内リンパ腫の呼称を用いる。
PCNSLではしばしば眼内リンパ腫を認める(約10~20%)。腫瘍細胞浸潤は主に硝子体,網膜および網膜下,視神経のいずれにも生じ得る。約半数の症例で霧視感,視野・視覚障害を訴える。したがって,PCNSLに対してはスリットランプ検査を含む眼科的精査が必須であり,International PCNSL Collaborative Group(IPCG)によるステージング精査に含められている1)(レベルV)。また,National Eye Instituteの診断指針にも述べられている2)(レベルV)。脳病変を伴わない眼内リンパ腫単独の症例もあるが,ぶどう膜炎との鑑別がしばしば困難である。硝子体サンプルの細胞診陽性、もしくは異型細胞、IL-10/IL-6>1、IgH遺伝子再構成、フローサイトメトリーの4項目中2項目以上が陽性を基準とすると感度0.929、特異度1.00と有用性が報告されている3)(レベルIII)。また、眼内液を用いて myeloid differentiation primary response gene 88(MYD88)遺伝子変異(MYD88 L265P)を解析することで、硝子体液は感度95%、特異度100%、前房水でも感度67%、特異度100%であったことが報告されている4)(レベルIV)。眼内リンパ腫単独症例は,脳や脳脊髄液(cerebro-spinal fluid:CSF)への浸潤をきたすハイリスク群であり,未治療の場合,脳内への再発の根源となりやすい。
眼球は薬剤の到達性に劣るため,放射線照射もしくはメトトレキサート(MTX)の硝子体内局注療法(保険適用外)が初回治療として用いられる5)(レベルV)。眼内病変に対する治療法としては放射線照射は有効であり,病巣の制御としては優れている6)(レベルIII)。歴史的に,眼内リンパ腫はPCNSLの亜型であることから眼球と脳全体を含む照射野が一般的に使用されてきた7)(レベルIII)。実際,眼内リンパ腫の60~85%で29カ月以内に頭蓋内再発をきたすという報告もある8, 9)(レベルV)。一方で脳に再発してもその時点で治療可能であることから,予防的全脳照射を行わずに,眼球に限局した照射野を用いるという考え方もある5, 10, 11)(レベルV, III, III)。両照射法を比較した臨床研究は存在しないため,その優劣は定まっていない8)(レベルV)。眼球に限局した照射野を用いる場合,多くの症例では両側眼球に腫瘍進展がみられるため,両側眼球を含んだ照射野が用いられる。しかしながら,病変が片眼にのみ限局している場合には,病側に限局した照射野が用いられることもある。その際,対側眼に再発した場合に再度照射が行えるようビーム入射方向を工夫する必要がある。照射線量は30~36 Gy程度が用いられる5, 12)(いずれもレベルV)。
薬物療法に関しては,大量メトトレキサート(HD-MTX)や大量シタラビン(HD-AraC)の全身投与により眼内にも薬剤は到達するが,至適濃度の獲得は不確定であり,再発も多いとされる13)(レベルIIb)。MTXの硝子体内局注療法は,ほぼ100%奏効という有効性を示すが,生存期間の延長効果はみられず,高率で眼合併症をきたし(73%),かつ視力障害も27%の症例で認められるとの報告がある14, 15)(いずれもレベルIII)。また近年では,リツキシマブの硝子体内局注療法も試みられている16)(レベルIV)。眼内リンパ腫を合併するPCNSLの最大の症例集積(221症例の解析)では,眼内リンパ腫を認めないPCNSL症例群の予後と同様であり,眼局所治療により無再発期間は延長するが生命予後は改善しなかったと報告されている10)(レベルIII)。
生命予後は中枢神経病変の有無に依存するため,眼内病変の制御に加えて中枢神経病変の予防が期待される。IPCGによる眼内リンパ腫の後方視的研究では,83症例での治療内容(全身化学療法か全脳照射・硝子体注射などの局所療法)による中枢神経系への再発率や予後の差は明らかではなかったとしている17)(レベルIII)。欧州の多施設共同研究も,同様に78例で眼局所治療群,全身治療群,局所と全身治療の併用群で中枢神経系への再発率や予後の差はなかったとしている18)(レベルIII)。一方で,MTXの硝子体内局注で眼病変消褪後にHD-MTX療法を追加することにより,中枢神経病変の発症が予防される可能性が報告されている19)18)(それぞれレベルIIb, III)。またR-MPV療法(リツキシマブ,MTX+プロカルバジン+ビンクリスチン)と放射線治療の併用も試みられている20)(レベルIII)。17症例を対象とした単アーム試験としてMTX硝子体注入+R-MPV療法+23.4 Gy低線量放射線全脳照射が行われ、4年生存(OS)割合が86.3%、無増悪生存(PFS)割合が74.9%であり、認知障害は1例だけであったことから、併用療法の有用性が示唆されている21)(レベルIIb)。)
新たな治療として、VRLを含むPCNSLの再発・難治例に対する第II相試験としてしリツキシマブとレナリドミド(適応外)併用療法が行われ、寛解導入療法の奏効割合(ORR)が32%であり、眼内病変は35%で完全奏効(CR)を達成したと報告されている22)(レベルIIa)。また、同様にVRLを含むPCNSLの再発・難治例に対する第II相試験としてブルトン型チロシンキナーゼ阻害薬であるイブルチニブ(適応外)単剤を投与し、ORRは59%、眼内病変は完全消失71%、部分消失29%と良好な反応を示したと報告されている23)(レベルIIa)。いずれも探索的試験であり、また対象が再発・難治例であることから、長期予後の解明、併用試験の結果、および初発例での検討が期待される。
したがって,現状では,眼内リンパ腫に対しての標準治療は確立していないが,放射線照射以外の治療法として,眼内病変はMTX硝子体内局注治療で制御可能であり,HD-MTXもしくはR-MPV療法を併用することで中枢神経病変の出現を予防できる可能性がある。現時点では中枢神経病変の有無,年齢や併発疾患などの患者背景,硝子体局所治療による眼合併症などの病状を考慮して,症例により治療選択を行うことが望ましい。
[注意]
メトトレキサート(MTX):眼内(硝子体内)注射は適応外使用
|

|
| |
|
文献検索式:
|
| |
|
1 Intraocular Lymphoma[MH] OR ((vitreoretinal[TIAB] OR subconjunctival[TIAB] OR intraocular) AND lymphoma*[TIAB]) 993
2 (Randomized Controlled Trial[PT] OR Meta-Analysis[PT] OR Cohort Studies[MH:noexp] OR Follow-Up Studies[MH] OR Prospective Studies[MH] OR Clinical Trial, Phase II[PT] OR Clinical Trial, Phase III[PT] OR Clinical Trial, Phase IV[PT] OR Clinical Trial[PT] OR prospective[TIAB] OR trial[TIAB]) AND (2017/04/01[PDAT]:2021/04/30[PDAT]) 562,834
3 #1 AND #2 36
|
本改訂時の新規抽出文献数:36件
抽出後追加文献数:1件(Takaka)
本CQへの新規追加採用文献数:4件(Sousssain, Ghesquieres, Hiemcke-Jiwa)
|
|

|
| |
|
| ◆文献:(第3版分)(○:本改訂にて追加された文献) |
| 1) |
Abrey LE, Batchelor TT, Ferreri AJ, et al. Report of an international workshop to standardize baseline evaluation and response criteria for primary CNS lymphoma. J Clin Oncol. 2005;23(22):5034-5043 (レベルV)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=15955902.
|
|
| 2) |
Nussenblatt RB, Chan CC, Wilson WH, et al. International Central Nervous System and Ocular Lymphoma Workshop: recommendations for the future. Ocul Immunol Inflamm. 2006;14(3):139-144 (レベルV)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=16827214.
|
|
| 3) |
○Tanaka R, Kaburaki T, Taoka K, et al. More Accurate Diagnosis of Vitreoretinal Lymphoma Using a Combination of Diagnostic Test Results: A Prospective Observational Study. Ocul Immunol Inflamm. 2022; 30(6): 1354-1360 (レベルIII)
https://www.ncbi.nlm.nih.gov/pubmed/33793360.
|
|
| 4) |
○Hiemcke-Jiwa LS, Ten Dam-van Loon NH, Leguit RJ, et al. Potential Diagnosis of Vitreoretinal Lymphoma by Detection of MYD88 Mutation in Aqueous Humor With Ultrasensitive Droplet Digital Polymerase Chain Reaction. JAMA Ophthalmol. 2018;136(10):1098-1104 (レベルIV)
https://www.ncbi.nlm.nih.gov/pubmed/30027272.
|
|
| 5) |
●Chan CC, Sen HN. Current concepts in diagnosing and managing primary vitreoretinal (intraocular) lymphoma. Discov Med. 2013;15(81):93-100 (レベルV)
https://www.ncbi.nlm.nih.gov/pubmed/23449111.
|
|
| 6) |
Ferreri AJ, Blay JY, Reni M, et al. Relevance of intraocular involvement in the management of primary central nervous system lymphomas. Ann Oncol. 2002;13(4):531-538 (レベルIII)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=12056702.
|
|
| 7) |
Akpek EK, Ahmed I, Hochberg FH, et al. Intraocular-central nervous system lymphoma: clinical features, diagnosis, and outcomes. Ophthalmology. 1999;106(9):1805-1810 (レベルIII)
https://www.ncbi.nlm.nih.gov/pubmed/10485554.
|
|
| 8) |
●Chan CC, Rubenstein JL, Coupland SE, et al. Primary vitreoretinal lymphoma: a report from an International Primary Central Nervous System Lymphoma Collaborative Group symposium. Oncologist. 2011;16(11):1589-1599 (レベルV)
https://www.ncbi.nlm.nih.gov/pubmed/22045784.
|
|
| 9) |
●Coupland SE, Heimann H, Bechrakis NE. Primary intraocular lymphoma: a review of the clinical, histopathological and molecular biological features. Graefes Arch Clin Exp Ophthalmol. 2004;242(11):901-913 (レベルV)
https://www.ncbi.nlm.nih.gov/pubmed/15565454.
|
|
| 10) |
●Grimm SA, McCannel CA, Omuro AM, et al. Primary CNS lymphoma with intraocular involvement: International PCNSL Collaborative Group Report. Neurology. 2008;71(17):1355-1360 (レベルIII)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=18936428.
|
|
| 11) |
●Teckie S, Yahalom J. Primary intraocular lymphoma: treatment outcomes with ocular radiation therapy alone. Leuk Lymphoma. 2014;55(4):795-801 (レベルIII)
https://www.ncbi.nlm.nih.gov/pubmed/23822539.
|
|
| 12) |
●Yahalom J, Illidge T, Specht L, et al. Modern radiation therapy for extranodal lymphomas: field and dose guidelines from the International Lymphoma Radiation Oncology Group. Int J Radiat Oncol Biol Phys. 2015;92(1):11-31 (レベルV)
https://www.ncbi.nlm.nih.gov/pubmed/25863750.
|
|
| 13) |
Batchelor TT, Kolak G, Ciordia R, et al. High-dose methotrexate for intraocular lymphoma. Clin Cancer Res. 2003;9(2):711-715 (レベルIIb)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=12576439.
|
|
| 14) |
Frenkel S, Hendler K, Siegal T, et al. Intravitreal methotrexate for treating vitreoretinal lymphoma: 10 years of experience. Br J Ophthalmol. 2008;92(3):383-388 (レベルIII)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=18303160.
|
|
| 15) |
●Smith JR, Rosenbaum JT, Wilson DJ, et al. Role of intravitreal methotrexate in the management of primary central nervous system lymphoma with ocular involvement. Ophthalmology. 2002;109(9):1709-1716 (レベルIII)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=12208721.
|
|
| 16) |
Itty S, Pulido JS. Rituximab for intraocular lymphoma. Retina. 2009;29(2):129-132 (レベルIV)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=19202422.
|
|
| 17) |
Grimm SA, Pulido JS, Jahnke K, et al. Primary intraocular lymphoma: an International Primary Central Nervous System Lymphoma Collaborative Group Report. Ann Oncol. 2007;18(11):1851-1855 (レベルIII)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=17804469.
|
|
| 18) |
●Riemens A, Bromberg J, Touitou V, et al. Treatment strategies in primary vitreoretinal lymphoma: a 17-center European collaborative study. JAMA Ophthalmol. 2015;133(2):191-197 (レベルIII)
https://www.ncbi.nlm.nih.gov/pubmed/25412269.
|
|
| 19) |
●Akiyama H, Takase H, Kubo F, et al. High-dose methotrexate following intravitreal methotrexate administration in preventing central nervous system involvement of primary intraocular lymphoma. Cancer Sci. 2016;107(10):1458-1464 (レベルIIb)
https://www.ncbi.nlm.nih.gov/pubmed/27412324.
|
|
| 20) |
●Cheah CY, Milgrom S, Chihara D, et al. Intensive chemoimmunotherapy and bilateral globe irradiation as initial therapy for primary intraocular lymphoma. Neuro Oncol. 2016;18(4):575-581 (レベルIII)
https://www.ncbi.nlm.nih.gov/pubmed/26487691.
|
|
| 21) |
●Kaburaki T, Taoka K, Matsuda J, et al. Combined intravitreal methotrexate and immunochemotherapy followed by reduced-dose whole-brain radiotherapy for newly diagnosed B-cell primary intraocular lymphoma. Br J Haematol. 2017;179(2):246-255 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/28699673.
|
|
| 22) |
○Ghesquieres H, Chevrier M, Laadhari M, et al. Lenalidomide in combination with intravenous rituximab (REVRI) in relapsed/refractory primary CNS lymphoma or primary intraocular lymphoma: a multicenter prospective 'proof of concept' phase II study of the French Oculo-Cerebral lymphoma (LOC) Network and the Lymphoma Study Association (LYSA)dagger. Ann Oncol. 2019;30(4):621-628 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/30698644.
|
|
| 23) |
○Soussain C, Choquet S, Blonski M, et al. Ibrutinib monotherapy for relapse or refractory primary CNS lymphoma and primary vitreoretinal lymphoma: Final analysis of the phase II 'proof-of-concept' iLOC study by the Lymphoma study association (LYSA) and the French oculo-cerebral lymphoma (LOC) network. Eur J Cancer. 2019;117:121-130 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/31279304.
|
|

|

|
再発治療
CQ13 再発PCNSLに対し,どのような治療法が推奨されるか?
|

|
| |
推奨1
大量メトトレキサート(HD-MTX)療法を含む初期治療により長期間の奏効が得られた患者では,HD-MTX療法を含む治療を提案する。(推奨度2C)
|
|

|
| |
推奨2
再発・難治性の患者では、チラブルチニブ単独療法を弱く推奨する。(推奨度2B)
|
|

|
| |
推奨3
初回治療で全脳照射を行っていない場合,もしくは追加照射が可能な場合には再発時に全脳照射を弱く推奨する。(推奨度2B)
|
|

|
| |
|
解説
|
| |
|
PCNSLの多くは初期治療後の完全奏効(CR)にもかかわらず再発を余儀なくされる。また,10%に近い症例では,全身性の再発をきたす。再発時のPCNSLに対する有効な標準治療は未だ確立しておらず,エビデンスレベルの高い前方視的臨床試験も乏しい。
初発時にHD-MTX療法が奏効し,一定の期間の奏効が得られた場合HD-MTX療法を含む二次治療は合理的な選択肢となる。Plotkinらの後方視的解析では,メトトレキサート(MTX)を含む初回治療後,中央値24.4カ月で再発したPCNSLに対して,HD-MTXによる再治療の奏効割合は91%(20/22),2回目の再治療では100%(4/4)であり,全生存期間中央値(mOS)も初回再発後61.9カ月と良好であった1)(レベルIII)。Pentsovaらの後方視的解析でも,MPV(MTX+プロカルバジン+ビンクリスチン)療法に代表されるHD-MTXを含む初回治療に奏効した後,再発した39人に対して,診断後中央値26カ月の時点でHD-MTXを含む再治療(うち6人はHD-MTX単独)の奏効割合(ORR)は85%,CR割合は75%で,無増悪生存期間中央値(mPFS)は16カ月, mOSは41カ月であった2)(レベルIII)。
PCNSLではCD79BやMYD88などの遺伝子の変異が高率にみられ,B細胞受容体(BCR)下流のシグナル伝達系が活性化していることから,ブルトン型チロシンキナーゼ(Bruton’s tyrosine kinase; BTK)阻害薬の効果が期待されている3)。第一世代BTK阻害薬のイブルチニブは、既に複数のリンパ系腫瘍に対し承認されており、BCR下流の遺伝子変異が多いactivated B-cell-like(ABC)型の全身性再発・難治性(relapse/refractory; r/r)びまん性大細胞型B細胞リンパ腫(DLBCL)に対する効果が示されている。
これまで、再発を中心に、一部初発PCNSLに対するイブルチニブの治療効果を探索する臨床試験が欧米で実施された。Memorial Sloan-Kettering Cancer Center(MSKCC)による再発・難治性PCNSL(13例)および二次性中枢神経系リンパ腫(SCNSL)(計20例)を対象としたイブルチニブの単施設第I相試験では、再発・難治性PCNSLに対するORR 77%(CR 5例、PR 5例)で、mPFSは4.6か月、mOSは15か月であった。BTKの下流に位置するCARD11変異例(1例)で増悪が認められ、CD79B/MYD88の同時変異例ではCRが得られなかった。また真菌感染を1例認めた4)(レベルIIb)。米国国立衛生研究所(NIH)が実施したイブルチニブの第Ib相試験(初発および再発・難治性PCNSL計18例)では、イブルチニブ単剤のORRは89%であった。イブルチニブはDA-TEDDI-R併用療法(TMZ+エトボシド+liposomal doxorubicin+デキサメタゾン+リツキシマブ+AraC髄注)の一部として使用され、再発・難治性PCNSLでのmPFSは15.3か月、mOSは未到達(51%生存)であったが、初発5例の成績は不十分であり、全体として毒性も強く(肺アスペルギルス症2例、敗血症1例)、治療関連死は3例(17%)に認めた5)(レベルIIb)。また、フランスのLymphoma study association (LYSA) とthe French oculo-cerebral lymphoma (LOC) networkのインターグループはイブルチニブ単独の多施設共同単アーム第II相試験(iLOC)を52例の再発・難治性PCNSLに対し行い、ORRは52%(CR 19%)、mPFS 3.3か月、mOS 14.4か月とMSKCCの結果と同様で、2例で肺アスペルギルス症(1例死亡)が発生した6)(レベルIIa)。これらの結果から、イブルチニブは再発PCNSLに対し少なくとも半数以上の患者で奏効が期待されるが、一方で効果持続期間は十分ではなく、mPFSは5か月程度に留まっている。さらに、肺アスペルギルス症や心房細動や出血等を含めた合併症リスクは安全性上重要な懸念点であり、一部はイブルチニブのオフターゲット効果の可能性が指摘されている7)(レベルIII)。
本邦では、よりBTKへの選択性を高め、オフターゲット効果の減弱が期待される第二世代BTK阻害薬チラブルチニブが開発され8)(レベルIV)、計44例の再発・難治性PCNSLを対象に第I/II相治験が実施された9)(レベルIIa)。登録患者全体のORR 64%、mPFS 2.9ヶ月であったが、推奨用量の480 mg/日空腹時服用(承認用法・用量)群ではORR 53%、CR割合35%、mPFS 5.8か月、mOS未到達と一定の有効性が認められた。一方MYD88、CD79B、CARD11の各遺伝子変異と奏効間に明らかな関連は認められなかった。480 mg/日空腹時服用群で高頻度にみられた有害事象は、発疹(35%)、好中球減少(20%)、リンパ球減少(18%)であった。Grade3以上の事象では好中球減少12%、リンパ球減少12%、発疹6%、斑状丘疹状皮疹6%と、高度の有害事象は乏しかったが、1例(承認外の用法)で気管支肺アスペルギルス症とニューモシスチス肺炎を合併し、治療関連死を認めた。不整脈や出血性合併症は認められず9)(レベルIIa)、この結果をもって2020年3月に再発・難治性PCNSLに対し承認された。再発の際に通常用いられるHD-MTX基盤療法との比較、チラブルチニブの適切な使用方法や有効性を予測するバイオマーカーの検討が今後の課題である。
この他に再発PCNSLに対して効果が確認されている治療に,大量シタラビン(HD-AraC)療法やHD-AraCを含む多剤併用化学療法が挙げられる。Soussainらは,再発・難治性PCNSLに対してHD-AraC療法とエトポシド(VP-16)の併用療法(CYVE)を行い,22人中8人でCR,4人で部分奏効(PR)が得られ,その後,自家幹細胞移植併用大量化学療法(HDC/ASCT)が行われた10)(レベルIII)。全身性非ホジキンリンパ腫の再発・難治例に対して広く用いられているHD-AraC療法を含む多剤併用化学療法(ESHAP療法やDHAP療法)の再発PCNSLに対する有効性が,後方視的研究により示唆されている(22例,ORR 59%) 11)(レベルIII)。また,再発PCNSLを対象としたHD-MTX療法やHD-AraC療法を含まない多剤併用化学療法として,リツキシマブ,イホスファミド+VP-16併用(R-IE)療法の有用性も後方視研究により示唆されている12)(レベルIII)。なお,再発時のHDC/ASCTについては,本章CQ8を参照のこと。
再発に対して放射線治療は有効な救済治療である13)(レベルIII)が、未治療例と同様に再発例においても全脳照射後の症候性白質脳症が懸念される。このため、全脳照射はあくまでも一時的な症状改善などを目標として実施される。再発あるいは治療抵抗性PCNSLに対し全脳照射単独療法は画像上の奏効割合が74~79%と報告されており,照射後のmOSは10.9~16カ月である14-16)(レベルIV, III, III )。その照射法については,初回治療に全脳照射が使われなかった場合と使われた場合に分けて考える必要がある。前者の場合は初回治療に準じ,全脳照射を軸として考える必要がある。後者の場合には,初回治療で用いられた線量によっては全脳への再照射は困難な場合が多い。その場合は定位照射を含めた局所照射が行われることがある17)(レベルIII)。
再発PCNSLに対して,TMZ(国内ではPCNSLに対しては適応外)単独療法は26%の奏効割合を示し18) (レベルIIa)、リツキシマブとの併用では、第II相試験でORR 53%,mOS 14カ月との報告があるが19)(レベルIIb)、PCNSLに対しては適応外であり、保険診療下で用いられることはない。
その他の新規治療薬としては,PCNSLの一部ではPD-L1遺伝子異常に伴いPD-L1の発現が亢進していることから,抗PD-1抗体などの免疫チェックポイント阻害薬の効果が期待された。しかし、再発・難治性PCNSLを対象としたニボルマブの第II相試験(CheckMate 647, NCT02857426)では、ORR 6.4%に留まった。
[注意]
テモゾロミド(TMZ):国内適応外
|

|
| |
|
文献検索式:
|
| |
|
1 (Central Nervous System Neoplasms[MH] AND Lymphoma[MH]) OR ((PCNSL[TIAB] OR "primary central nervous system lymphoma" [TIAB] OR CNS[TIAB] OR (primary[TIAB] AND brain[tiab] AND lymphoma[TIAB]) NOT MEDLINE[SB])) 19,450
2 Neoplasm Recurrence, Local[MH] OR recurrence*[TIAB] OR relapse*[TIAB] 538,056
3 (Randomized Controlled Trial[PT] OR Meta-Analysis[PT] OR Cohort Studies[MH:noexp] OR Follow-Up Studies[MH] OR Prospective Studies[MH] OR Clinical Trial, Phase II[PT] OR Clinical Trial, Phase III[PT] OR Clinical Trial, Phase IV[PT] OR Clinical Trial[PT] OR prospective[TIAB] OR trial[TIAB]) AND (2017/04/01[PDAT]:2021/04/30[PDAT]) NOT (Animals[MH] NOT Humans[MH]) 556,303
4 #1 AND #2 AND #3 86
|
本改訂時の新規抽出文献数:86件
抽出後追加文献数:4件(Grommes, Lionakis, Owen, Yasuhiro)
本CQへの新規追加採用文献数:7件(Soussain, Grommes, Narita)
|
|

|

|
| |
|
| ◆文献(第3版分):(○:本改訂にて追加された文献) |
| 1) |
●Plotkin SR, Betensky RA, Hochberg FH, et al. Treatment of relapsed central nervous system lymphoma with high-dose methotrexate. Clin Cancer Res. 2004;10(17):5643-5646 (レベルIII)
http://www.ncbi.nlm.nih.gov/pubmed/15355887.
|
|
| 2) |
Pentsova E, Deangelis LM, Omuro A. Methotrexate re-challenge for recurrent primary central nervous system lymphoma. Journal of neuro-oncology. 2014;117(1):161-165 (レベルIII)
https://www.ncbi.nlm.nih.gov/pubmed/24481997.
|
|
| 3) |
○Grommes C, Nayak L, Tun HW, et al. Introduction of novel agents in the treatment of primary CNS lymphoma. Neuro Oncol. 2019;21(3):306-313 (レベルIII)
https://www.ncbi.nlm.nih.gov/pubmed/30423172.
|
|
| 4) |
○Grommes C, Pastore A, Palaskas N, et al. Ibrutinib Unmasks Critical Role of Bruton Tyrosine Kinase in Primary CNS Lymphoma. Cancer discovery. 2017;7(9):1018-1029 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/28619981.
|
|
| 5) |
○Lionakis MS, Dunleavy K, Roschewski M, et al. Inhibition of B Cell Receptor Signaling by Ibrutinib in Primary CNS Lymphoma. Cancer Cell. 2017;31(6):833-843 e835 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/28552327.
|
|
| 6) |
○Soussain C, Choquet S, Blonski M, et al. Ibrutinib monotherapy for relapse or refractory primary CNS lymphoma and primary vitreoretinal lymphoma: Final analysis of the phase II 'proof-of-concept' iLOC study by the Lymphoma study association (LYSA) and the French oculo-cerebral lymphoma (LOC) network. Eur J Cancer. 2019;117:121-130 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/31279304.
|
|
| 7) |
○Owen C, Berinstein NL, Christofides A, et al. Review of Bruton tyrosine kinase inhibitors for the treatment of relapsed or refractory mantle cell lymphoma. Curr Oncol. 2019;26(2):e233-e240 (レベルIII)
https://www.ncbi.nlm.nih.gov/pubmed/31043832.
|
|
| 8) |
○Yasuhiro T, Sawada W, Klein C, et al. Anti-tumor efficacy study of the Bruton's tyrosine kinase (BTK) inhibitor, ONO/GS-4059, in combination with the glycoengineered type II anti-CD20 monoclonal antibody obinutuzumab (GA101) demonstrates superior in vivo efficacy compared to ONO/GS-4059 in combination with rituximab. Leuk Lymphoma. 2017;58(3):699-707 (レベルIV)
https://www.ncbi.nlm.nih.gov/pubmed/27684575.
|
|
| 9) |
○Narita Y, Nagane M, Mishima K, et al. Phase I/II study of tirabrutinib, a second-generation Bruton's tyrosine kinase inhibitor, in relapsed/refractory primary central nervous system lymphoma. Neuro Oncol. 2021;23(1):122-133 (レベルIIa)
https://www.ncbi.nlm.nih.gov/pubmed/32583848.
|
|
| 10) |
●Soussain C, Suzan F, Hoang-Xuan K, et al. Results of intensive chemotherapy followed by hematopoietic stem-cell rescue in 22 patients with refractory or recurrent primary CNS lymphoma or intraocular lymphoma. J Clin Oncol. 2001;19(3):742-749 (レベルIII)
https://www.ncbi.nlm.nih.gov/pubmed/11157026.
|
|
| 11) |
●del Rio MS, Choquet S, Hoang-Xuan K, et al. Platine and cytarabine-based salvage treatment for primary central nervous system lymphoma. J Neurooncol. 2011;105(2):409-414 (レベルIII)
https://www.ncbi.nlm.nih.gov/pubmed/21656329.
|
|
| 12) |
●Mappa S, Marturano E, Licata G, et al. Salvage chemoimmunotherapy with rituximab, ifosfamide and etoposide (R-IE regimen) in patients with primary CNS lymphoma relapsed or refractory to high-dose methotrexate-based chemotherapy. Hematol Oncol. 2013;31(3):143-150 (レベルIII)
https://www.ncbi.nlm.nih.gov/pubmed/23161567.
|
|
| 13) |
●Langner-Lemercier S, Houillier C, Soussain C, et al. Primary CNS lymphoma at first relapse/progression: characteristics, management, and outcome of 256 patients from the French LOC network. Neuro Oncol. 2016;18(9):1297-1303 (レベルIII)
https://www.ncbi.nlm.nih.gov/pubmed/26951382.
|
|
| 14) |
●Gerstner ER, Batchelor TT. Primary central nervous system lymphoma. Arch Neurol. 2010;67(3):291-297 (レベルIV)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=20212226.
|
|
| 15) |
Hottinger AF, DeAngelis LM, Yahalom J, et al. Salvage whole brain radiotherapy for recurrent or refractory primary CNS lymphoma. Neurology. 2007;69(11):1178-1182 (レベルIII)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=17846417.
|
|
| 16) |
Khimani NB, Ng AK, Chen YH, et al. Salvage radiotherapy in patients with recurrent or refractory primary or secondary central nervous system lymphoma after methotrexate-based chemotherapy. Ann Oncol. 2011;22(4):979-984 (レベルIII)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=20935059.
|
|
| 17) |
●Shin SM, Silverman JS, Bowden G, et al. Relapsed or refractory primary central nervous system lymphoma radiosurgery: Report of the International Gamma Knife Research Foundation. J Radiosurg SBRT. 2017;4(4):247-253 (レベルIII)
https://www.ncbi.nlm.nih.gov/pubmed/29296450.
|
|
| 18) |
Reni M, Mason W, Zaja F, et al. Salvage chemotherapy with temozolomide in primary CNS lymphomas: preliminary results of a phase II trial. Eur J Cancer. 2004;40(11):1682-1688 (レベルIIa)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=15251157.
|
|
| 19) |
Enting RH, Demopoulos A, DeAngelis LM, et al. Salvage therapy for primary CNS lymphoma with a combination of rituximab and temozolomide. Neurology. 2004;63(5):901-903 (レベルIIb)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=15365145.
|
|

|

|

|
| |

|
|



